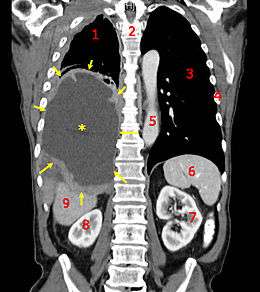
Un cancer (ou tumeur maligne) est une maladie caractérisée par une prolifération cellulaire (tumeur) anormalement importante au sein d'un tissu normal de l'organisme, de telle manière que la survie de ce dernier est menacée. Toutes ces cellules dérivent d'un même clone, cellule initiatrice du cancer qui a acquis certaines caractéristiques lui permettant de se diviser indéfiniment. Au cours de l'évolution de la maladie, certaines cellules peuvent migrer de leur lieu de production et former des métastases. Pour ces deux raisons, le dépistage du cancer doit être le plus précoce possible.
« Cancer » est un terme général désignant une maladie pour lesquelles certaines cellules d'un organisme adoptent un comportement anormal caractérisé par :
une indépendance vis-à-vis des signaux qui stimulent normalement la multiplication des cellules ; une insensibilité aux signaux et mécanismes anti-prolifératifs ; une capacité proliférative qui n'est plus limitée (croissance à l'infini) ; la disparition du phénomène d'apoptose ; une capacité anormale à susciter l'angiogenèse ; et l'acquisition d'un pouvoir invasif et de production de métastases.
Les nouvelles cellules résultantes, dites « cancéreuses » ou « tumorales », peuvent former une tumeur maligne (un néoplasme) ou se propager à travers le corps.
Les facteurs de risques sont internes (génome, mutation, etc.), induction par un agent infectieux, etc. et/ou externes (alimentation, exposition à des substances cancérigènes ou à des conditions telles que l'irradiation, etc.). Le nombre de multiplication des cellules d'un tissu donné au cours de la vie est fortement corrélé au risque de cancer, d'après une étude publiée dans Science et portant sur 31 localisations possibles du cancer les 2/3 de la variation du risque (et non pas les 2/3 des cas de cancers comme l'ont souvent rapportée les médias) entre ces localisations s'expliqueraient par des mutations aléatoires, le reste se partageant entre facteurs environnementaux et génétiques.
Des facteurs hormonaux, et épigénétiques sont possibles. Des études scientifiques concluent que seul 5 à 10 % des cas de cancer sont uniquement attribués à des facteurs génétiques contre 25 à 30 % au tabagisme, 30 à 35 % aux régimes alimentaires (dont l'alcool), 15 à 20 % aux infections, et 10 à 25 % aux autres facteurs (rayons ionisants, stress, activité physique insuffisante, pollution de l'environnement). Ces chiffres sont en réalité trompeurs : comme toute pathologie le cancer est le résultat d'une interaction complexe entre l'environnement et l'individu, or les recherches actuelles ont du mal à identifier des facteurs de risques génétiques uniquement lié à un facteur environnemental ou comportemental. Certaines études mettent par exemple en relief certaines prédispositions génétiques du cancer qui ne favoriseraient l'apparition de la maladie qu'en cas de facteur externe : les obèses diabétiques ne seraient pas tous égaux face au risque de cancer selon leurs gènes. Des études futures vont sans doute permettre de mieux comprendre l’interaction entre l'environnement et la génétique.
Durant la dernière décennie, plusieurs types de cancers semblent en augmentation, si dans certains cas cette progression est facilement liée à des facteurs de risque identifiés (tabac, alcool, polluants industriels reconnus cancérigènes, obésité, sédentarité, exposition au soleil) dans certains cas il est difficile d'attribuer à des facteurs précis l'augmentation observée. L'amélioration des outils de diagnostic et le vieillissement de la population expliquent une part importante de la progression de l'incidence de certains cancers. À l'inverse une étude de l'Institut de veille sanitaire montre que les cancers de l'estomac, de l’œsophage (chez l'homme), du col de l'utérus et le lymphome hodgkinien ont régressé entre 1980 et 2000.
Terminologie et étymologie
L'oncologie est la spécialité qui étudie les cancers. Elle est souvent confondue, par les médecins eux-mêmes et par le public, avec la branche médicale de la cancérologie, qui diagnostique et traite les cancers. Les cancérologues peuvent être, selon leur spécialité, chimiothérapeutes ou radiothérapeutes. Du fait d'une image négative sur le pronostic auprès du public, le cancer a de nombreux synonymes employés par les médecins : tumeur maligne, néoplasie, néoplasme, polymitose, carcinome, etc. Certains termes sont plus répandus dans la langue populaire : tumeur, crabe, etc.
Du latin cancer (« crabe, chancre, cancer »), apparenté au grec καρκινος, karkinos (« écrevisse »). Ce nom aurait été donné par Hippocrate, parce que le cancer « a des veines étendues de tous côtés, de même que le crabe a des pieds ». La même source (Paul d'Égine) ajoute que « son nom lui vient, selon quelques-uns, de ce que quand il s'est emparé d'un organe, il ne le lâche plus, de même que fait le crabe quand il s'est attaché à quelque chose ».
Biologie
Quand des cellules normales sont endommagées et qu'elles ne peuvent pas être soignées, elles meurent : c'est l'apoptose. Les cellules cancéreuses ne meurent pas et continuent de se développer.
Typologie
Il existe généralement :
les carcinomes : cancer d'un épithélium, c'est-à-dire une surface composée uniquement de cellules ;
les sarcomes : cancers proliférant dans des tissus conjonctifs comme les os ;
les cancers hématopoïétiques : cancer des cellules sanguines.
Il existe un classement selon les organes touchés, par exemple :
le cancer du sein ;
le cancer du côlon : cancer du côlon et, proche, celui du rectum ;
le cancer du pancréas ;
le myélome multiple : cancer de la moelle osseuse ;
les leucémies : cancers du sang ;
le sarcome de Kaposi : cancer des vaisseaux sanguins ;
lymphomes : maladie de Hodgkin et lymphome non-hodgkinien ;
le cancer des testicules ;
le cancer des poumons, causé le plus souvent par la cigarette, l'amiante ou autres.
Il existe presque autant de sources de cancer que de tissus dans l'organisme. Certains sont toutefois plus fréquents que d'autres.
Génétique
D'un point de vue pathologique, les cancers sont des maladies génétiques, c'est-à-dire qu'ils ont pour origine une modification quantitative et/ou qualitative de nos gènes. Comme il s'agit d'altérations génétiques somatiques qui ne sont présentes que dans le tissu malade, la plupart des cancers ne sont donc pas eux-mêmes héréditaires, seul un terrain plus ou moins favorable pouvant l'être. Les cancers familiaux (10 % des cancers humains) sont associés à une altération constitutionnelle (ou germinale) d'un gène. Cette altération est donc présente dans toutes les cellules de l'organisme, gamètes inclus. Elle peut être transmise à la descendance.
Il y a trois grandes catégories de gènes associés aux maladies cancéreuses : les oncogènes, les gènes suppresseurs de tumeurs et les gènes de réparation de l'ADN.
Les oncogènes (appelés proto-oncogènes lorsqu'ils sont dans leur état normal et oncogènes lorsqu'ils sont mutés, ou c-onc) sont les régulateurs positifs de la prolifération cellulaire. Ils deviennent hyperactifs et leur modification est dominante car il suffit qu'une des deux copies du gène soit modifiée. On a identifié actuellement plus de cent oncogènes. Les plus connus sont les gènes Ha-ras, myc, ou abl.
La seconde catégorie comprend les gènes suppresseurs de tumeurs qui sont des régulateurs négatifs de la prolifération cellulaire (les freins). Les deux copies de ces gènes sont inactivées dans les cancers.
La troisième catégorie correspond aux gènes des multiples systèmes de réparation qui sont capables de détecter et de réparer les lésions de l'ADN qui ont modifié les oncogènes ou les gènes suppresseurs de tumeur. Ces systèmes de réparation sont également inactivés dans les cellules cancéreuses.
Transformation cellulaire
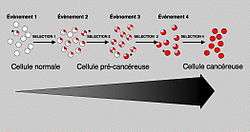
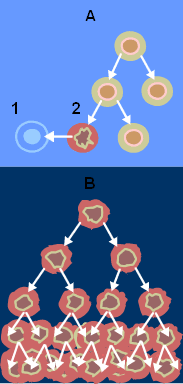
Durant toute la vie cellulaire, notre patrimoine génétique (l'acide désoxyribonucléique ou ADN) est soumis à des agressions. Dans la majeure partie des cas, ces modifications de l'ADN passent inaperçues car des mécanismes réparateurs corrigent ces défauts. Pourtant, dans de rares cas, une mutation peut atteindre et modifier la structure d'un gène spécifiant un facteur qui règle le contrôle de la multiplication cellulaire (oncogène ou gène suppresseur de tumeur). Dans ce cas, la cellule peut acquérir un avantage sélectif qui lui permettra de donner naissance à un premier clone de cellules anormales (lésion précancéreuse). Dans ces cellules qui ont un avantage sélectif, la probabilité qu'une seconde mutation apparaisse et soit sélectionnée est plus importante. Dans ce cas, une seconde population sera générée, plus anormale que la première et qui va se développer à ses dépens. On peut ainsi, par diverses étapes successives, accumuler plusieurs mutations, chacune d'entre elles permettant la sélection d'un clone de plus en plus malin pour finir par une cellule hautement cancéreuse. La progression tumorale correspond donc à un processus dynamique qui, à chaque étape, sélectionne une nouvelle cellule ayant subi une ou plusieurs altérations.
La transformation cellulaire correspond au passage d'une cellule eucaryote normale vers une cellule eucaryote cancéreuse.
Contrairement aux maladies génétiques comme la mucoviscidose, les myopathies ou certaines hémophilies qui sont des maladies monogéniques (un seul gène est généralement altéré), le cancer est une maladie multigénique. Chaque cancer a pour origine l'altération de 10 à 20 gènes. Ces altérations se produisent de manières successives, chacune d'entre elles favorisant la suivante (voir encadré). Cette suite d'altérations se produit généralement sur une très longue plage chronologique (5 à 20 ans); elle n'est pas aléatoire et pour chaque type de cancer, on a pu mettre en évidence d'une part une certaine spécificité des gènes altérés et d'autre part une chronologie dans le développement des évènements.
Dans les cancers du côlon, cette succession d'événements comprend (entre autres) tout d'abord l'inactivation du gène suppresseur de tumeur APC, puis une mutation de l'oncogène Ha-ras suivi de l'inactivation du gène suppresseur de tumeur P53. Il y a d'autres événements qui restent à identifier. Le point essentiel est la spécificité des gènes altérés et leur chronologie. Dans un autre type de cancer, les gènes impliqués et la chronologie sont totalement différents. APC n'est altéré que dans les cancers du côlon et jamais dans les cancers de la peau. Par contre l'altération de P53 peut être retrouvée dans pratiquement tous les types de cancers. Dans le cancer de la peau, contrairement au cancer du côlon, l'altération du gène P53 est l'un des premiers événements. Cette très grande diversité génétique est à la base de l'hétérogénéité de la pathologie cancéreuse. À l'intérieur même d'un type de cancer particulier comme le cancer bronchique, existent plusieurs sous-types (cancer bronchique à petites cellules, adénocarcinome, cancer bronchique à grandes cellules, etc.) chacun étant associé à des altérations génétiques particulières. La situation est identique pour d'autres cancers comme celui du sein, de l'estomac ou de la peau, chaque organe pouvant être associé à plusieurs types de cancers suivant le type histologique de la cellule ayant été à l'origine de la maladie.
Origine
Environ 15 % des cancers humains peuvent être associés à des agents infectieux. Cela peut être des virus (virus de l'hépatite B et cancer du foie, papillomavirus humain et cancer du col de l'utérus, virus d'Epstein-Barr et lymphome de Burkitt), plus rarement des bactéries (Helicobacter et cancer gastrique) ou encore plus rarement des parasites (Schistosomes et cancer du foie). Dans tous ces cas, outre l'infection, on trouve également des altérations d'oncogènes ou de gènes suppresseurs dans les tumeurs. L'agent infectieux n'intervient qu‘à une étape du processus de transformation cellulaire.
L'origine des altérations qui modifient les oncogènes et les gènes suppresseurs de tumeurs est multiple. On les classe généralement en deux grandes catégories, exogène et endogène.
L'origine exogène correspond à toutes les expositions environnementales auxquelles un organisme est soumis. Cela va du tabac aux ultraviolets du soleil en passant par l'amiante, les radiations gamma, l'alcool et de nombreuses autres substances auxquelles un individu est exposé volontairement ou involontairement. Elles peuvent agir directement au niveau de notre ADN et provoquer des altérations comme certaines molécules dans le tabac ou les ultraviolets ou provoquer des états inflammatoires favorisant l'apparition de cellules cancéreuses (alcool).
Les altérations d'origine endogène sont provoquées en partie par des molécules issues de notre métabolisme comme les espèces réactives à l'oxygène. Chaque jour notre ADN subit des millions d'agressions de la part de ces molécules mais dans la très grande majorité des cas, celles-ci sont réparées de manière très efficace. Néanmoins, il suffit d'une défaillance dans la réparation d'un gène important pour enclencher ou continuer un processus de transformation cellulaire. Des travaux récents (2007) suggèrent que les systèmes de réparation de l'ADN ont une efficacité qui diminue avec l'âge.
En 2000, dans leur article « The hallmarks of cancer », Robert Weinberg et Douglas Hanahan ont suggéré que la transformation cellulaire passe par l'acquisition d'au moins six propriétés :
Indépendance vis-à-vis des signaux stimulant la prolifération. Les cellules normales ne se divisent que lorsqu'elles reçoivent un stimulus particulier. Les cellules tumorales n'ont plus besoin de ce signal.
Insensibilité aux signaux inhibiteurs
Abolition de l'apoptose ou mort cellulaire programmée. En cas de stress ou d'anomalie ne pouvant pas être éliminée, une cellule normale se suicide en utilisant l'apoptose. Les cellules tumorales ont inactivé tous ces mécanismes pour mieux survivre.
Capacité proliférative illimitée : le nombre usuel de divisions cellulaires pour une cellule humaine est de 50 à 60 (sénescence cellulaire, limite de Hayflick), après quoi elle cesse de pouvoir se diviser (voir article Télomère). Les cellules tumorales continuent de se diviser sans limite visible grâce à l'activité de la télomérase qui est fortement active dans toutes les cellules cancéreuses.
Capacité de susciter l'angiogenèse. Les cellules tumorales (et la tumeur) ont un besoin important en oxygène pour survivre. Elles vont donc stimuler la formation de nouveaux vaisseaux sanguins afin d’oxygéner la tumeur.
Acquisition d'un pouvoir invasif. Les cellules tumorales sont capables de passer à l'intérieur d'un vaisseau sanguin afin d'être transportées dans un autre organe où elles vont générer une seconde tumeur (métastase)
Chronologie de la transformation cancéreuse
La cancérogenèse est causée par des substances cancérogènes, qui entraînent des anomalies génétiques touchant l'architecture ou la séquence de l'ADN. À ce stade, le cancer en formation n'est cliniquement pas observable et n'a pas de conséquence fonctionnelle.
La formation d'un cancer – au sens strict – comporte deux étapes distinctes et nécessairement successives : cancérogenèse et tumorogenèse.
Cancérogenèse

Des cellules cancéreuses photographiées par une caméra attachée à un microscope.
Le stade cancérogenèse de la transformation cancéreuse nécessite deux étapes : l'initiation et la promotion. Ces deux étapes sont obligatoirement successives et l'initiation précède toujours la promotion, sans quoi le processus cancéreux s'arrête.
Initiation
L'initiation correspond à l'accumulation des anomalies génétiques.
L'initiation (ou transformation cellulaire) comporte deux éléments majeurs :
l'immortalisation : les cellules deviennent incapables d'initier leur propre mort (apoptose) ou ne répondent plus aux signaux extérieurs qui la déclenchent
la perte d'homéostasie. L'homéostasie est caractérisée normalement par un équilibre divisions/morts qui assure le maintien de la taille et de la fonctionnalité d'un organe. Dans notre cas, les cellules cancéreuses perdent la sensibilité aux signaux qui régulent la prolifération.
L'initiation est la conséquence de la carcinogenèse. L'action des carcinogènes mute des gènes importants dans le maintien de l'intégrité et des caractéristiques de chaque type cellulaire.
Il en résulte des pertes ou gains de fonctions cellulaires :
activation ou dérépression d'un oncogène : les oncogènes sont souvent des activateurs de la multiplication ou des inhibiteurs de l'apoptose (BCL, BCLX1, etc.)
inhibition ou répression d'un gène suppresseur de tumeur : les gènes suppresseurs sont des inducteurs de l'apoptose ou des bloqueurs du cycle cellulaire (P53, BAC, etc.).
Promotion
La promotion recouvre la réception par la cellule de facteurs de prolifération qui vont entraîner les divisions. Ces signaux vont donc pérenniser les anomalies au cours des divisions, et ainsi assurer la descendance de la cellule anormale, qui va de surcroît accumuler de nouvelles anomalies génétiques. (voir Transformation cellulaire).
La promotion est caractérisée par une grande instabilité génomique et une augmentation de la perte d'homéostasie.
L'instabilité génomique est due à des mutations de deux types de gènes :
Les gènes portiers (gate keeper genes) : ils assurent le contrôle du passage à une étape ultérieure du cycle cellulaire. Une perte de fonction de ces gènes permet à la cellule cancéreuse de passer rapidement à la phase ultérieure du cycle cellulaire, donc in fine de proliférer de façon incontrôlée.
Les gènes soignants (care taker genes) : ils assurent physiologiquement la réparation des anomalies liées à l'ADN. Leur inactivation entraîne une instabilité accrue et une accumulation d'anomalies génétiques (mutation, perte d'hétérozygotie, modifications épigénétiques : hypo/hyperméthylation, désacétylation, etc.).
Ces points de contrôle et de réparation altérés, la cellule cancéreuse a désormais perdu la capacité à « reconnaître sa vieillesse », initier sa mort et réparer les dommages de son ADN. La réponse aux signaux de croissance physiologiques est en outre disproportionnée. Ensuite, la cellule commence à produire ses propres signaux de prolifération (cf. infra) : la croissance incontrôlée d'un pool de cellules n'a alors plus de limite.
À ce stade, le cancer est infraclinique : c'est une masse de cellules qui survit dans l'organisme. L'environnement des cellules cancéreuses (ou stroma, microenvironnement) est dit non coopératif : il ne fournit pas aux cellules cancéreuses les nutriments et le soutien que leur développement réclame. Cette phase est critique dans le développement clinique du cancer : si le stroma reste non-permissif, le cancer n'évolue pas, ou alors très lentement. Si en revanche il peut s'établir une réciprocité de maintien entre cancer et stroma : le cancer envoie des signaux permissifs au stroma, qui se modifie en faveur du cancer et va lui apporter nutriments et soutien. Ainsi le cancer grossit, produit de plus en plus de signaux permissifs, etc. Dans le cas ou la réciprocité s'établit, l'évolution du cancer reprend et passe à un stade clinique.
Le stroma devient permissif à deux conditions :
lorsqu'il est le siège d'une néoangiogenèse, c'est-à-dire d'une sécrétion par la tumeur de facteurs de croissance angiogéniques (VEGF) accompagnée d'une apparition des récepteurs à ces facteurs sur le stroma (VEGF-R))
lorsqu'il y a apparition de récepteurs tumoraux aux facteurs de croissances cellulaires (boucle autocrine) ou microenvironnementaux (boucle paracrine).
Tumorigenèse
Il s'agit du développement du cancer donnant des conséquences cliniques : il grossit dans des limites histologiques précises (on parle de cancer in situ), puis les dépasse et devient donc invasif avec dissémination très probable de métastases.
La néoangiogenèse et la mise en place d'une circulation sanguine stable et relativement efficace sont les préalables indispensables à cette phase : la croissance tumorale est telle qu'elle ne peut plus se contenter d'une diffusion à partir d'un stroma non permissif mais nécessite des apports importants et dédiés.
La tumeur grossit jusqu'à atteindre la lame basale : le cancer est dit in situ et son risque de métastase est faible.
La croissance tumorale continue et la membrane basale se rompt, le cancer devient invasif : les cellules cancéreuses ont alors de grandes facilités à atteindre les courants métastatiques (circulations lymphatiques pour les carcinomes et veineuse pour les sarcomes) et la dissémination dans le corps débute.
Évolution
De son foyer initial, le cancer va (en dehors de tout traitement ou si le traitement n'est pas efficace) :
se développer de manière locale. Il provoque dans ce cas une compression des organes voisins, voire un envahissement et une destruction des tissus adjacents ;
se développer de manière régionale. Il envahit les ganglions lymphatiques, où logent les cellules du système immunitaire ;
se propager à distance de la tumeur initiale et former des métastases. Il y a souvent une confusion chez les patients et leur famille : un cancer du sein avec des métastases au niveau du cerveau ne donne pas un cancer du cerveau ; c'est toujours le cancer du sein initial, mais qui s'est développé ailleurs. Il faut continuer à le traiter comme un cancer du sein. La localisation des métastases ne se fait pas complètement au hasard : les métastases de certains organes se localisent de préférence dans des types d'organes bien marqués. Voir à ce propos l'exemple des métastases osseuses (c'est-à-dire dans les os).
L'évolution dépend du type du cancer et de sa prise en charge : certains ne font que très peu de métastases et sont très sensibles aux traitements permettant d'aboutir dans la grande majorité des cas à une rémission complète et prolongée (ce terme de rémission est spécifique de la cancérologie et diffère de guérison par l'absence de certitude quant à une récidive à court, moyen ou long terme). D'autres sont encore très difficilement maîtrisables et peuvent entraîner le décès à court terme. Une évaluation précise du type du cancer auprès d'un médecin spécialisé est donc indispensable.
Causes
Une étude américaine en 2014 parvient à la conclusion que deux cancers sur trois sont dus à des mutations génétiques aléatoires et ne seraient donc pas liés à des causes héréditaires ou environnementales. Pour le tiers restant, les causes reconnues sont énoncées ci-dessous. Le journal Le Monde du 7 janvier 2015 publie un article de Annie Thébaud-Mony contestant la validité de l'étude américaine de Christian Tomasetti et Bert Vogelstein, lui reprochant de confondre relation statistique avec relation causale.
Les facteurs de risque du cancer peuvent être endogènes (provenant de l'organisme) ou exogènes (extérieurs à l'organisme). L'étude sur des registres de vrais jumeaux ou des changements de taux de cancer chez les populations migrantes permet de démontrer la part environnementale de nombreux cancers.
Risques endogènes
Dans certains cas, l'apparition d'un cancer a une composante héréditaire. C'est le cas de quelques-uns comme certains cancers du sein. Certains cancers induits par certains comportements transmis de génération en génération (consommation d'alcool ou de tabac) peuvent être confondus avec un risque génétique vrai, et inversement certains gènes prédisposant au cancer pourraient n'être activés que dans certaines circonstances (obésité, alcoolisme, etc.).
Risques dits « environnementaux »
Le tabagisme est la principale cause du cancer du poumon.
Les facteurs exogènes de risque (facteurs non-génétiques ou « environnementaux ») dépassent le seul champ de l'environnement (au sens français du terme), puisque recouvrant aussi, par exemple, les bactéries et virus inducteurs de cancers. Ils sont pour partie liés à l'environnement et pour partie aux comportements à risque qui augmentent l'exposition de l'individu à ces facteurs.
Tabac : Le tabac est un facteur de risque majeur pour différents cancers (80% des cancers du poumon, 75% du larynx, 50% de la vessie), il est aussi impliqué dans certains cancers du foie, du pancréas, de l'estomac, du rein, du col de l'utérus, du sein, du côlon-rectum, de l'ovaire et de certaines leucémies. C'est la première cause de mortalité évitable par cancer avec près de 47 000 décès par an en France, soit environ 25% de la mortalité totale par cancer.
Alcool: L'alcool est en France « la deuxième cause de mortalité évitable par cancer après le tabac. » L'éthanol (alcool) - même à dose modérée est classé dans la liste des cancérogènes du groupe 1 du CIRC ; il augmente le risque de plusieurs cancers, d'autant plus que la dose ingérée est importante - il n'y a pas de dose sans effet. Les cancers les plus favorisés par l'alcool incluent le cancer du foie et le cancer du pancréas ; les cancers des voies aérodigestives supérieures : cancer de la bouche (langue, cavum, lèvres), cancer de l'œsophage, cancer de l'estomac ; et le cancer du sein, une femme augmente son risque de cancer du sein de 10 % par 10 g d'alcool par jour. Le rapport du Circ (Iarc, 2007) estime la part attribuable à l'alcool à 10,8 % de l'incidence des cancers et 9,4 % des décès par cancers chez l’homme et à respectivement 4,5 % et 3 % chez la femme. En 2015, on estime que la consommation d'alcool est responsable de plus de 15 000 décès par cancer par an en France, sur un total de 148 000 décès par cancer. L'alcool est un facteur de risque pour de nombreux accidents et maladies. Il a été estimé, pour l'année 2015, que 49 000 décès (toutes causes confondues) étaient attribuables à l'alcool par an en France, sur un total de 570 000 décès toutes causes confondues.
Alimentation : L'alimentation joue un rôle dans la survenue de cancers, elle serait particulièrement impliquée dans la forte prévalence du cancer colorectal qui touche environ 37 000 personnes et en tue 17 000 par an en France. Selon le Fonds mondial de recherche contre le cancer, 30 à 40 % des cancers seraient imputables à l'alimentation. Outre l'alcool cité plus haut, les mycotoxines et la viande transformée sont considérées comme des facteurs établis de cancer, c'est-à-dire classés comme cancérigènes par le CIRC. La viande rouge, les glucides à haut indice glycémique et les résidus de pesticides sont considérés comme des facteurs probables, c'est-à-dire classés comme cancérigènes probables par le CIRC. Les produits laitiers ont des effets ambigus, ils favoriseraient le cancer de la prostate et des ovaires mais le lait réduirait le risque de cancer colorectal.
La consommation de viandes rouges est souvent citée comme un facteur probable des cancers colorectaux, sauf dans le cas d'une consommation modérée (50 g par jour). Plusieurs méta-études jugent cependant les données statistiques insuffisantes pour conclure, mais l'OMS et le CIRC ont jugé en 2015 que la viande rouge devait être classée en cancérigène probable (groupe 2A) et les charcuteries en cancérigène (groupe 1). Le lien entre la consommation de viandes transformées (charcuteries par exemple) et certains cancers (colorectal, œsophage et estomac) semble mieux établi. Plusieurs études attribuent l'effet cancérigène des viandes transformées à l'ajout d'agents de conservation à base de nitrites absents dans la viande fraîche. Les nitrites sont des précurseurs d'une famille de composés cancérigènes: les nitrosamines. L'exposition aux nitrosamines, associée à la consommation de viande et de poisson transformés - dont en particulier les produits fumés - augmente le risque de cancer de l'estomac. La consommation de légumes conservés en saumure acide (de type pickles) augmente le risque de cancer de l 'estomac et de l’œsophage, ils contiennent eux aussi de grande quantité de précurseurs de nitrosamines.
Il existe aussi un lien entre consommation de viandes rouges ou transformées avec le cancer du pancréas, sans que les graisses saturées ne puissent être incriminées ; pour les auteurs, l'effet du mode de cuisson sur le sur-risque est à explorer. Le mode de cuisson de la viande comme des aliments végétaux semble effectivement jouer un rôle important dans leur potentiel cancérigène. Deux composés, l'acrylamide et le benzopyrène, produits par les cuissons à hautes températures (friture - en particulier pour les produits de pomme de terre frits -, cuisson au contact de la flamme - en particulier pour les viandes) sont plus particulièrement cités parmi les facteurs de risques reconnus.
Une forte consommation de sel est corrélée à un risque plus élevé de cancer de l'estomac. Les consommations de maté et de noix de bétel sont corrélées à un risque plus élevé de cancer de l'œsophage et/ou du pharynx.
La consommation de matières grasses saturées pourrait aussi être un facteur de risque, en particulier pour le cancer colorectal, certaines matières grasses pouvant avoir un effet protecteur comme les huiles de poisson et l'huile d'olive, cependant les méta-analyses sont moins catégoriques.
Outre les mycotoxines évoquées plus haut - dont en particulier l'aflatoxine, d'autres contaminants cancérigènes peuvent être présents dans les aliments, parfois naturellement (hydrazines dans les champignons frais par exemple), parfois à des teneurs anormalement élevées pour cause soit de concentration tout au long de la chaîne alimentaire (métaux lourds dont en particulier le cadmium - par exemple dans le foie de bœuf ou l'hépatopancréas des crustacés, soit de contamination de l'environnement: métaux lourds de nouveau dont en particulier l'arsenic dans les eaux de certains pays comme le Bangladesh, hydrocarbures aromatiques polycycliques, furfural, dioxine - par exemple dans le lait et les produits laitiers)
Sur le plan des facteurs protecteurs, la consommation régulière de fruits et légumes diminue le risque de survenue d'un cancer. Une étude publiée dans Food and Chemical Toxicology estime qu'une augmentation de la consommation de fruits et légumes éviterait 20 000 cas de cancer par an aux États-Unis en ne générant que dix cas liés aux résidus de pesticides. En revanche la consommation en quantité élevée d'agrumes (plus de 6 fois par semaine) augmenterait le risque de cancer de la peau. La recherche met en évidence le lien entre plusieurs substances d'origine végétale et la réduction de risque de certains cancers: brassicacées (choux, brocolis, etc.), ail, lycopène et autres caroténoïdes, flavonoïdes, huile d'olive, mais c'est bien la consommation de fruits et légumes en général - et non de compléments alimentaires - qui est encouragée par les pouvoirs publics. La consommation de fibres - typiquement apportées par les fruits, les légumes et les céréales entières - réduit aussi le risque de cancer. La pratique du jeûne intermittent, de la diète cétogène, et de la restriction calorique, les régimes pauvres en glucides et riches en protéines et Atkins pourraient avoir un effet protecteur et améliorer les chances de survie des malades. L'apport en oméga-3 - souvent mis en avant dans la littérature grand public - pourrait avoir un effet. Une étude stipule que, après étude des données relatives à 48 essais randomisés et contrôlés et à 41 études de cohortes, « les oméga-3 ne montrent qu'un léger bénéfice sur la mortalité totale, les événements cardiovasculaire ou le cancer. »
Enfin, et parce que ces aliments contribuent à l'obésité (voir ci-dessous), les boissons sucrées sont une cause indirecte de certains cancers.
Obésité : Elle jouerait un rôle dans près de 4 % des cancers, et pour beaucoup des cancers hormono-dépendants (du sein et de l'utérus et semble-t-il colorectal, de la vésicule biliaire, de la prostate, du pancréas et des reins ; à cause d'une production œstrogénique anormale et accrue dans les tissus gras). Un indice de masse corporelle de 30 à 35 (seuil de l'obésité) augmente d'un tiers le risque de mourir du cancer. 100 000 cancers auraient été causés par l'obésité par an entre 2000 et 2010 ; Une étude américaine récente a conclu que 9 % des cas de cancer colorectal, 17 % des cas de cancer du sein, 21 % des cas de cancer de la vésicule biliaire, 24 % des cas de cancer du rein, 28 % des cas de cancer du pancréas, 35 % des cas de cancer de l'œsophage et une écrasante majorité de 49 % des cas de cancer de l'endomètre avaient l'obésité comme cause probable. De plus les chances de survie sont moindres chez l'obèse, car leur cancer est souvent détecté plus tardivement. Aux États-Unis où l'obésité a fortement progressé (touchant 15 % des enfants et adolescents de 6 à 19 ans en 2000, avec 65 % des adultes étant soit en situation d'embonpoint, soit obèses, soit 3 fois plus qu'en 1980), elle serait même déjà la cause de 14 % des décès par cancer chez les hommes et 20 % chez les femmes (devant le tabagisme). Probablement pour les mêmes raisons (hormonales), l'obésité de la mère aggrave aussi le risque de cancer du testicule chez le futur enfant (il y en avait déjà un indice avec un taux plus faible de cancer des testicules observé chez les hommes conçus durant la dernière guerre mondiale en Europe de l'Ouest, alors que la nourriture était rationnée). Pourtant, environ 40 % des gens sondés sur tous les continents ne connaissaient pas le lien entre obésité et cancer. Le message de la campagne mondiale 2009 contre le cancer de l'UICC était qu'environ un cancer sur trois parmi les cancers les plus communs pourrait être évité par un poids normal, entretenu par une alimentation saine et équilibrée et une activité physique suffisante. Une étude récente a conclu que le risque de cancer du pancréas double pour ceux qui étaient obèses ou en surpoids à l'adolescence, par rapport à ceux qui n'ont jamais été obèses ou en surpoids. Sur tous les cas de cancer étudiés, 27 % ont été attribués à l'obésité (les autres facteurs de risque pour ce type de cancer sont surtout le tabagisme (25 % des cas) puis le diabète).
Activité physique : L'activité physique pratiquée au quotidien a un effet protecteur vis-à-vis du cancer. Cet effet est plus marqué pour le cancer du côlon, du sein, de l'utérus et des poumons.
Polluants : Leur rôle exact dans la genèse des cancers reste difficile à évaluer, sauf dans le cas des expositions professionnelles où de nombreuses reconnaissances officielles confirment le lien entre cancer et exposition aux polluants. Les risques associés au contact en milieu professionnel avec des produits cancérogènes sont reconnus pour de nombreuses substances : amiante, benzène, trichloréthylène, arsenic, formaldéhyde, gaz moutarde, iode 131, les poussières de bois, le goudron de houille et la suie. Les mycotoxines peuvent être inhalées dans des locaux insalubres, l'effet à long terme est cependant mal quantifié. On soupçonne que l'exposition aux pesticides serait responsable de certains cancers (lymphome, leucémie, prostate) chez les agriculteurs, en particulier les arboriculteurs et viticulteurs. Il faut noter que l'incidence de beaucoup d'autres cancers chez les agriculteurs est moindre que dans l'ensemble de la population. Une vaste enquête épidémiologique a été lancée pour mieux cerner la situation. L'OMS estime à 10 % la proportion de cancers liés au travail, ce qui correspond à plus de 200 000 décès annuels dans le monde. En France 2.5 à 3 millions de travailleurs seraient exposés, générant 11 à 23 000 nouveaux cas de cancer par an, dont seulement 15 à 30% seraient officiellement reconnus.
« Ce qui donne le cancer », d'après la classification du Centre international de recherche sur le cancer, nuage de mots-clés.
Radiations solaires : Les UV du soleil sont cancérigènes. Il est notamment important d'éviter une surexposition au soleil, ou d'utiliser des crèmes solaires lors d'une exposition prolongée au soleil dont l'effet protection est démontré.
Micro-organismes : Les virus et bactéries font partie des facteurs exogènes du cancer. Certains cancers peuvent être induits par des virus, tels le cancer du col de l'utérus provoqué par le VPH.
Perturbateurs endocriniens : Mimant les hormones naturelles, certains sont fortement soupçonnées d'initier des cancers dits « dépendants des hormones » (par exemple, le cancer du sein) ; la perturbation peut se produire in utero et donner par exemple des cancers du testicule, ou d'autres types de cancers susceptibles d'être induits par des molécules telles que le distilbène.
Éclairage artificiel : Il est évoqué, et parfois assimilé à la catégorie pollution lumineuse (pour le cancer du sein au moins), via une perturbation endocrinienne chez les femmes exposées à une lumière artificielle la nuit. Les femmes travaillant en équipe de nuit ont un risque de cancer du sein plus élevé
Radioactivité : Les rayonnements ionisants, artificiel ou naturel, sont cancérigènes au-delà d'un seuil estimé à 100 à 2 000 mGy. Les risques associés à des doses dites faibles (inférieures à 100 mSv) sont mal connus. Une étude publiée en 2015, coordonnée par le Centre international de recherche sur le cancer, conclut que le risque existe aussi pour de faibles expositions. Les risques de pollution radioactive militaire, industrielle ou accidentelle sont encadrés par des règles de radioprotection.
Nanomatériaux ? Certains nanomatériaux ont une toxicité avérée, et/ou une génotoxicité potentielle, aggravée par la taille infime de ces particules qui peuvent ainsi atteindre l'ADN et le génome). Ils sont suspectés de peut-être contribuer à certains cancers. Un projet européen Nanogenotox doit pré-évaluer cette question, ou au moins proposer des outils de mesure du risque, sur la base de tests faits sur 14 matériaux à base de dioxyde de titane, silice et nanotubes de carbone. Ces 3 nanomatériaux ont été choisis car déjà utilisés dans des cosmétiques, aliments, produits de consommation courante.
Pour l'Académie nationale française de médecine (rapport 2007), le tabac reste la principale cause de cancer. Viennent ensuite l'alcool, le surpoids et l'insuffisance d'exercice physique, puis les expositions professionnelles et les traitements hormonaux de la ménopause chez la femme. La moitié des origines du cancer demeure inexpliqué.
Prévention
Il convient de faire la différence entre la prévention, qui cherche à diminuer la survenue de la maladie en luttant contre ses facteurs favorisants, et le dépistage, qui cherche à mettre en évidence une maladie de manière précoce pour la traiter plus facilement.
La prévention du cancer se fonde sur :
l'évitement ou la diminution de l'exposition aux cancérogènes de l'environnement et industriels : principalement, la lutte contre le tabagisme, la consommation excessive d'alcool et de graisses animales, l'exposition excessive au soleil, les normes de construction (désamiantage), radioprotection, manutention de produits dangereux dans le cadre professionnel, étude REACH ;
le rôle protecteur (« oncostatique ») de certains éléments : fibres, vitamines et autres antioxydants (céréales, légumes verts, fruits), ainsi que le thé vert (plus que le noir) ou le chocolat et plus précisément les aliments contenant de la catéchine. Consommer une gousse d'ail par jour réduit de moitié le risque de cancer de l'estomac, du côlon et du rectum.
Le « Plan Cancer » (2003-2007/2009-2013) prévoit : une réorganisation de la recherche médicale, le renforcement de la prévention primaire, des efforts de dépistage, une amélioration de la prise en charge des maladies, des aides à l'insertion sociale des malades et des actions pour améliorer l'environnement.
Dépistage
Il consiste en la détection la plus précoce possible de lésions précancéreuses ou de cancers, chez des personnes ne présentant pas encore de symptômes évidents. Le but est de trouver, dans une population donnée, des lésions que l'on peut encore traiter facilement : si l'on attend les symptômes, il est souvent nécessaire d'avoir recours à des traitements plus « lourds » pour traiter la maladie.
Cela se fait par la clinique (l'examen du patient) : palpation des seins, toucher rectal, etc. et des examens paracliniques (scanner, IRM, tomographie optique ou parfois échographie). Certains dépistages ont prouvé leur intérêt en diminuant le nombre de décès par cancer : le frottis du col utérin, pour dépister les lésions précancéreuses et les petits cancers du col utérin et les examens colorectaux. La mammographie, pour dépister des cancers du sein à un stade précoce, a fait l'objet de plusieurs controverses, en raison d'un fort accroissement des faux-positifs dans la population de moins de 50 ans, et il existe un consensus pour ne la pratiquer de façon systématique qu'au-delà de cet âge.
En novembre 2014, une équipe de chercheurs du centre hospitalier universitaire de Nice (France) montre que le Test ISET a permis d'obtenir des résultats majeurs pour le dépistage des cancers du poumon. C'est une technologie récente permettant d'isoler les cellules tumorales circulantes présentes dans le sang. Très simple pour le patient, sa mise en œuvre consiste en une simple prise de sang.
L'intérêt de la recherche de saignements minimes dans les selles (test hémocult) fait encore l'objet de discussion pour le dépistage des polypes et des petits cancers du côlon.
Pour Sorensen et al., les fièvres prolongées non-expliquées (FPI) sont un marqueur de néoplasies occultes.
Diagnostic
Même s'il existe des éléments permettant d'identifier un cancer avec une grande probabilité, le diagnostic de certitude ne se fait que sur analyse au microscope (anatomopathologie) d'un échantillon de la tumeur (éventuellement aidé par d'autres techniques comme le scanner, l'IRM voire parfois l'échographie). Cet échantillon vient soit d'une biopsie (simple prélèvement d'un morceau de la tumeur) qui peut être faite, suivant la localisation, suivant différentes procédures (fibroscopie, ponction à travers la peau…), soit d'une pièce opératoire (tumeur enlevée par le chirurgien).
Traitements
Le traitement est effectué en milieu spécialisé, en règle sur une stratégie définie par une équipe médicale pluridisciplinaire (c'est-à-dire comportant des médecins de plusieurs spécialités : oncologie, radiothérapie, chirurgie, gynécologie, gastro-entérologie, etc.).
Il nécessite d'avoir un diagnostic de certitude et de connaître le type du cancer ; d'évaluer son extension locale, régionale et la présence ou non de métastases ; et d'évaluer l'état général du patient (âge, fonctions cardiaque et rénale, présence d'autres maladies).
Suivant les cas, il repose sur :
l'exérèse (l'ablation) chirurgicale large de la tumeur quand cela est possible, large voulant dire que le bistouri du chirurgien passe uniquement par des tissus sains ;
un traitement mini-invasif percutané par radiofréquence, micro-ondes ou cryothérapie en complément ou en alternative à la chirurgie;
une chimiothérapie, prescription de médicaments s'attaquant au cancer et à ses métastases ;
une radiothérapie, l'irradiation de la tumeur permettant de faire fondre, voire disparaître celle-ci.
Certains cancers peuvent bénéficier également :
d'un traitement hormonal ;
d'un traitement à visée immunologique consistant à augmenter l'action du système immunitaire ; une piste est notamment explorée, qui associe l'interleukine 7 (IL-7) à un vaccin viral pour inciter le système immunitaire à attaquer les tumeurs. Ces travaux ont aussi montré comment l'IL-7 casse les barrières qui freinaient la réponse immunitaire aux tumeurs.
d'un traitement à base d'ultrasons, une technologie en plein développement s'appuyant sur la focalisation d'un faisceau ultrasonore très puissant sur une métastase ;
d'un traitement par photochimiothérapie qui consiste à détruire les cellules cancéreuses (notamment dans les cancers de la peau) au moyen de substances chimiques devenant toxiques à la lumière.
Souvent, plusieurs de ces types de traitements sont nécessaires chez un même patient. Il ne faut pas oublier le traitement des conséquences de la tumeur, la prise en charge des effets secondaires du traitement et le traitement de la douleur.
Traitements alternatifs
En médecine les traitements reposent sur des études scientifiques de bonne qualité qui sont nécessaires avant qu'un traitement soit considéré comme efficace. Il existe de nombreux traitements alternatifs, mais l'évaluation scientifique de leur efficacité est souvent soit inexistante, soit non validée en pratique clinique, c'est-à-dire validées dans des modèles expérimentaux ou animaux mais pas chez l'homme. Par exemple de nombreuses substances tuent les cellules cancéreuses en laboratoire ou chez l'animal mais fonctionne mal chez l'homme.
De nombreuses personnes se tournent vers des traitements alternatifs pensant qu'ils n'ont pas d'effets négatifs, ce qui n'est pas toujours le cas, certains sont nocifs et peuvent même entraîner la mort. D'autre part, le simple fait de retarder le traitement reconnu peut permettre au cancer de se développer et d'atteindre d'autres parties du corps.
Certains traitements alternatifs sont assimilables à du charlatanisme ou de la fraude, ces méthodes sont souvent basées sur des théories de la maladie qui sont contraires aux idées scientifiques reconnues, de simple témoignages de patients sont parfois utilisés comme preuves. Ces « remèdes miraculeux » prétendent souvent soigner d'autres maladies que le cancer.
Quelques exemples de traitements alternatifs :
La supplémentation de très forte doses de vitamine C en médecine orthomoléculaire, dont l'idée initiale a été donnée par Irwin Stone, reprise par Linus Pauling (mort d'un cancer de la prostate) et notamment Matthias Rath (dont les travaux sont très controversé). Un effet favorable semble exister chez les cultures cellulaires ou chez des animaux mais aucune preuve satisfaisante n'existe chez l'être humain à titre curatif, ou préventif. La Société Suisse de lutte contre le cancer souligne, en particulier, les faiblesses du dossier scientifique de Matthias Rath.
Il existe de nombreux régimes alimentaires censés lutter contre le cancer, par exemple : la cure de raisin de Johanna Brandt, la cure anticancer de R. Breuss, l'instinctothérapie de Guy-Claude Burger, des régimes végétariens, le régime cétogène, la méthode de Gerson, la diététique de Kousmine, le régime et la thérapie du D Moerman, la thérapie de Livingtone-Wheeler, le zen macrobiotique. Certaines théories utilisent le jeûne thérapeutique dans le but de « détoxifier » l'organisme ou pour faire « maigrir » les tumeurs. Les preuves scientifiques disponibles ne soutiennent pas une efficacité contre le cancer chez l'homme. Des périodes de jeûne de courte durée peuvent avoir des effets négatifs sur certaines personnes, sur de longues périodes les effets peuvent être plus graves et même entraîner la mort.
D'autres méthodes font appel à la guérison par la foi et la prière, depuis l'Antiquité, il existe notamment aux États-Unis des évangélistes guérisseurs. La chirurgie psychique est pratiquée par des guérisseurs aux Philippines, la méthode très controversée de Hamer en Allemagne et en France, etc.
Voir aussi les travaux de Mirko Beljanski. Par ailleurs, G. Edward Griffin prétend que le cancer résulterait notamment d'une carence en vitamine B17 ordinairement appelée amygdaline ou laetrile. Le professeur Didier Raoult a exposé dans Le Point en 2014 les travaux de William Coley, qui ont fait l'objet d'un article dans la revue Nature.
Impact sur la qualité de vie, la vie professionnelle et soutien psychologique
Apprendre qu'on a un cancer est très difficile à assumer, tant cette nouvelle a longtemps été considérée comme celle d'une mort imminente. Par ailleurs, l'hospitalisation, l'opération chirurgicale et les traitements adjuvants changent profondément la vie du malade et interfèrent souvent durablement avec son parcours professionnel et sa vie familiale. Il est donc essentiel d'apporter aux malades un soutien psychologique adapté.
En France, l'association de psycho-oncologie étudie comment aider au mieux les cancéreux, ce qui passe en général par la participation à des groupes de patients qui vivent les mêmes épreuves. Un rapport récent a synthétisé 6 études ayant répondu à un appel à projet sur le maintien/retour au travail et des trajectoires professionnelles de personnes atteintes de cancer.
Coûts économiques et socioéconomiques
La chimiothérapie et la chirurgie lourde, ainsi que les traitements au long cours font du cancer une des maladies financièrement les plus coûteuses pour la société. Le coût social du cancer est difficile à évaluer, mais est important et ne cesse d'augmenter. Avec l'industrialisation des pays pauvres et l'évolution de leur mode de vie et de l'espérance de vie, le cancer tend à se globaliser sur la planète; En 2010, plus de 50 % des nouveaux cas de cancer et près des 2/3 des décès par cancer touchent des personnes à faible revenu, à revenu inférieur à la moyenne et des pays en développement à revenu intermédiaire du monde (à titre de comparaison, en 1970, les pays en développement ne représentaient que 15 % des cancers nouvellement signalés). En 2030, le monde en développement sera censé supporter 70 % du fardeau mondial du cancer.
En France, dans les années 2000, environ 280 000 nouveaux cas étaient détectés par an, avec une augmentation régulière du nombre de cas (358 000 nouveaux cas attendus en 2010 selon les modélisations de l'INVS (rendues nécessaire par le fait qu'en France, seule environ 20 % de la population est concernée par un registre du cancer)) coût annuel estimé à 30 milliards d'euros pour 2004. 730 millions d'euros ont été accordés au 2 Plan cancer (2009-2013) dont 95 millions pour la recherche et 400 millions pour les soins. La recherche porte aussi sur les moyens de diminuer les coûts socio-économiques de la maladie et des soins. Les 6s Rencontres parlementaires sur le Cancer (jeudi 21 octobre 2010) à l'Assemblée nationale ont porté sur le thème : « Cancer : quels coûts pour la société? ». Certaines réflexions de la littérature internationale suggèrent « d'accepter, sans se poser de question, les stratégies thérapeutiques dont les coûts marginaux pour le système de santé par année de vie gagnée demeurent inférieurs à deux fois le PNB par tête », soit moins de 50 000 euros.
Force est de rapprocher ce chiffre du fait que la moyenne des années de vie perdues est de 15 ans sur l'ensemble des cancers.
Des médecins et ONG telles le MDRGF et le réseau européen HEAL protestent contre le fait que ce type d'approche ne portant que sur les coûts du soin, omettent de poser la question des causes environnementales et comportementales du cancer. Mieux les traiter permettrait selon eux d'importantes économies, plus durables, avec peut-être une forte réduction du nombre et de la gravité des cancers.
Selon une étude publiée par les chercheurs de l'université d'Oxford (et rapportée dans le quotidien Direct Matin du 15 octobre 2013), le coût financier pour l'Union européenne s’élève à 26 milliards d'euro par an, ce chiffre inclut les coûts de la maladie pour les systèmes de santé, le manque à gagner lié à l'incapacité de travailler des malades ainsi que les soins fournis par les proches des malades.
Le cancer, même guéri, peut avoir des implications économiques à long terme. En France, par exemple, les patients ont, jusqu'en 2015 des difficultés à avoir certains prêts jusqu'à l'instauration, le 23 mars 2015, du « droit à l'oubli ». Ce droit permet aux personnes guéries de certains cancers ou d'une hépatite C de contracter un emprunt sans avoir à déclarer leur ancienne maladie après une période définie.
Statistiques par pays
La comparaison des statistiques nationales est délicate, car la détection et les classifications ont varié en fonction des époques et pays. Ainsi, en France, le terme « cause environnementale » fait référence aux produits chimiques et à la pollution…, alors qu'en anglais, cela fait référence à tout ce qui entoure l'homme et, de manière générale, tous les facteurs exogènes, c'est-à-dire le soleil, l'alcool, le tabagisme, le nombre de grossesses…
France
Dans le cadre du Plan cancer 2009-2013, depuis 2007, l'Institut national du cancer publie annuellement une synthèse des données sur le cancer (en 2011 le rapport contenait un focus sur les facteurs environnementaux et les expositions professionnelles. En 2009, 1 830 cas de cancers ont été indemnisés par la CNAM, soit une augmentation de 9,1 % par rapport à 2008, en raison d'un meilleur repérage et reconnaissance des cancers professionnels et non d'une augmentation de leur incidence).
En 2000, environ 278 000 personnes étaient annuellement diagnostiquées comme atteintes d'un cancer, soit un Français sur deux cent cinquante. Le nombre total annuel des décès par cancer en France était, en 2004, de 152 708, soit environ 241 décès pour 100 000 habitants. C'est la première cause de mortalité en France, juste avant les maladies cardio-vasculaires (147 323 décès en 2004) dont le taux a baissé de 50 % depuis les vingt-cinq dernières années alors que le taux de décès par cancer n'a que peu diminué. En même temps des cancers de plus en plus divers sont dépistés de plus en plus précocement.
En 2012, le nombre de nouveaux cas de cancer en France métropolitaine est estimé à 355 000 dont 200 000 chez l’homme et 155 000 chez la femme. Le nombre de décès par cancer en 2012 est estimé 148 000 décès dont 85 000 chez l’homme et 63 000 chez la femme. Le cancer du poumon est la première cause de décès par cancer chez l’homme devant le cancer colorectal et le cancer de la prostate. Chez la femme, le cancer du sein se situe au premier rang devant le cancer du poumon et le cancer colorectal.
En 2015, on estime le nombre de décès liés au cancer à 150 000. Le cancer lié au tabac est responsable de 47 000 décès. 15 000 décès sont, eux, associés aux cancers liés à l'alcool.
Il existe une augmentation du nombre de certains cancers. Les cancers du poumon, mésothéliomes, hémopathies malignes, tumeurs cérébrales et cancers du sein, de l'ovaire, du testicule, de la prostate et de la thyroïde sont en augmentation très significative depuis les années 1980. Ceci est en partie lié au vieillissement et à la croissance de la population et touche différemment l'homme et la femme. De 1980 à 2005 (en tenant compte de la démographie), le taux de cancers s'est élevé de 35 % pour les hommes et de 43 % pour les femmes. En 2008, l'INSERM a conclu d'une revue de la littérature scientifique mondiale relative aux liens entre ces neuf cancers en augmentation et exposition passive à des cancérogènes, avérés ou suspectés dans l'environnement (incluant donc le tabagisme passif, mais non le tabagisme actif), que ni les améliorations du dépistage ni l'évolution de la démographie ne pouvaient expliquer cette augmentation. L’exposition aux cancérigènes de l'environnement est donc supposée, mais reste mal évaluée, bien que des liens de causalité soient déjà établis par exemple entre cancer du poumon et pollution particulaire de l’air par le trafic automobile, le chauffage et l’industrie (« Environ 1 300 à 1 900 décès par cancer du poumon pourraient être évités chaque année dans vingt-trois villes européennes si les niveaux de PM2,5 particules fines étaient ramenés respectivement à 20 et à 15 microgrammes par millimètre cube (µg/mm) ». Mais la norme européenne sur les PM2,5 (max de 25 µg/mm en 2010) ne sera en vigueur qu'en 2015. On sait que les rayons ionisants (rayons X et gamma en particulier) peuvent induire de nombreux cancers : (poumon, thyroïde, sein, cerveau, plèvre, leucémies…) et que les radiographies fréquentes augmentent le risque de cancer du sein et peut-être d'autres cancers, a conclu l'étude. Or, ces examens sont de plus en plus fréquents (+ 5 à 8 % par an en France). L'exposition à certains insecticides domestiques du fœtus lors de la grossesse ou dans l'enfance est associée à un doublement du risque de leucémie et moindrement à un risque de tumeur ou cancer du cerveau. L'AFSSET s'est en 2008 engagée à produire des avis et recommandations dans un proche avenir.
Incidence (1980-2005) et mortalité (2005) par cancer en France Cancer Incidence Mortalité Tous les cancers +319 380, +145 762, Prostate +062 245, +009 202, Sein +049 814, +011 201, Côlon-rectum +037 413, +016 865, Poumons +030 651, +026 624, Cavité buccale et pharynx +012 270, +004 000, Lymphome Malin Non Hodgkinien +010 224, +004 203, Vessie +009 679, +004 482, Rein +007 949, +003 684, Mélanome (peau) +007 401, +001 440, Pancréas +007 218, +007 787, Estomac +006 794, +004 756, Thyroïde +006 672, +000403, Foie +006 433, +007 390, Utérus (corps) +005 774, +001 800, Œsophage +004 721, +003 850, Myélome +004 516, +002 789, Ovaire +004 375, +003 180, Système nerveux +004 120, +003 019, Larynx +003 735, +001 406, Leucémie lymphoïde chronique +003 224, +001 059, Leucémies aiguës +003 082, +002 733, Col de l'utérus +003 068, +001 067, Testicule +002 002, +0 00082, Maladie de Hodgkin +001 544, +000218, Plèvre +000906, +001 090,
Il est essentiel de bien noter la différence entre l'incidence d'un cancer (la fréquence annuelle calculée sur une durée précise) et la mortalité. Ce tableau montre bien que certains cancers très fréquents (prostate) ont une mortalité faible contrairement à des cancers plus rares (pancréas) qui ont une mortalité très élevée.
La France est parfois présentée comme étant le pays ayant la plus longue survie après cancer. Mais concernant la survie à 5 ans après le diagnostic, elle serait le second en Europe derrière la Suède, avec environ 52 % de survie (63 % pour les femmes, 44 % pour les hommes). Cela cache de grandes disparités selon les cancers. On atteint des chances de survie de 95 % pour le cancer de la thyroïde ; chez les hommes, on atteint 80 % de survie à 5 ans pour le cancer de la prostate, et quasiment 100 % pour les cancers des testicules et, chez les femmes, 85 % pour le cancer du sein entre 15 et 44 ans, mais 78 % au-delà de 75 ans. En revanche, les cancers profonds sont diagnostiqués plus tardivement et sont très souvent mortels : cancer du pancréas (10 % de survie), du poumon, etc.
L'État et l'assurance maladie ont consacré un peu plus de 12 milliards d'euros à la lutte contre le cancer en 2004, 90 % de cette somme étant dédiée aux soins.
En France, outre l'InVS et l'INPES, l'INSERM, les ARS et ORS, l'Institut de recherche et documentation en économie de la santé (IRDES) et la Direction de la recherche, des études, de l'évaluation et des statistiques (DRESS) dépendant du ministère chargé de la santé, existent plus spécifiquement :
un outil en ligne, l'Institut National du Cancer (INCa), qui donne accès aux principaux indicateurs et recherches sur le cancer (avec un rapport 2011 sur la situation en France .
un « Observatoire sociétal des cancers » confié au Pôle sociétal de la Ligue contre le cancer. Il publie depuis 2012 un rapport annuel (sur le « vécu des malades en 2012 » et sur « le parcours professionnel » en 2014) et a confirmé que la maladie est paupérisante, surtout chez les plus vulnérables (arrêt maladie, perte de revenus, invalidité, rupture sociale, fracture psychologique), avec des démarches administratives fastidieuses ;
un « Comité éthique et cancer », organe de recours indépendant, rendant des avis, associant 35 membres permanents et présidé par le P Axel Kahn ;
un Collectif interassociatif sur la santé (CISS) regroupant (en 2011) 37 associations et une plate-forme Cancer info, une plate-forme collaborative (Web 2.0), créée avec le pôle citoyen de Cancer Campus® pour coproduire des contenus inédits et innovants issus des expériences individuelles et collectives concernant le cancer.
En 2015, selon un rapport InVS réalisé dans le plan cancer 2014-2019 : en France métropolitaine les registres des cancers ne couvrent que 20% de la population. Pour la période 2008-2010 et pour 8 cancers chez l'homme et 8 chez la femme, des disparités départementales persistent pour certains cancers (liés au tabac, à l'alcool, à l'environnement) et « qui semblent correspondre aux variations d'exposition des populations à ces facteurs de risque ». Chez les hommes, l'incidence des cancers des lèvres-bouche-pharynx, du larynx, du poumon et de l’œsophage plus élevée dans les départements du nord, avec une incidence très élevée (dans le Pas-de-Calais, le Nord et la Seine-Maritime notamment) alors que les départements de l'ouest et du sud sont en sous-incidence. Les femmes sont plus victimes du cancer du poumon dans le sud et l'Île-de-France surtout dans les départements urbanisés (Alpes-Maritimes : 18,6 ; Hérault : 19,0 ; Haute-Garonne : 18,6 et dans une moindre mesure Var : 17,4) et en Ile-de-France (17,5), avec par contre une sous-incidence dans le nord. Pour les autres cancers étudiés, les différences départementales sont moins nettes.
Taux de survie et surmortalité
Le taux de survie des cancers n'a cessé de s'améliorer au cours des décennies : dans les années 2010 la survie à 10 ans est similaire, en Angleterre et en Écosse, à la survie à un an en 1970.
Le taux de survie dépend aussi de l'âge. Cinq ans après le diagnostic, 70 % des 15–45 ans survivent. Alors que seuls 39,4 % des malades cancéreux âgés de 75 ans survivront plus de 5 ans ; sachant qu'étant donné le risque de métastases, on ne parle pas de guérison pour un cancer, mais de rémission (voir Évolution plus loin). En France et au Canada, le cancer est la première cause de mortalité chez les plus de 65 ans. Pour estimer l'efficacité du dépistage et des soins, on utilise le taux de survie et la surmortalité à une certaine durée après le diagnostic.
Taux de survie
En Europe, selon l'étude « Eurocare-5 » (publié dans The Lancet Oncology en 2013, il varie beaucoup selon le type de cancer, avec par exemple un taux de survie élevé à cinq ans — plus de 80 % — pour les tumeurs ou cancers des testicules, des lèvres, de la thyroïde ou encore de la prostate). Les chances de survie varient aussi significativement selon le pays ; les pays de l'Ouest (Autriche, Belgique, France, Allemagne, Suisse, Italie, Espagne, Portugal) ont de meilleurs taux de survie après cancer. La Bulgarie, les Pays baltes, la Pologne la Slovaquie ont les scores les plus bas, et le Royaume-Uni et le Danemark ont des résultats moyens.
En France Selon La Ligue nationale contre le cancer, en 2006, le taux de survie à cinq ans après diagnostic en France, pour des patients suivis entre 1989 et 1997 était :
Survie à cinq ans par localisation et par sexe
| Hommes |
Femmes |
| 75 % et + |
| Lèvre |
96 % |
Thyroïde |
95 % |
| Testicule |
95 % |
Maladie de Hodgkin |
92 % |
| Thyroïde |
88 % |
Mélanome de la peau |
89 % |
| Maladie de Hodgkin |
85 % |
Lèvre |
88 % |
| Mélanome de la peau |
83 % |
Sein |
85 % |
| Prostate |
80 % |
Corps utérin |
76 % |
| 50 à 74 % |
| Pénis |
67 % |
Col utérin |
70 % |
| Rein |
63 % |
Rein |
** % |
| Vessie |
60 % |
Os, articulations et cartilages articulaires |
62 % |
| Os, articulations et cartilages articulaires |
59 % |
Larynx |
59 % |
| Côlon |
56 % |
Rectum |
58 % |
| Rectum |
55 % |
Côlon |
57 % |
| Larynx |
54 % |
Vulve et vagin |
52 % |
| Lymphome malin non hodgkinien |
54 % |
Vessie |
50 % |
| 25 à 49 % |
| Nasopharynx |
45 % |
Langue |
45 % |
| Intestin grêle |
45 % |
Myélomes multiples |
43 % |
| Myélomes multiples |
42 % |
Intestin grêle |
42 % |
| Cavité orale |
38 % |
Ovaire |
40 % |
| Langue |
33 % |
Fosses nasales,
sinus annexes de la face,
oreille moyenne et oreille interne |
37 % |
|
|
Hypopharynx |
34 % |
|
|
Leucémie aiguë lymphoblastique |
29 % |
|
|
Estomac |
28 % |
| 25 % et - |
| Estomac |
23 % |
Système nerveux central |
19 % |
| Système nerveux central |
20 % |
Poumon |
18 % |
| Poumon |
13 % |
Œsophage |
14 % |
| Œsophage |
11 % |
Mésothéliome de la plèvre |
13 % |
| Foie |
7 % |
Foie |
9 % |
| Mésothéliome de la plèvre |
6 % |
Pancréas |
7 % |
| Pancréas |
5 % |
En France, selon un rapport conjoint de l'Institut de veille sanitaire (InVS), le réseau Francim des registres des cancers, l'Institut national du cancer (INCa) et les Hôpitaux de Lyon, la durée de survie des patients atteints d'un cancer de la prostate, du sein ou du côlon-rectum, a augmenté dans la période allant de 2005 à 2010 comparativement à la période allant de 1989 à 1993.
Surmortalité
Pour un groupe de personnes chez lesquelles on a diagnostiqué un cancer, on peut distinguer celles mortes des suites de leur cancer, et celles mortes d'autre chose. La surmortalité à une durée t (par exemple de 10 ans) liée au cancer est la probabilité de mourir du seul fait du cancer durant la durée t qui suit le diagnostic.
Le problème de l'évaluation de cette mortalité est qu'il faudrait connaître les causes de tous les décès des personnes dont on a diagnostiqué un cancer, ce qui est impossible. On utilise donc une autre estimation ; pour un groupe de personnes du même sexe et du même âge, on utilise la « survie relative », c'est-à-dire le rapport entre :
la probabilité de survie après un temps t du groupe de personnes dont on a diagnostiqué un cancer, et
la probabilité de survie à t d'un groupe de personnes n'ayant pas de cancer, de même âge et de même sexe.
La surmortalité est alors le complément à 1 de cette survie relative.
Les études montrent une surmortalité d'environ 2 % au-delà de 10 ans après le diagnostic dans les pays développés, ce qui pointe l'irrationalité de la ségrégation que subissent les patients ayant eu un cancer de la part des assurances et des banques (surtaxes, refus de prêt, etc.).
Les résultats ci-après sont issus du document Cancers — Pronostics à long terme de l'INSERM.
L'étude Eurocare s'est penchée sur une vingtaine de pays européens pour des cas diagnostiqués durant trois périodes (les malades étudiés durant une période forment une « cohorte ») : 1978–1985, 1985–1989 et 1990–1994. Cette étude ne distingue pas le stade du diagnostic.
Étude Eurocare, surmortalité, tous cancers et tous âges confondus
| délais après diagnostic |
surmortalité |
| deux sexes confondus |
femmes |
hommes |
| 0–1 an |
27 % |
20 % |
33 % |
| 2 année |
15 % |
| 5 année |
5 % |
| 10 année |
2,27 % |
1,95 % |
3,18 % |
| 11-12 année |
2 % |
moins de 2 % |
un peu plus de 2 % |
Étude Eurocare, surmortalité, tous cancers et deux sexes confondus
| délais après diagnostic |
surmortalité par classe d'âge |
toutes classes
d'âge confondues |
15–44 ans |
45–54 ans |
54–65 ans |
65–74 ans |
| 0–1 an |
27 % |
12 % |
|
|
33 % |
| 4 année |
|
moins de 5 % |
| 10 année |
2,27 % |
1,24 % |
2,06 % |
2,42 % |
3,03 % |
| 11-12 année |
2 % |
un peu plus de 1 % |
|
|
plus de 3 % |
tumeurs germinales du testicule (0,03 %),
corps de l'utérus (0,28 %),
leucémies aiguës lymphoïdes (0,33 %),
thyroïde (0,49 %),
côlon (0,91 %),
mélanomes cutanés (0,91 %),
maladie de Hodgkin (1,03 %)
col de l'utérus (1,13 %),
rectum (1,44 %),
ovaires (1,80 %),
sein (2,57 %),
larynx (2,74 %),
leucémies aiguës myéloïdes (2,75 %),
oropharynx (2,76 %),
rhinopharynx (2,96 %),
rein (3,13),
lymphomes malins non-hodgkiniens (4,18 %)
poumon (5,** %),
prostate (6,67 %),
hypopharynx (9,11 %),
leucémies lymphoïdes chroniques (9,67 %),
leucémies myéloïdes chroniques (10,27 %)
L'étude américaine SEER s'est intéressée au stade du cancer au moment de son diagnostic, selon trois catégories :
tumeur localisée ;
tumeur ayant un développement régional (ganglionnaire) ;
tumeur ayant un développement à distance (métastase).
prostate (0,00 %),
tumeurs germinales du testicule (0,00 %),
thyroïde (0,00 %),
corps de l'utérus (0,50 %),
mélanomes cutanés (0,61 %),
ovaires (0,86 %),
col de l'utérus (0,91 %)
sein (1,02 %),
rein (1,80 %),
Chez l'enfant
Selon une grande étude européenne publiée fin 2004 et fondée sur les registres du cancer, l'analyse d'une base de données financée par l'Union européenne regroupant 80 registres de cancers et couvrant environ la moitié des enfants (jusqu'à 14 ans) et un quart des adolescents (15 à 19 ans), a montré que le taux moyen de l'incidence du cancer par classe d'âge dans les années 1990, calculé sur près de 50 000 cas, s'établit à 140 cancers par million d'enfants, contre 118 dans les années 1970 et 124 dans les années 1980. Si les cancers des enfants ne comptent que pour moins de 1 % du nombre total de cancers, et bien qu'ils soient — dans les pays dits « développés » — guéris dans les deux tiers des cas, ces cancers restent, dans les pays riches, la seconde cause de mortalité de l'enfant. Dans les pays industrialisés, environ 1 enfant sur 500 déclare un cancer avant l'âge de 15 ans (presque 1 500 nouveaux cas par an en France, dont 50 % avant l'âge de 6 ans). Les cancers de l'enfant sont en forte augmentation : chez les adolescents, ce taux est de 193 par million au cours des années 1990, contre 147 dans les années 1970 et 165 dans les années 1980. Dans les années 1990, le taux de cancer chez l'enfant était en Europe un peu plus important à l'Est qu'à l'Ouest, à cause de cancers de la thyroïde plus fréquents (attribués aux retombées de Tchernobyl).
Les leucémies (450 cas nouveaux par an en France) sont les cancers les plus fréquents chez l'enfant, devant (principalement) :
des tumeurs cérébrales (300/an en France) ;
des lymphomes (190/an en France, dont 56 % de lymphomes non-hodgkiniens déclarés entre 2 et 3 ans).
Les tumeurs embryonnaires sont plus fréquentes les premières années de la vie, et des sarcomes osseux et des tissus mous chez les grands enfants.
Étude Eurocare, surmortalité chez les enfants
| délais après diagnostic |
surmortalité |
| 0–1 an |
> 10 % |
| 4 année |
2 % |
| 7 année |
1 % |
En raison d'une évaluation difficile des expositions indirectes et des effets de synergies possibles, des relations certaines de cause à effet sont difficiles à établir, mais les pesticides (ingérés ou inhalés par l'enfant, ou ses parents avant la naissance) semblent être l'une des causes d'augmentation, notamment pour les tumeurs du cerveau, avec 9 études sur 16 qui concluent à une relation causale possible en cas d'emploi de sprays insecticides ou d'autres pesticides par les parents, (OR 1,5 ; 2,2) ou par la manipulation de pesticides agricoles (RR 2,0 ; 2,9 ; 3,3) (dans de mêmes conditions environnementales, les enfants sont significativement plus exposés que les adultes aux pesticides, alors même qu'ils y sont a priori plus vulnérables). D'autres cancers de l'enfant semblent induits ou co-induits par des pesticides (leucémie, neuroblastome, tumeur de Wilms, sarcomes des tissus mous, sarcomes d'Ewing, lymphome non-Hodgkinien, cancer colorectal et cancer des testicules). Dans ce dernier cas, un effet perturbateur endocrinien est probable.
Cancers hématopoïétiques de l'enfant
Une étude a confirmé que l'exposition des ménages français aux pesticides domestiques augmente (doublement environ) le risque de cancers hématopoïétiques (cancer du sang) de leur enfant.
Cette étude a exploité le RNHE, le « Registre national des hémopathies malignes de l'enfant » (antérieurement dénommé « Registre national des leucémies de l'enfant ») qui enregistre les cas signalés d'hémopathie maligne ou à la limite de la malignité, chez les enfants habitant en France métropolitaine ayant moins de 15 ans au moment du diagnostic.
L'étude s’est aussi appuyée sur le registre national ESCALE (Étude sur les cancers de l'enfant pour la période 2003-2004).
Les mères d’un échantillon d’enfants atteints de cancers du sang et celles d'un échantillon-témoin ont été questionnées sur l'usage éventuel de pesticides (par la mère ou par le père) dans l’habitation lors de la grossesse ; en différenciant les insecticides (bombes utilisées à la maison, traitement d'animaux de compagnie, ou traitement du jardin ou des cultures, etc.), les herbicides et les fongicides. Les chercheurs ont aussi intégré des paramètres tels que l'âge, le sexe, le degré de d'urbanisation de l’environnement et le type de logement (appartement ou maison).
Le panel retenu pour la période d'étude (2003-2004) était constitué des parents de 7** enfants ayant déclaré une leucémie aiguë, 130 enfants ayant présenté un lymphome de Hodgkin (LH), et 166 cas de lymphome non-hodgkinien (LNH). Ce groupe ayant été comparé à une population-témoin de parents de 1 681 enfants, le dépouillement des questionnaires a montré qu'utiliser des insecticides dans la maison durant la grossesse a significativement augmenté le risque que l’enfant déclare une leucémie aiguë (leucémie lymphoïde ou leucémie myéloïde) ou un lymphome non hodgkinien, surtout un Lymphome de Burkitt (près de 3 fois plus de risque : OR = 2,7 ; IC à 95 %, 1,6-4,5) ou des tumeurs mixtes à cellule de lymphome non hodgkinien (OR = 4,1 ; IC à 95 %, 1,4-11,8). Par contre, l'exposition aux pesticides domestiques n’a pas augmenté le risque de lymphome hodgkinien à sclérose nodulaire (Nodular sclerosis ou « NSHL » pour les anglosaxons), cancer qui touche majoritairement des filles plus âgées.
L'utilisation domestique de pesticides par le père a également semblé lié à une légère augmentation moindre, mais également significative du nombre de leucémies aiguës (OR = 1,5 ; IC à 95 %, 1,2-1,8) et de lymphomes non hodgkiniens NHL (OR = 1,7 ; IC à 95 %, 1,2-2,6), mais les liens avec la leucémie aiguë ne sont plus significatifs après prise en compte de l'usage des pesticides par la mère durant la grossesse.
Cette étude confirme l'hypothèse que l'usage domestique des pesticides joue un rôle dans l'étiologie de ces cancers hématopoïétiques de l'enfance. Les auteurs concluent que la cohérence des résultats avec ceux d'études antérieures soulève à nouveau la question de l'opportunité de prévenir l'usage des pesticides dans l'environnement des femmes enceintes.
Épidémiologie
pas de données
moins de 55
55-80
80-105
105-130
130-155
155-180
180-205
205-230
230-255
255-280
280-305
plus de 305
En 2008, le cancer a causé la mort de 7,6 millions de personnes, surtout dans les pays en voie de développement, selon une étude du Centre international de recherche sur le cancer (CIRC, émanation de l'Organisation mondiale de la santé). En 2008, 56 % des 12,7 millions de nouveaux cas de cancer et 63 % des 7,6 millions de décès associés à un cancer dans le monde sont survenus dans les pays en développement selon une étude fondée sur 27 formes de cancer.
Les cancers les plus fréquemment diagnostiqués dans le monde sont ceux du poumon (12,7 %), du sein (10,9 %) et le cancer colorectal (9,7 %). Les décès les plus fréquents sont provoqués par le cancer du poumon (18,2 %), de l'estomac (9,7 %) et le cancer du foie (9,2 %). Les cancers du col utérin et du foie sont beaucoup plus fréquents dans les régions en développement, tandis que ceux de la prostate et du côlon-rectum sont plus fréquents dans les régions développées.
En prenant en compte le nombre d'habitants de chaque pays, ce sont les pays d'Amérique du Nord, ceux d'Europe de l'Ouest et l'Australie qui enregistrent les taux de mortalité les plus élevés.
Historique
Des cancers étaient déjà décrits dans des textes égyptiens (papyrus Ebers) il y a 3 500 ans ans environ, et en 2013, des archéologues retrouvent des ossements vieux de 3 200 ans porteurs de lésions cancéreuses. C'est Hippocrate qui donna la première définition de la maladie, appelée alors « carcinome » (une variété de cancer) ou « squirre » (tumeur dure et indolore se formant en quelque partie du corps) : une tumeur (gonflement) dure, non-inflammatoire, ayant tendance à récidiver et se généraliser jusqu'à la mort.
En 1906, la première conférence internationale pour l'étude du cancer se réunit à Heidelberg et à Francfort, en Allemagne, sur convocation du Comité central allemand pour l'étude du cancer. On y déclare pour la première fois le cancer comme fléau de l'humanité.
Chez les animaux
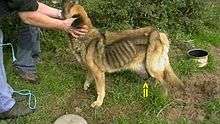
Une chienne avec une tumeur mammaire.
Quelques espèces animales (ex. : requins, rats-taupes nus) semblent épargnées par les cancers. On suppose de plus que, dans la nature, les animaux sauvages victimes de tumeurs sont plus rapidement éliminés par leurs prédateurs ou éliminés par sélection naturelle. Par contre, les animaux domestiques, dont chiens et chats sont fréquemment victimes de cancers semblables à ceux des humains (en particulier : ostéosarcomes, cancer des mamelles, mélanomes buccaux, carcinomes épidermoïdes, tumeurs nasales, carcinome du poumon, sarcomes des tissus mous, et tumeurs malignes non hodgkiniennes, etc.). Ces cancers semblent également de plus en plus fréquents ; c'est même la 1 cause de mortalité des chiens dans le monde (chiens dont l'espérance de vie est en moyenne de 11 ans et trois mois). 27 % des chiens meurent d'un cancer, alors que 18 % meurent d'une affection cardiaque, sachant aussi que les maladies dominantes des chiens adultes sont infectieuses bactériennes, virales ou parasitaires, et que 50 % des chiens seraient obèses (facteurs qui peuvent contribuer à augmenter le risque de certains cancers).
Une médication et des moyens spécifiques (incluant chimiothérapie et radiothérapie) ont été développés pour les animaux, sur la base des mêmes molécules et moyens.
Les animaux de laboratoires sont utilisés comme modèle en cancérologie humaine, y compris en épidémiologie ou pour tester de manière statistiquement significative des médicaments à grande échelle.
Découvertes récentes en cancérologie
Des découvertes dans la recherche sur les cellules souches pourraient expliquer la cancérogenèse de manière plus précise. Jusqu'à récemment un unique modèle était proposé pour expliquer la formation d'un cancer : il est appelé « le modèle stochastique », qui stipule que toute cellule capable de se diviser peut voir son information génétique perturbée (via les mutations dans l'ADN) et acquérir des caractéristiques tumorales lui conférant un pouvoir cancérogène. Plus spécifiquement, ce modèle dit que n'importe quelle cellule capable de se diviser peut être à l'origine d'un cancer, les cancers ne touchant pas les cellules incapables de se diviser comme les neurones.
Un deuxième modèle a été proposé et se base sur le fait que ce sont les cellules souches qui acquièrent des caractéristiques tumorales et qui donc donnent sans cesse des cellules cancéreuses différenciées. Dans ce modèle, les cellules souches sont placées en tête dans la hiérarchie de la formation d'un cancer quelconque. Pour certaines leucémies (cancers du sang) ce sont les cellules souches hématopoïétiques par exemple qui deviennent anormales et qui prolifèrent en trop grand nombre, donnant des cellules différenciées anormales et trop nombreuses. Une autre tentative d'explication a été fournie et stipule qu'une cellule déjà différenciée peut se dédifférencier de façon anormale, revenir au stade de cellule souche et commencer à proliférer comme décrit ci-dessus, pour redonner des cellules différenciées anormales et en grand nombre. Il y a des cellules souches dans tous les tissus renouvelables, ce qui fait que cette théorie n'est pas valable uniquement pour les leucémies mais aussi pour d'autres types de cancers concernant des tissus renouvelables. Cette nouvelle théorie est appuyée par l'observation de certaines tumeurs dites « hétérogènes » (hétérogénéité tumorale), c'est-à-dire que la tumeur possède à la fois des cellules assez différenciées et des cellules indifférenciées que sont les cellules souches cancéreuses (CSC). Il y a donc un gradient de différenciation observé.
Toutefois il se pourrait que certains cancers aient pour origine une seule de ces deux explications (« modèle stochastique » ou « modèle des cellules souches ») ou bien les deux, la formation d'un cancer ne serait également pas identique à celle d'un autre cancer, ce qui rend les recherches difficiles.
Une autre étude récente prouve que les lymphocytes T régulateurs empêchent les réponses cytotoxiques lorsqu'un nouveau cancer se forme, une piste pourrait être de diminuer l'action de ces lymphocytes T régulateurs, sans pour autant susciter des réactions auto-immunes.
Bibliographie
Littérature jeunesse
L'association Sparadrap propose sur son site une liste d'ouvrages jeunesse sur un parent malade ou décédé du cancer.

 词典释义:
词典释义:
 ,
,  症; 肿瘤; 弊端, 恶习
症; 肿瘤; 弊端, 恶习 。
。
 切除手术
切除手术 症
症 症
症 症作斗争
症作斗争 ,
,  瘤:~du sein[du poumon, du foie]乳房[肺,
瘤:~du sein[du poumon, du foie]乳房[肺,  ]
]  ~généralisé扩散了的
~généralisé扩散了的 n. m. 【天】巨蟹(星)座:tropique du~北回归线
n. m. 【天】巨蟹(星)座:tropique du~北回归线
 病,
病,  症,
症,  ; 毒瘤
; 毒瘤




 , 胶样
, 胶样














 茎
茎

 ; 乳[岩、粟]; 乳
; 乳[岩、粟]; 乳



 体
体 ,
, 
 体
体




 , 胚胎
, 胚胎





























 自查盒
自查盒 切除术
切除术