La combustion est une réaction exothermique d'oxydoréduction. Lorsque la combustion est vive, elle se traduit par une flamme dans le cas d'une combustion ou par une explosion, si le front de flamme dépasse la vitesse du son.
On appelle aussi combustion nucléaire la transformation d'atomes provoquée par le fonctionnement d’un réacteur nucléaire, bien qu'il s'agisse de réactions nucléaires et non pas d'oxydoréduction.
La combustion d'un bâton d'encens, se traduisant par la production d'une flamme.
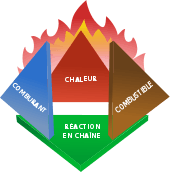
Triangle du feu

La réaction chimique de combustion ne peut se produire que si l'on réunit trois éléments : un combustible, un comburant, une énergie d'activation en quantités suffisantes. C'est pourquoi on parle du « triangle du feu ».
Cependant depuis les années 1980 on a découvert qu'une des étapes indispensable de la réaction chimique est la production de radicaux libres ; cette étape est nécessaire pour que la combustion s'entretienne et que l'on puisse parler d'incendie. C'est la raison pour laquelle on parle depuis de « tétraèdre du feu ».
La disparition de l'un des quatre éléments suffit à arrêter la combustion.
Combustible
Le combustible peut être :
un solide formant des braises (charbon, bois, papier, carton, tissu, PVC, etc.) ;
un liquide ou solide liquéfiable (essence, gazole, fioul, huile, kérosène, PE, PS, etc.) ;
un gaz (gaz naturel, butane, propane, méthane, dihydrogène, etc.) ;
un métal (fer, aluminium, sodium, magnésium, etc.) ;
une huile de cuisson.
Ces cinq types de combustible correspondent, respectivement, aux cinq principales classes de feux A, B, C, D et F.
Comburant
Le comburant est l’autre réactif de la réaction chimique. La plupart du temps, il s’agit de l’air ambiant, et plus particulièrement de l’un de ses composants principaux, le dioxygène. En privant un feu d’air, on l’éteint ; par exemple, si on place une bougie chauffe-plat allumée dans un bocal de confiture et qu’on ferme le bocal, la flamme s’éteint ; à l’inverse, si l’on souffle sur un feu de bois, cela l’active (on apporte plus d’air). Dans certains chalumeaux, on apporte du dioxygène pur pour améliorer la combustion et élever la température de la flamme.
Dans certains cas très particuliers (souvent explosifs comme avec l'aluminium), le comburant et le combustible sont un seul et même corps ; par exemple, la célèbre nitroglycérine, molécule instable comportant une partie oxydante greffée sur une partie réductrice.
Activateur
La réaction est déclenchée par une énergie d’activation, généralement de la chaleur ou une flamme. Par exemple, ce sera l'échauffement par frottement pour une l’allumette, le câble électrique suralimenté qui chauffe l'isolant, ou une autre flamme (propagation du feu), l'étincelle (de l'allume-gaz, de la pierre à briquet ou celle provoquée par une machine électrique qui se met en route ou s’arrête).
Mais il existe d’autres façons de fournir l’énergie d’activation : arc électrique, radiation, élévation de la température par compression de l'air, par exemple dans un moteur Diesel.
Il existe cependant des cas où le facteur déclenchant la combustion n'est pas l'énergie d'activation. Par exemple, l'explosion de fumées est une combustion très violente des gaz imbrûlés présents dans les fumées (voir combustion incomplète) provoquée par un apport soudain d'air, donc de comburant. L'intervalle dans lequel le mélange air/gaz pourra brûler est borné par les limites d'explosivité. Cet intervalle peut varier de quelques pour cent (kérosène) à plusieurs dizaines de pour cent (acétylène).
La production de chaleur par la combustion permet à la réaction de s’auto-entretenir dans la plupart des cas, voire de s'amplifier en une réaction en chaîne (par exemple dans un feu de forêt).
Seuls des matériaux sous forme gazeuse peuvent brûler (car ils offrent la possibilité de très bien se mélanger avec un comburant, ce qui n'est pas le cas des liquides ou des solides où le comburant principal, le dioxygène, ne peut pénétrer au cœur de la substance), c'est pourquoi il faut fournir suffisamment d'énergie à un produit inflammable (qu'il soit solide ou liquide) pour qu'il commence à se vaporiser ou se décomposer en éléments vaporisables et combustibles (comme les terpènes des conifères via une distillation ou une pyrolyse). Le seuil de température atteint à cette occasion est appelé point d'éclair. Certains produits ont leur point d'éclair largement en dessous de la température ambiante, ce qui en fait des substances très inflammables, car il suffit de peu d'énergie d'activation pour amorcer la combustion (une simple étincelle…).
Une allumette jetée dans un bac de gazole à température ambiante n'aura aucun effet, car son point d'éclair étant de 68 °C, en moyenne, suivant les règlements des installations classées et de transport de matières dangereuses, la flamme sera noyée dans le gazole avant d'avoir pu transmettre assez de chaleur pour en vaporiser suffisamment. À l'inverse, une allumette jetée dans un bac d'essence, dont le point d'éclair est d'environ −40 °C, suffira pour enflammer les vapeurs déjà présentes sous forme de gaz à la surface du liquide. À cette occasion, on remarquera que :
l'essence s’enflammera avant que l’allumette n'ait atteint le liquide (c'est donc l'essence vaporisée qui brûle) ;
la flamme restera au-dessus du liquide, brûlant l'essence sous forme gazeuse (le liquide ne brûle pas mais s'évapore très rapidement sous l'effet de la chaleur) ;
l'allumette (si elle est lestée avec deux/trois tours de fil de fer) coulera et s'éteindra dans l'essence par manque de dioxygène.
Lorsque la combustion produit suffisamment d'énergie pour s'entretenir d'elle-même, la température a dépassé le point d'inflammation.
Radicaux
Une réaction chimique est une recombinaison de molécules. Elle passe par une étape intermédiaire au cours de laquelle les molécules sont « déstructurées » mais pas encore recombinées ; celles-ci sont appelées radicaux et sont très réactives. Dans le cas de la combustion, les radicaux sont créés par rupture de liaison chimique due à l'énergie thermique, et ils vont pouvoir agir sur les molécules du produit (libérant d'autres radicaux) et engendrant de fait une réaction en chaîne qui va perdurer tant que les deux conditions suivantes seront réunies : présence de combustible et de comburant.
Procédés d'extinction d'une combustion
Pour interrompre une réaction de combustion, il faut supprimer un des quatre éléments du tétraèdre du feu :
dans le cas d'un combustible solide, le facteur limitant est l'apport en comburant (air), le feu produisant sa propre chaleur ; l'eau étouffe donc le feu par dégagement de vapeur qui entraîne l'air et empêche l'alimentation en dioxygène ;
dans le cas d'une atmosphère prémélangée, on ne peut pas séparer le combustible du comburant, la seule action possible consiste à refroidir l'atmosphère pour empêcher la flamme de se propager (la vapeur d'eau joue également un rôle de diluant) ;
La formule brute de ce composé est CF3Br, cela donne deux radicaux lors d'une combustion (CF3• et Br•) qui vont pouvoir se combiner chacun avec un radical hydrogène (H•), formant un composé restant stable malgré la combustion : CF3• + H• → CF3H Br• + H• → BrH. De nombreux objets de la vie courante intègrent d'ailleurs des composés bromés ou chlorés à effet de retardateur de flammes : plastiques (pour les appareils électriques), isolants thermiques, textiles, etc. ; 2. inhibition mécanique : les extincteurs à poudre piègent également les radicaux (en plus de leurs autres actions), mais par absorption (« étouffement » des radicaux dans le produit). Et au-delà de 190 °C, certaines poudres (entre autres le bicarbonate de sodium) se vitrifient en un vernis peu soluble dans l'eau et ignifugeant.
Historique
La découverte de la combustion par le dioxygène est imputable au chimiste français Lavoisier, en 1775, car on considère généralement que Joseph Priestley, qui a isolé pour la première fois du dioxygène (impur) en 1774 n'a pas pour autant découvert le rôle de comburant du dioxygène. En effet, dans la mesure où il se fondait sur la théorie du phlogistique, cela l’empêchait de concevoir le rôle du dioxygène dans la combustion.
Selon le philosophe des sciences Thomas Samuel Kuhn, la découverte de la combustion par le dioxygène constitue une révolution scientifique majeure dans l'histoire des sciences. Elle a constitué un changement de paradigme, en remplaçant l'ancien paradigme du phlogistique.
La combustion par le dioxygène a eu au XIX siècle, et plus encore au XX siècle, de nombreuses applications industrielles (voir section Applications ci-dessous). Elle a cependant conduit pendant l'ère industrielle à l'émission massive de dioxyde de carbone, qui est un gaz à effet de serre contribuant pour une large part aux phénomènes de dérèglement climatique.
Caractéristiques
Combustion rapide
La combustion rapide est une forme de combustion au cours de laquelle de grandes quantités de chaleur et d'énergie sous forme de lumière sont relâchées, donnant naissance au feu. Elle est utilisée dans certaines machines telles que les moteurs à combustion interne ou les armes thermobariques.
Combustion lente
La combustion lente est une réaction se réalisant à des températures peu élevées.
On peut citer le cas de la respiration cellulaire : cette lenteur due à des enzymes spécifiques permettent d'augmenter les réactions d'oxydoréduction et ainsi d'obtenir un très bon rendement par récupération d'une grande partie de l'énergie.
Combustion complète ou stœchiométrique
Lors d'une combustion complète, le réactif réagira avec le comburant jusqu'à former des produits qui ne pourront plus être oxydés, c'est-à-dire que ces produits ne peuvent plus réagir avec le comburant : les produits ont atteint un degré de stabilité qu'une réaction de combustion ne peut modifier. Dans le cas d'un hydrocarbure réagissant avec le dioxygène, les produits de combustion sont le dioxyde de carbone et l'eau. Il existe pour chaque élément un produit de combustion stable, ainsi une combustion complète fournit les mêmes produits de réactions quels que soient les réactifs.
Une combustion complète permet d'obtenir la quantité maximale d'énergie disponible par une substance et cette énergie est définie comme étant le pouvoir calorifique.
Combustion turbulente
La combustion turbulente est une combustion caractérisée par des flux de chaleur. Elle est souvent utilisée dans l'industrie (par exemple, les turbines à gaz et les moteurs Diesel) car la chaleur facilite l'opération de mélange entre le combustible et l'oxydant.
Combustion incomplète
La combustion incomplète a lieu quand la quantité de comburant est insuffisante pour permettre la réaction complète du combustible ou lorsque le temps de contact, à une température rendant la combustion possible, est trop faible. Elle produit des résidus de combustion, sous forme de cendres qui émettent des fumées : certains composés, tels que monoxyde de carbone (gaz mortel), particules de carbone pur (suie, goudron, cendres), oxydes d'azote (NOx), hydrocarbures (du benzène cancérigène par exemple) sont très toxiques pour l'homme et pour l'environnement, ou fortement toxiques comme les HAP ou les composés organiques volatils (COV).
La réaction de combustion est habituellement incomplète. Seul le contrôle des conditions permet d'obtenir une combustion complète, en apportant un excès de dioxygène à haute température par exemple. En cas de combustion incomplète, il est possible de traiter les fumées pour réduire les imbrûlés ainsi que le font les pots d'échappement et les filtres à particules des moteurs d'automobiles. La présence de catalyseurs y assure alors une seconde combustion à plus faible température. Des filtres à particules sont également développés pour les équipements de combustion du bois, un combustible solide étant particulièrement exposé au risque de combustion incomplète.
Chimie de la combustion
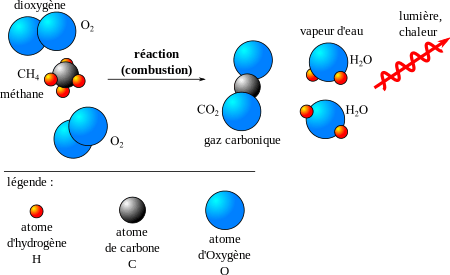
La combustion est une réaction chimique où des molécules complexes sont décomposées en molécules plus petites et plus stables via un réarrangement des liaisons entre les atomes. La chimie de la combustion est une composante majeure de la chimie à haute température qui implique principalement des réactions radicalaires. Toutefois il est possible de traiter la combustion via une réaction globale unique.
Exemple : Combustion du méthane dans le dioxygène : CH4 + 2O2 → CO2 + 2H2O. Le dioxyde de carbone CO2 et l’eau H2O sont plus stables que le dioxygène et le méthane.
La combustion est une réaction d'oxydoréduction, en l’occurrence l’oxydation d’un combustible par un comburant :
le combustible est le corps qui est oxydé durant la combustion ; c'est un réducteur, il perd des électrons ;
le comburant est le corps qui est réduit ; c'est un oxydant, il gagne des électrons.
Comme pour toutes réactions chimiques, un catalyseur facilite la combustion et comme cette dernière possède souvent une énergie d'activation élevée, l'usage d'un catalyseur permet de travailler à une température moins élevée. Ceci permet une combustion complète comme dans le cas des pots catalytiques qui grâce à la présence de métaux catalytiques brûlent les résidus des gaz d'échappement à une température inférieure à celle régnant dans le moteur.
Dans le cas des combustibles solides, l’énergie d’activation va permettre de vaporiser ou de pyrolyser le combustible. Les gaz, ainsi produits, vont se mélanger au comburant et donner le mélange combustible. Si l’énergie produite par la combustion est supérieure ou égale à l’énergie d’activation nécessaire, la réaction de combustion s’auto-entretient.
Énergie dégagée et pouvoir calorifique
La quantité d'énergie dégagée par la réaction est supérieure à la quantité d'énergie nécessaire à l'amorcer.
La quantité d’énergie produite par la combustion est exprimée en joules (J) ; il s'agit de l'enthalpie de réaction. Dans les domaines d'application (fours, brûleurs, moteurs à combustion interne, lutte contre incendie), on utilise souvent la notion de pouvoir calorifique, qui est l'enthalpie de réaction par unité de masse de combustible ou l'énergie obtenue par la combustion d'un kilogramme de combustible, exprimée en général en kilojoule par kilogramme (noté kJ/kg ou kJ·kg).
Les combustions d'hydrocarbures dégagent de l'eau sous forme de vapeur. Cette vapeur d'eau contient une grande quantité d'énergie. Ce paramètre est donc pris en compte de manière spécifique pour l'évaluation du pouvoir calorifique, et l'on définit :
le pouvoir calorifique supérieur (PCS) : « Quantité d'énergie dégagée par la combustion complète d'une unité de combustible, la vapeur d'eau étant supposée condensée et la chaleur récupérée » ;
le pouvoir calorifique inférieur (PCI) : « Quantité de chaleur dégagée par la combustion complète d'une unité de combustible, la vapeur d'eau étant supposée non condensée et la chaleur non récupérée ».
La différence entre le PCI et le PCS est la chaleur latente de vaporisation de l’eau (Lv), qui vaut à peu-près 2 250 kJ·kg (cette dernière valeur dépend de la pression et de la température), multipliée par la masse de vapeur produite (m).
On a la relation : PCS = PCI + m·Lv.
Vitesse du front de flamme et explosion
Dans le cas d'une flamme de prémélange, la combustion est caractérisée par la vitesse du front de flamme :
La déflagration : la vitesse du front de flamme est inférieure à la vitesse du son (343,34 m·s sous une pression de 1 atm à 20 °C dans l'air sec) ;
La détonation : la vitesse du front de flamme est supérieure à la vitesse du son, et peut atteindre plusieurs kilomètres par seconde.
Feux de métaux
L'oxydation des métaux est en général lente. La chaleur dégagée est donc faible et est lentement dissipée dans l'environnement ; c'est le domaine de la corrosion (par exemple la rouille du fer et de l'acier).
Cependant, dans certains cas, l'oxydation est violente et constitue donc une combustion. Il existe cinq cas notables :
combustion dans l'air du magnésium : le magnésium brûle facilement, en émettant une lumière très vive et blanche ; il était utilisé auparavant pour les flashs photographiques ;
combustion du sodium dans l'eau : ce n'est pas à proprement parler le sodium qui brûle ; le sodium réagit violemment avec l'eau et provoque un dégagement de dihydrogène, et avec la chaleur produite par la réaction, le dihydrogène s'enflamme dans l'air ;
aluminothermie : le comburant est ici un oxyde métallique, il s'agit d'une réaction chimique entre deux solides ;
combustion à haute température et forte concentration de dioxygène : lorsque le métal est chauffé très fort et que l'on envoie du dioxygène pur, la réaction est suffisamment rapide pour s'auto-entretenir ; ce phénomène est utilisé pour l'oxycoupage au chalumeau, la lance thermique, et c'est aussi l'accident du « coup de feu » qui peut survenir avec le détendeur d'une bouteille de dioxygène (par exemple dioxygène médical ou bouteille de chalumeau) ;
combustion d'un métal sous forme de poudre ou de mousse. La réaction chimique se fait au contact entre le métal et l'air. Or, dans le cas d'une mousse ou d'une poudre, cette surface de contact (la surface spécifique) est très grande, la réaction est donc rapide et la chaleur dégagée importante ; c'est un phénomène comparable au coup de poussière.
Applications
Dans les transports
La combustion est utilisée massivement dans les moteurs à explosion, pour la propulsion des véhicules (automobiles, camions, avions à hélice, motocyclettes, bateaux, etc.), et aussi pour des outils mobiles (tondeuses à gazon, tronçonneuses, etc.) et pour des installations fixes (groupes électrogènes, pompes, etc.).
À la maison
Dans le domaine domestique, la combustion sert essentiellement à :
faire cuire les aliments : soit en utilisant directement la flamme (cuisinière à gaz, cuisson au feu de bois), soit en utilisant le chauffage par rayonnement (braises du barbecue, parois du four) ;
se chauffer : chauffage au gaz, feu de cheminée, poêle à bois ;
produire de l'eau chaude sanitaire chauffe eau à gaz;
s'éclairer : bougies, chandelles, feu de cheminée.
Certains appareils utilisent également un moteur à combustion interne : tondeuse à gazon, tronçonneuse, etc.
La combustion peut être remplacée par des installations électriques : cuisinière électrique, chauffe-eau électrique, ampoule, moteurs électriques, etc.
Historiquement, le feu domestique est un symbole très fort ; le terme « foyer » désigne à la fois l'emplacement du feu, et le lieu de vie de la famille.
Dans la production d'électricité
La combustion est utilisée dans les centrales thermiques utilisant des combustibles fossiles (charbon, gaz naturel, pétrole), des combustibles renouvelables (déchets agricoles ou de l'exploitation forestière et biomasse si exploitée durablement) ou différents types de déchets (dans les incinérateurs d'ordures ménagères par exemple), pour dégager de la chaleur, qui produit de l'électricité grâce à des turbo-alternateurs.
Dans la métallurgie
Dans la nature, les métaux sont en général présents sous la forme de minerais. Certains minerais peuvent être réduits, c'est-à-dire transformés en métal, par réaction avec un gaz issu d'une la combustion ; c'est le domaine de la pyrométallurgie. L'exemple le plus connu est la réduction du minerai de fer par le monoxyde de carbone dans les bas-fourneaux puis les hauts-fourneaux. Cela concerne également l'obtention du nickel, du cuivre, du zinc, du titane et du zirconium, même s'il existe d'autres voies d'élaboration.
La combustion peut également servir à chauffer du métal pour mieux le déformer (laminage, forgeage) ou pour le faire fondre (fonderie, soudage au chalumeau, brasage, oxycoupage). En dehors de l'oxycoupage, on peut utiliser l'énergie électrique comme alternative à la combustion.
Dans la production de ciment
La fabrication du ciment requiert beaucoup d'énergie pour élever le mélange qui va produire le clinker à plus de 1 450 °C, cette énergie est apportée par la combustion d'une grande variété de combustibles (gaz, fuel) et de déchets (huiles usagées, pneumatiques broyés, farines animales, résidus d'épuration de station d'épuration des eaux).
En astronautique
La combustion est utilisée dans le domaine de l’astronautique pour fournir l’énergie de propulsion des véhicules spatiaux. Les termes correspondants en anglais sont burning et combustion.
Selon le type de combustion employée dans un propulseur, on parle de :
combustion en cigarette (en anglais cigarette burning et end burning) qui est une combustion d'un bloc de poudre caractérisée par une surface plane de combustion progressant dans la direction longitudinale, vers l'avant ou vers l'arrière ;
combustion érosive (erosive burning) qui est une combustion d'un bloc de poudre dans le cas où l'écoulement des gaz de combustion provoque une érosion du bloc ;
combustion transversale extérieure (external burning) qui est une combustion d'un bloc de poudre caractérisée par une surface de combustion s'étendant longitudinalement et progressant de l'extérieur vers l'intérieur ;
combustion transversale intérieure (internal burning) qui est une combustion d'un bloc de poudre qui s'effectue de l'intérieur vers l'extérieur à partir d'un canal central.

燃烧是物体快速氧化,产生光和热的过程。 燃烧的本质是氧化还原反应。广义燃烧不一定要有氧气参加,任何发光、发热、剧烈的氧化还原反应,都可以叫燃烧。
燃烧需要三种要素并存才能发生,分别是可燃物如燃料、助燃物如氧气、以及温度要达到燃点。燃烧三要素并称为火三角。助燃物是燃烧反应中的氧化剂,氧气是燃烧反应中最常见的助燃物,但其他化合物也可能是助燃物,例如镁带可以在二氧化碳中燃烧,此时二氧化碳即为助燃物。
在一个完整的燃烧反应中,一物质和氧化剂(如氧气、氟气)反应,其生成物为燃料的各元素氧化反应后的产物。例如:
- CH4 + 2 O2 → CO2 + 2 H2O + 能量
- CH2S + 6 F2 → CF4 + 2 HF + SF6
- 2 H2 + O2 → 2 H2O(g) + 能量
然而在真实情况下不可能达到完整的燃烧反应。当燃烧反应达到化学平衡时,会产生多种主要和次要产物;例如燃烧碳时会产生一氧化碳和煤烟。此外,在大气中发生燃烧反应时,因为大气中含有78%的氮气的缘故,会产生各式各样的氮氧化物和氮化物。
种类
完全燃烧和不完全燃烧 完全燃烧 甲烷的燃烧 完全燃烧是指燃料和充量的助燃物完全进行燃烧反应。当碳氢化合物在氧气中燃烧时,一般会产生二氧化碳和水。化学元素在燃烧时多半会生成氧化物﹐例如碳会变成二氧化碳﹐硫会变成二氧化硫﹐铁会变成氧化铁。若助燃物是氧气时,氮一般是视为不会燃烧,但若助燃物是空气时,会形成少量的氮氧化物(NOx)。 燃烧后的产物不一定是氧化数最高的氧化数,而且形成的氧化数和温度有关。例如将硫在空气中燃烧,不容易形成三氧化硫。在温度超过2,800 °F(1,540 °C)时,会开始产生NOx,更高温时的NOx更多。NOx的量也会随氧过量的比例而变。 常见的完全燃烧与不完全燃烧被应用在内燃机(引擎)上面,由于太完美的完全燃烧会产生大量氮氧化物,所以许多引擎会设计改变燃烧效率,降低燃烧效率,虽然排气会有较多的碳(黑)产生,但能大大降低有害物质氮氧化物(NOx)产生。 以较新型的车辆来说;汽油车的应用多为由电脑控制喷油时间破坏燃烧,柴油则多半使用EGR(废气再回燃)系统,将废气由导管在送回进气岐管破坏燃烧。以降低氮氧化物(NOx)排放。
本质
连锁反应理论 近代的连锁反应理论将燃烧解释为游离基的链式反应,在反应过程中发光、放热。这个理论将燃烧的链式反应分为三个阶段:“链引发”、“链传递”、“链终止”。 链引发阶段即产生游离基并形成反应链的阶段。产生游离基的方法有很多,包括但不限于点燃、光照、辐射、催化、加热。少数物质间会自发化合引发燃烧,如氟气和氢气在冷暗处就能剧烈燃烧引发爆炸。 链传递阶段,游离基反应的同时又产生更多的游离基,使燃烧持续甚至扩大。 链终止阶段,游离基失去能量或者所有物质反应尽,没有新游离基产生而使反应链断裂,反应结束。

 词典释义:
词典释义:


 ; 易
; 易