La sursaturation est la condition chimique où une solution contient plus de soluté qu'elle ne peut en dissoudre normalement. Il réfère également à la condition physique où la pression partielle d'un gaz dans un mélange gazeux dépasse la pression de vapeur saturante, en particulier dans l'air.
En général la solubilité augmente avec la température et pour produire ces solutions, c'est un changement de la température d'une solution saturée qui causera la sursaturation. C'est un état métastable et le soluté en sursaturation précipite à la moindre perturbation donnant des cristaux dans un liquide ou des gouttelettes dans un gaz.
Chimie
Pour obtenir une solution sursaturée, il faut chauffer le solvant, y dissoudre le maximum de soluté et laisser la solution refroidir le plus lentement possible. L'ajout d'un germe de cristal de soluté à une solution sursaturée entraine la croissance de celui-ci et cela peut être une voie d'obtention de cristaux de bonne qualité.
Météorologie
Lors qu'un échantillon d'air contenant une pression partielle de vapeur d'eau à saturation est refroidi, il entre en sursaturation par rapport au rapport de mélange de saturation par rapport à l'eau à la même température et la même pression. S'il existe des noyaux de condensation, l'excès de vapeur s'y déposera et formera des gouttelettes de nuages. S'il n'y en a pas, il faudra un contact avec un objet pour avoir déposition, c'est le cas de la rosée.
Lorsque la température de l'air est sous le point de congélation, en plus de la saturation par rapport à l'eau, il existe la saturation par rapport à la glace. Celle-ci est plus faible que la première et la sursaturation par rapport à la glace est atteinte plus rapidement que celle par rapport à l'eau. Cela implique que s'il y a des noyaux glacigènes, il y aura formation de cristaux de glace avant ceux de gouttelettes de nuages à ces températures. S'il n'y en a pas, la vapeur excédentaire pourra se déposer sur des objets et former de la gelée blanche.
溶液中的溶质含量超过当前温度和压力下该物质饱和溶液中的溶质含量,而仍能稳定存在的现象称过饱和。该溶液称为过饱和溶液。过饱和也可以指蒸汽中某物质蒸汽压超过该温度和压力下该物质的饱和蒸汽压而不发生相变的现象。该蒸汽称为过饱和蒸汽。高温下的饱和溶液降温或高压下的气体溶液降低压力时有可能形成过饱和溶液,形成的难易程度与溶质与溶剂的性质有关。
过饱和体系处于热力学介稳态,外界条件变化时或长时间静置后会发生相变,转变成该物质的饱和溶液和游离溶质。不同物质的过饱和溶液稳定性不同。搅拌,震荡,加入晶核或杂质等操作会加速此过程。
溶液相关条目 溶液 理想溶液 · 水溶液 · 固溶体 · 缓冲溶液 · 弗洛里-哈金斯 · 混合物 · 悬浮液 · 胶体 · 相图 · 低共熔点 · 合金 · 饱和 · 过饱和 · 连续稀释 浓度 与相关量 体积莫耳浓度 · 质量浓度 · 计数浓度 · 体积浓度 · 当量浓度 · 百分比溶液 · 重量克分子浓度 · 摩尔分数 · 质量分数 · 混合比例 溶解度 溶解平衡 · 总溶解固体 · 溶解 · 溶剂壳 · 溶解热 · 晶格能 · 拉乌尔定律 · 亨利定律 · 溶解度表 · 溶解度图 溶剂 (分类) · 酸度系数 · 质子溶剂 · 无机非水溶剂 · 溶剂化 · 溶剂的沸点和凝固点列表 分配系数 · 极性 · 疏水性 · 亲水性 · 亲脂性 · 两亲分子

 词典释义:
词典释义:

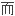

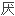

 ;
; ;
;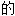 ;
;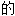 ,液体
,液体 ;
; ,环境
,环境 ;
; , 溺死
, 溺死 ;
;