
La titrimétrie ou titrage est une technique de dosage utilisée en chimie analytique afin de déterminer la concentration d'une espèce chimique en solution (ou titre d'une solution).
La méthode de titrage la plus utilisée est le titrage volumétrique. Elle consiste à utiliser une solution de concentration volumique connue (appelée titrant) afin de neutraliser une espèce contenue dans la solution inconnue (appelée analyte ou espèce titrée). Une autre méthode de titrage plus rare est le titrage gravimétrique. Cet article traitera uniquement du titrage volumétrique.
Réactions de titrage
Les réactions chimiques de l'analyse titrimétrique appartiennent à quatre classes principales. Les trois premières reposent sur la combinaison d'ions. La quatrième implique des changements d'état d'oxydation, c'est-à-dire des transferts d'électrons :
Le titrage acido-basique (en) est basé sur les réactions acido-basique. Tous les acides et les bases peuvent être titrés avec des solutions de bases fortes ou d’acides forts respectivement. Ce sont les titrages volumétriques les plus répandus. Selon le type d'agent titrant, on parle de :
titrage acidimétrique ou titrage acide-base : l'opérateur fait couler goutte à goutte un acide dans un volume déterminé de base ;
titrage alcalimétrique ou titrage base-acide : l'opérateur fait couler goutte à goutte une base dans un volume déterminé d'acide.
Le titrage par complexation (en) est basé sur les réactions de complexation. Le réactif titrant forme un complexe soluble avec l’ion métallique à titrer. Parmi les agents complexants, l’acide éthylènediaminetétraacétique (EDTA) occupe une place importante dans les titrages de ce type.
Le titrage par précipitation est basé sur les réactions de précipitation. Ce titrage est basé sur la formation de composés de solubilité limitée. Le titrage par précipitation est limité par la faible vitesse de formation de la plupart des précipités. Le réactif précipitant le plus utilisé est le nitrate d'argent. On parle d'argentimétrie.
Le titrage par oxydo-réduction (en) est basé sur les réactions d'oxydo-réduction. Les oxydants peuvent être titrés par des réducteurs et vice versa. Cependant, n’importe quel oxydant ne peut pas être titré par n’importe quel réducteur. L’échelle des potentiels normaux est d’une grande utilité puisqu’elle peut renseigner sur la possibilité du titrage. Les principales méthodes oxydoréductimétriques sont la manganimétrie (permanganate de potassium), la cérimétrie, la chromimétrie (dichromate de potassium) et principalement l’iodométrie sous ses différentes formes.
Point d'équivalence
Le point d'équivalence est connu entre autres, grâce à un indicateur coloré ajouté dans la solution inconnue (cet indicateur change de couleur au moment de la neutralisation) ou grâce à une variation du potentiel ou du pH (mesuré au moyen d'une électrode trempant dans la solution inconnue).
Définition de l'équivalence
Avant l'équivalence, la solution titrante, immédiatement consommée, est limitante. Il y a diminution de la concentration en ions titrés, et augmentation de la concentration en ions témoins de la solution titrante, ce qui entraîne une diminution ou une augmentation (si les ions témoins sont plus conducteurs que les ions titrés) de la conductivité de la solution.
À l'équivalence, la solution titrante et la solution titrée ont réagi dans les proportions stœchiométriques. Les deux réactifs sont limitants et entièrement consommés (à l'exception des ions témoins).
Après l'équivalence, l'espèce dont on cherche le titre, totalement consommée, devient limitante. Par conséquent, si l'on continue d'ajouter de la solution titrante, le réactif titrant n'est pas consommé : cela permet de savoir que l'équivalence a été dépassée.
L'équivalence est donc le changement de réactif limitant.
Titrages direct et indirect
Titrage direct : l'analyte A réagit directement avec le réactif titrant B :
Titrage indirect : l'analyte A réagit dans une première réaction chimique et l'équivalence est déterminée avec une autre réaction chimique : Titrage en retour : l'analyte A réagit en premier lieu avec B en excès connu, on titre ensuite l'excès restant de B par un nouveau réactif E. A + B en excès connu → C + D B restant + E → F + G Titrage par déplacement : l'analyte A réagit en premier lieu avec B en excès inconnu, ensuite le produit C formé par cette réaction est titré par un nouveau réactif E.
Titrage en retour : l'analyte A réagit en premier lieu avec B en excès connu, on titre ensuite l'excès restant de B par un nouveau réactif E. A + B en excès connu → C + D B restant + E → F + G
Titrage par déplacement : l'analyte A réagit en premier lieu avec B en excès inconnu, ensuite le produit C formé par cette réaction est titré par un nouveau réactif E.
Matériel nécessaire
On utilise en général une burette graduée quand le titrage est manuel ou un titrimètre automatique quand on souhaite améliorer la répétabilité et la traçabilité. Le volume de l'échantillon est prélevé au moyen d'une pipette de volume déterminé et est placé dans un erlenmeyer ; un bécher convient mieux s'il faut placer les sondes pH/conductimétriques. La burette contient toujours la solution de réactif titrante dont on connaît la concentration. La graduation de la burette indique le volume versé de solution titrante et donc donnera le point à l'équivalence. La solution à doser sera toujours dans un bécher ou autre récipient propre, son volume sera exactement connu.
Titrage en solution aqueuse
Pour réaliser un titrage, on réalise une réaction chimique où l'espèce en solution réagit avec une autre substance. L'espèce à doser est appelée réactif titré et la substance ajoutée est appelée réactif titrant.
Selon la méthode utilisée pour la détection du point de neutralisation, il est possible de réaliser un titrage par indicateurs colorés, un titrage conductimétrique, un titrage potentiométrique (pH-métrique dans le cas d'un titrage acide-base), un titrage spectrophotométrique, etc.
Titrage pH-métrique
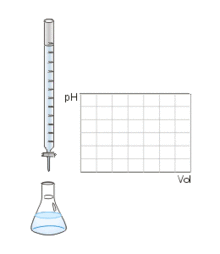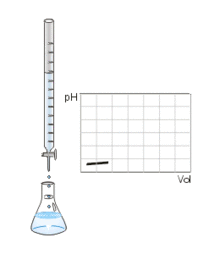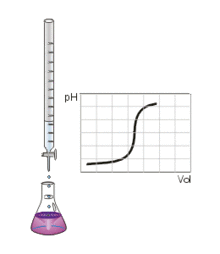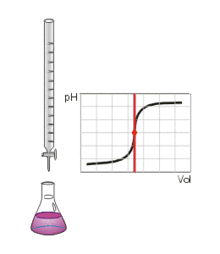
Ce type de titrage est réalisable uniquement avec des acides et des bases, faibles ou forts, et au moyen d'un pH-mètre.
Titrage d'un acide fort par une base forte
En solution, les acides forts comme l'acide chlorhydrique sont totalement dissociés et donnent des ions H 3 O + {\displaystyle {\rm {H_{3}O^{+}}}} . De même, les bases fortes se dissocient totalement pour libérer des ions H O − {\displaystyle {\rm {HO^{-}}}} .
Les ions et réagissent de la façon suivante :
Au volume à l'équivalence, tous les ions H 3 O + {\displaystyle {\rm {H_{3}O^{+}}}} et H O − {\displaystyle {\rm {HO^{-}}}} ont réagi, la seule réaction qui se produit est celle de l'autoprotolyse de l'eau. Le pH est alors égal à 7. L'équivalence est indiquée soit par un indicateur de pH, soit indirectement par une courbe de titrage représentant le pH en fonction du volume de base versé. On doit pour cela relever les valeurs du pH-mètre pour chaque millilitre de solution versée. Quand le pH commence à augmenter de façon significative, verser alors 0,2 ml de solution entre chaque mesure de pH. Une fois que le pH sera redevenu relativement stable, refaire une mesure de pH tous les millilitres. En traçant la courbe du pH en fonction du volume de base versée, on obtient la courbe représentée comme sur le dessin ci-contre. Pour retrouver le volume à l'équivalence, on doit tracer deux tangentes de part et d'autre du point d'inflexion (qui correspond à l'équivalence). Les tangentes doivent être parallèles. Tracer une perpendiculaire à ces deux droites, puis grâce à un compas, tracer la médiatrice de la perpendiculaire. La médiatrice doit être parallèle aux tangentes. Le volume à l'équivalence est l'endroit où la médiatrice et la courbe se rencontrent, pour un pH de 7.
Calculs
Le but d'un titrage est de trouver la concentration en un élément donné. Il existe pour cela deux moyens possibles : par le calcul et par un tableau d'avancement. Dans les deux cas il faut connaître l'équation bilan de la réaction.
Méthode considérant la stœchiométrie
À l'équivalence, on a : t A + p B {\displaystyle tA+pB} → p r o d u i t {\displaystyle produit}
donc : p {\displaystyle p} × n A = t {\displaystyle n_{A}=t} × n B {\displaystyle n_{B}}
d'où : p ( c A {\displaystyle p(c_{A}} × V A ) = t ( c B {\displaystyle V_{A})=t(c_{B}} × V B ) {\displaystyle V_{B})}
donc : c A = t ( c B × V B ) p V A {\displaystyle c_{A}={\frac {t(c_{B}\times V_{B})}{pV_{A}}}}
avec :
c A {\displaystyle c_{A}} : concentration molaire de la solution inconnue en mol·L ;
V A {\displaystyle V_{A}} : volume d'échantillon utilisé en litres (L) ;
c B {\displaystyle c_{B}} : concentration molaire de la solution connue en mol·L ;
V B {\displaystyle V_{B}} : volume de titrant coulé en litres (L) ;
p et t : coefficients stœchiométriques ;
Cette formule est générale quels que soient les coefficients (ou nombres) stœchiométriques.
En raisonnant avec les concentrations, les coefficients stœchiométriques interviennent.
Tableau d'avancement
Le bilan de la réaction s'écrit comme ceci :
| État initial | ||||
| État intermédiaire | ||||
| État final |
Au début du titrage, (quand on n'a encore rien versé), on n'a que des réactifs et aucun produit de réaction. Au fur et à mesure que la réaction se déroule, une quantité x de réactif disparaît, alors qu'en même temps une quantité x de produit apparaît. C'est l'application de la loi de Lavoisier. À la fin du titrage, c'est-à-dire quand un des réactifs a totalement disparu (celui se trouvant dans l'erlenmeyer) on a atteint l'avancement maximal, la réaction ne peut pas aller plus loin.
À ce moment-là :
n H 3 O + − x = 0 {\displaystyle n\mathrm {H} _{3}\mathrm {O} ^{+x=0}
n H O − − x = 0 {\displaystyle n\mathrm {H} \mathrm {O} ^{-x=0}
donc : n H 3 O + = n H O − {\displaystyle n\mathrm {H} _{3}\mathrm {O} ^{+}=n\mathrm {H} \mathrm {O} ^{-}}
c H 3 O + = c H O − × V H O − V H 3 O + {\displaystyle c_{\mathrm {H_{3}O^{+}} }={\frac {c_{\mathrm {H} \mathrm {O} ^{-}}\times V_{\mathrm {H} \mathrm {O} ^{-}}}{V_{\mathrm {H_{3}O^{+}} }}}} .
Ce tableau permet de comprendre ce qui se passe pendant la réaction et de ne pas se tromper avec les coefficients. En effet, on a juste à les reporter devant le x. Normalement quand on a de l'eau dans la réaction on doit écrire « en excès » (on a toujours plus d'eau qu'il n'en faut pour que la réaction se déroule).
Calcul d'un excès
Au départ la solution titrée est en excès. Après l'équivalence, c'est la solution titrante qui est en excès. Pour une réaction acido-basique, l'acide est limitant au début et pour une oxydoréduction, c'est l'oxydant qui est limitant avant l'équivalence.
Un excès est une partie des réactifs qui ne réagit pas pendant une réaction chimique et qui se retrouve donc dans les produits de la réaction. On peut doser l'excès de réactif avec une deuxième réaction chimique : c'est un dosage en retour.
Rappels
Le nombre de mole n correspond à la quantité de matière d'une espèce chimique.
La masse molaire M d'un élément est la quantité de matière qu'il faut pour avoir une mole de cet élément.
Exemple : MC = 12 g, il faut 12 grammes de carbone pour avoir 1 mole.
La masse m est la quantité de matière pesée.
La concentration est la quantité de matière contenue dans un litre de solution. Elle est exprimée en mol/L pour la concentration molaire c(1) ou en g/L pour la concentration massique ρ(2).
Exemple de calcul
On fait réagir du chlorure de sodium NaCl avec du nitrate d'argent AgNO3.
On verse 10 ml de NaCl à 0,2 mol/L dans un bécher contenant 20 ml de AgNO3 à 0,2 mol/L.
M A g {\displaystyle {\rm {M_{Ag}}}} = 47 g/mol
M N {\displaystyle {\rm {M_{N}}}} = 14 g/mol
M O {\displaystyle {\rm {M_{O}}}} = 16 g/mol
Détermination de la masse de l'excès de AgNO3 :
| + | = | ||||
|---|---|---|---|---|---|
| État initial | |||||
| État intermédiaire | |||||
| État final |
n C l − − x max = 0 {\displaystyle n\mathrm {C} \mathrm {l} ^{-x_{\text{max}}=0}
x max = n C l − {\displaystyle x_{\text{max}}=n\mathrm {C} \mathrm {l} ^{-}}
n A g + − x max = n ′ A g + {\displaystyle n\mathrm {A} \mathrm {g} ^{+x_{\text{max}}=n'\mathrm {A} \mathrm {g} ^{+}}
n A g + − n C l − = n ′ A g + {\displaystyle n\mathrm {A} \mathrm {g} ^{+n\mathrm {C} \mathrm {l} ^{-}=n'\mathrm {A} \mathrm {g} ^{+}}
n ′ A g + = c A g N O 3 × V A g N O 3 − c NaCl × V NaCl {\displaystyle n'\mathrm {A} \mathrm {g} ^{+}=c_{\mathrm {AgNO_{3}} }\times V_{\mathrm {AgNO_{3}} c_{\text{NaCl}}\times V_{\text{NaCl}}}
m A g N O 3 = n ′ A g + × M A g N O 3 {\displaystyle m_{\mathrm {AgNO_{3}} }=n'\mathrm {A} \mathrm {g} ^{+}\times \mathrm {M} _{\mathrm {AgNO_{3}} }} .
Articles connexes
Poids équivalent
Bibliographie
L. Lopes, « Réactions totales en solution aqueuse », Bulletin de l’union des physiciens, vol. 99, n 872(1), mars 2005, p. 385-396 (lire en ligne [PDF])

滴定(titration),在分析化学中是一种分析溶液成分的方法。将标准溶液逐滴加入被分析溶液中,用颜色变化、沉淀或电导率变化等来确定反应的终点。
滴定通过两种溶液的定量反应来确定某种溶质的含量。滴定最基本的公式为:
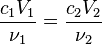
其中c为溶液浓度,V为溶液体积,ν为反应方程序中的系数。
原理
酸碱中和滴定(利用中和反应)
氧化还原滴定(利用氧化还原反应)
沉淀滴定(利用生成沉淀的反应)
络合滴定(利用络合反应)
HIn (酸色形) = H + In(碱色形)
操作
滴定操作需要用到一种专门的仪器:“滴定管”。滴定管很细,因此读数也较精确,最小刻度为0.1mL,读数还要估读一位(0.01mL)。 由于滴定要求极准确,所以滴定管及其下方的锥形瓶都要求清洁,在滴定前(若不确保干净)都要用肥皂水洗一遍,再用自来水、蒸馏水各洗2~3遍。由于滴定管是量具,有浓度要求,所以清洗之后还要润洗滴定管,用待装溶液润洗2~3遍。出于节约,清洗、润洗都秉着少量多次的原则。 酸式滴定管能用于酸性,中性,和强氧化性试剂的量取,但不可以装填碱性试剂;碱式滴定管可以用于碱性,中性溶液的量取,但不可以装填酸性和强氧化性试剂(否则会腐蚀橡胶开关). 滴定之前,先检查滴定管。先将滴定管装满水,竖直放置,检查是否漏液。润洗之后要装上溶液并打开活塞放液,赶尽管下部的空气泡。滴定之前要读一次数,因此放液之后要把液面调至某个整数刻度(通常是0刻度)以便读数。 在锥形瓶被滴溶液中滴入几滴指示剂。按照实验规程,滴定管中的液体要逐滴滴下,每滴一滴都要摇荡锥形瓶。然而在实际操作中,熟练的实验员可以先很快地放液,在接近变色点时放慢速度,改为逐滴滴下,这样节省不少时间。 当指示剂变色时,停止放液,震荡30秒后,若颜色不褪去,读出滴定管读数。前后两个读数相减即为用去溶液体积。 通常进行滴定实验至少要进行两次,取平均值,两次所用标准溶液体积相差不能超过0.02ml,再取平均值,以确保准确。
仪器分析中的滴定
在没有合适的指示剂可用的情况下,通过仪器分析的方法来判定滴定反应的计量点是一种较好的途径。 电位滴定 电位滴定利用溶液电势与滴入滴定剂体积的关系判定反应的计量点。计量点前后,溶液电势发生突跃,通过随时测量滴定剂的体积和溶液电势,即可找出该点。 所用的测量装置包括一个电压计,连接一个参比电极(电势不变)和一个指示电极。指示电极内外离子浓度不同导致电势差(E),这个电势差与待测离子浓度的对数成线性关系。pH计就是依据这个原理制成的。 为了提高测量精度,可以改用对V(滴定剂体积)作图,视“导数”的最高点为滴定终点。也可以用对V作图,视“二阶导数”的**之处为滴定终点。需要说明,由于测量是散点式的,这些量并不是真正的导数。实际应用时,假定每两个测量点之间“导数”的变化是线性的。

 词典释义:
词典释义:
 〕
〕





 的)加印字幕
的)加印字幕

 ;
; 量,剂量,配量,配比;
量,剂量,配量,配比;