La calcination, dans son acceptation moderne du terme, est une opération consistant à chauffer intensément dans une enceinte fermée un corps inerte, afin de le décomposer ou d'obtenir des réactions chimiques.
Étymologiquement, la calcination est la transformation du calcaire en chaux par chauffage dans un four à chaux (réaction de décarbonatation).
Définitions
Fin XVII siècle, on entendait par le mot "calcination", l'action de transformer le carbonate de calcium en chaux vive par chauffage du matériau, opération qui dégage du dioxyde de carbone, mais on l'étendait aussi en général à toute opération qui consistait à traiter par le feu une substance quelconque jusqu à ce qu'elle ait perdu les matières décomposables ou volatiles qu'elle contenait. Les anciens chimistes croyaient en effet que les métaux chauffés au contact de l'air perdaient du phlogistique et redevenaient à l'état de chaux et de là donnaient également à cette opération le nom de calcination. Il sera reconnu plus tard qu'il s'agit de simples oxydations. On donnait donc à la calcination deux objets:
la production de chaux et de plâtre;
la séparation des substances volatiles d'une substance qu'on veut isoler, comme dans la calcination des minerais.
Le résidu se nommait dans les deux cas « chaux ».
De nos jours on étend souvent le sens de la calcination à la chauffe en présence d'air, c'est-à-dire d'oxygène, d'un corps afin de lui faire subir une action chimique : oxydation, réduction, etc.. Cependant, lorsque les réactions chimiques avec l'air deviennent importantes, le terme grillage (en) est plus précis.
LOI
La perte au feu ou LOI (loss on ignition en anglais) est la perte de masse qui résulte de l'échauffement d'un matériau.
Cette perte au feu se constate lorsque l'élaboration d'objets manufacturés nécessite une forte chaleur, par exemple en métallurgie. De fait, le produit final n'a plus la même composition chimique que le produit initial puisque de la matière est partie (ce qui explique la variation de masse).
La calcination est une technique de préparation d'échantillon utilisée en chimie analytique qui permet de prendre en compte ce phénomène. Elle consiste à chauffer l'échantillon à haute température (typiquement 500 à 1 000 °C) sous air ou sous atmosphère neutre pour provoquer des réactions physiques et chimiques et mettre ainsi l'échantillon dans un état de référence.
En effet, un certain nombre de propriétés des matériaux dépendent de la température et de l'historique de l'échantillon comme de l'humidité. La calcination permet de l'abstraire de ces effets et donc d'avoir des mesures reproductibles, de pouvoir comparer différents échantillons. En revanche, il faut être conscient que l'échantillon analysé n'est pas l'échantillon prélevé. La méthode est similaire à l'analyse des extraits secs mais utilise une température plus élevée.
Historique
Au début du XVIII siècle, le chimiste allemand Georg Ernst Stahl attribuait cette perte au feu à un fluide qui sortait du corps lors de la combustion, le phlogistique. Cette théorie ne permettait pas d'interpréter une perte au feu négative, et a été balayée par la découverte de l'oxygène par Priestley : pour rendre compte du bilan de masse dans les combustions, Lavoisier lui substitua alors la théorie du calorique.
Réactions chimiques et physiques
Lors du chauffage, il se produit diverses réactions qui modifient l'échantillon :
à 100 °C : l'eau libre se vaporise ;
au-dessus, l'eau liée se libère (par exemple molécules d'eau liées dans le gypse, l'argile) (voir adsorption et désorption) ;
vers 550 °C : sous air ou atmosphère oxydante, la matière organique brûle donnant du dioxyde de carbone (CO2) ou du graphite (C) ;
le carbone s'oxyde lentement pour former du dioxyde de carbone ou du monoxyde de carbone ;
les carbonates se décomposent, par exemple :
CaCO3 → CaO + CO2
sous air ou atmosphère oxydante, les métaux s'oxydent ;
les sels volatils se vaporisent.
Les conditions de chauffage sont capitales :
chauffage à la flamme : une flamme peut comporter des zones oxydantes et des zones réductrices, selon les conditions de combustion ;
chauffage en four ou par induction : on peut travailler sous air (environnement oxydant) ou sous atmosphère neutre.
Perte au feu
Si de telles réactions prennent place, on peut avoir :
une perte de masse du fait du départ des espèces volatiles : c'est la perte au feu ;
un gain de masse dû à l'incorporation d'atomes d'oxygène (oxydation), on parle alors de « perte au feu négative » ou parfois de « gain au feu » (gain on ignition, GOI).
La perte au feu est donc simplement la différence de masse :
perte au feu = masse avant calcination m0 - masse après calcination m1 on l'exprime parfois en pourcentage : perte au feu (%) = 100 × (m0 - m1) / m0.
Un cas typique est celui de l'analyse des roches. La perte au feu provoque une transformation du calcaire évoquée ci-dessus, mais si l'on n'est pas sous atmosphère neutre, cela provoque aussi l'oxydation de l'oxyde de fer :
-
FeO → Fe3O4 → Fe2O3.
Dans ce cas-là, il faut titrer le fer II sur l'échantillon frais d'une autre manière, par exemple par voie humide, afin d'appliquer une correction exacte.

 词典释义:
词典释义:
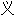 词:
词: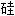 石, 二氧化
石, 二氧化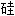 ;
;