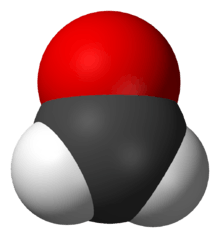
Le méthanal ou formaldéhyde ou aldéhyde formique ou formol est un composé organique de la famille des aldéhydes, de formule chimique CH2O ; il s'agit d'ailleurs du membre le plus simple de cette famille. À température ambiante, c'est un gaz inflammable.
Il fut synthétisé pour la première fois par le Russe Alexandre Boutlerov en 1859, mais fut formellement identifié par l'Allemand August Wilhelm von Hofmann en 1867. Le terme « formol » est généralement réservé à ses solutions aqueuses.
On trouve du méthanal dans les produits d'une combustion incomplète de substances contenant du carbone. Il y en a dans la fumée des feux de forêt, dans les rejets des automobiles, et dans la fumée du tabac. Le méthanal est aussi produit dans l'atmosphère sous l'action des rayons solaires et du dioxygène sur le méthane atmosphérique ainsi que sur d'autres hydrocarbures. De petites quantités de méthanal sont produites par le métabolisme de la plupart des organismes, dont l'organisme humain.
Propriétés
Bien que le méthanal soit un gaz à température ambiante, il est très soluble dans l'eau, dans laquelle il forme une solution appelée formol. Le méthanal polymérise dans l'eau, ce qui fait que le formol contient peu de méthanal sous forme de monomères. Le méthanal polymérise sous forme de polyoxyméthylène (appelé paraformaldéhyde ; succession de groupements -O-CH2-) ou de 1,3,5-trioxane (trimère cyclique). La dépolymérisation est possible par distillation en présence de traces acides. Généralement, le formol vendu dans le commerce contient aussi du méthanol pour limiter la polymérisation du méthanal.
Le méthanal possède la plupart des propriétés chimiques des aldéhydes, mis à part le fait qu'il est plus réactif. De plus, il est remarquablement électrophile, et peut réagir par substitution électrophile aromatique avec les composés aromatiques ou par addition électrophile sur les alcènes. En présence d'un catalyseur basique, le méthanal subit une réaction de Cannizzaro et se transforme en acide formique et en méthanol.
Enfin, le formol (methanal) est facilement oxydé par le dioxygène de l'air pour former de l'acide formique. C'est pourquoi il faut conserver le méthanal dans des récipients bien étanches.
Production
Le méthanal est produit industriellement par l'oxydation catalytique du méthanol. Les catalyseurs les plus employés sont l'argent métallique, ou un mélange d'oxyde de fer, de molybdène et de vanadium. Dans ce cas, le méthanol et le dioxygène réagissent à 400 °C selon l'équation :
CH3OH + ½ O2 → H2CO + H2O.
La catalyse à base d'argent réagit à des températures plus hautes, de l'ordre de 650 °C. Deux réactions produisent alors simultanément du méthanal : l'équation ci-dessus, et l'équation de déshydrogénation ci-dessous :
CH3OH → H2CO + H2.
L'oxydation prolongée du méthanal conduit à la formation d'acide formique, que l'on trouve en faible concentration dans les solutions industrielles de méthanal. À une échelle réduite, le formol peut être produit grâce à diverses réactions comme la conversion de l'éthanol.
Le méthanal peut également être produit lors de l'ozonolyse d'un alcène terminal.
On peut également produire le formaldéhyde en ajoutant de l'hexaméthylènetétramine au milieu réactionnel suivant la réaction :

Production artisanale
Le méthanal est obtenu à partir de la formaline, solution aqueuse dans laquelle le méthanal est dissous à 37 % en masse.
Le méthanal se dégage avec l'ajout de permanganate de potassium (KMnO4) dans les proportions de 1 g de permanganate pour 2 ml de formaline. C'est une réaction exothermique, dont la chaleur générée est importante.
Cette méthode est utilisée par certains aviculteurs pour les fumigations d'œufs.
Utilisation
Le méthanal est utilisé :
comme désinfectant, notamment en médecine vétérinaire (pédiluves de désinfection) ;
comme fixateur et conservateur de cadavres d'animaux ou d'humains (pour les dissections d'écoles de médecine par exemple) ou pour la conservation ou fixation d'échantillons ou de certains prélèvements biologiques, comme dans le cadre d'analyses IBGN, IBMR ou IOBS ;
comme conservateur dans certains vaccins ;
pour assécher ou tuer la peau (pour le traitement médical des verrues par exemple) ;
en dentisterie ; sous forme directe (formaldéhyde) ou dérivée (paraformaldéhyde, polyoxyméthylène) intégrés dans un grand nombre de spécialités destinées à obturer les canaux des dents dévitalisées. Contrairement aux médicaments, les produits et matériaux employés en art dentaire ne sont pas soumis à une autorisation de mise sur le marché, ce qui explique qu'ils échappent à la réglementation évoquée au paragraphe suivant ; l'usage pour les dentifrices est encore autorisé en Union européenne, mais a été interdit aux Etats-Unis au début des années 1980.
pour embaumer les corps, donc par thanatopraxie, par exemple en attente d'un enterrement ;
pour produire des polymères et des produits chimiques (plus de 50 % du total des usages du méthanal) ;
pour coller les tapisseries ;
illégalement, pour la conservation des aliments ;
comme inhibiteur de corrosion dans l'industrie d'extraction du gaz de schiste, où le méthanal est dilué dans un mélange d'eau, à d'autres produits chimiques et de sable, pour l'injection dans les puits d'extraction du gaz de schiste comme liquide d'hydrofracturation.
sous forme de formol pour faire sortir les vers de terre du sol, à de fins de comptage.
pour fabriquer des phénoplastes, en le combinant au phénol, à l'urée ou à la mélamine (fabrication d'aminoplastes). le méthanal forme alors des résines thermodurcissables. Ces résines sont souvent utilisées dans les colles permanentes, comme celles utilisées dans la fabrication d'agglomérés, de contreplaqués, de la laine de verre, de tapis, ou bien pour former des mousses synthétiques.
On emploie aussi le méthanal pour produire de nombreux autres produits chimiques, dont la plupart sont des polyols comme le pentaérythritol, utilisé dans la fabrication de peintures et d'explosifs. On compte aussi d'autres dérivés du méthanal comme le méthylène diphényle diisocyanate, un constituant important des peintures et des mousses de polyuréthane, ainsi que l'hexaméthylènetétramine, utilisée dans les résines phénol-méthanal et pour fabriquer du RDX (un explosif).
Réglementation
Plusieurs pays européens limitent ou interdisent l'utilisation de formaldéhyde (dont en thanatopraxie). L'importation de produits traités au formaldéhyde est alors soumise à réglementation ou interdiction.
Concernant les produits biocides (dont phytopharmaceutiques), sous le nom de formaldéhyde :
pour l’Union européenne : cette substance active est interdite par la décision 2007/442/CE à la suite de l'examen relatif à l'inscription à l’annexe I de la directive 91/414/CEE ;
pour la France : cette substance active n'est pas autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché. Les produits contenant du formaldéhyde ont un délai à la distribution fixé au 30 juin 2008, et un délai à l'utilisation fixé au 20 décembre 2008, par l'avis paru au Journal officiel du 31 octobre 2007.
Perspectives :
l'Union européenne envisage une interdiction complète de l'utilisation du formaldéhyde en tant que biocide (y compris pour l'embaumement) en vertu de la Directive relative aux produits biocides (98/8/CE), mais certains pays où la thanatopraxie s'est développée (Irlande et quelques autres pays froids) ont manifesté des réserves à une telle interdiction. Malgré des rapports allant dans le sens d'une interdiction, aucune décision quant à l'inclusion du formaldéhyde dans l'annexe I de la directive pour les produits biocides du type 22 (fluides d'embaumement et pour la taxidermie) n'avait été prise en septembre 2009.
La France, pour se mettre en conformité avec le droit européen et les recommandations de l'OMS, soumet à consultation en juin 2010 un projet de décret relatif à des valeurs-guides, après avis de l'Agence française de sécurité sanitaire de l'environnement et du travail. Il concerne les gestionnaires de certains établissements recevant du public (enseignement, accueil d'enfants de moins de six ans, établissements sanitaires et sociaux disposant d'une capacité d'hébergement, établissements sportifs couverts) et devrait entrer en vigueur le 1 janvier 2015 puis le 1 janvier 2022. Pour le décret, une valeur-guide pour l'air intérieur est « un niveau de concentration de polluants dans l'air intérieur fixé, pour un espace clos donné, dans le but d'éviter, de prévenir ou de réduire les effets nocifs sur la santé humaine, à atteindre, dans la mesure du possible, dans un délai donné. » La proposition est : 30 μg/m en moyenne hebdomadaire à compter du 1 janvier 2015 ; 10 μg/m en moyenne hebdomadaire à compter du 1 janvier 2022.
30 μg/m en moyenne hebdomadaire à compter du 1 janvier 2015 ;
10 μg/m en moyenne hebdomadaire à compter du 1 janvier 2022.
Recherche, détection et mesures quantitatives
Dans les années 1950, des tests colorimétriques ont été créés par la chimie analytique pour détecter ce produit via la réaction de Hantzsch, puis au moyen de l'alcool méthylique puis via la formation de radicaux, puis (dans les années 1990) par réaction avec l'acétylacétone ou par d'autres méthodes. Depuis diverses méthodes, plus fines ont été développées, dont utilisant le méthanol ou l'éthanol. L'acide chromotropique permet le dosage spectrométrique du formaldéhyde.
Santé
Exposition de l'être humain
Le formaldéhyde est employé dans nombre de matériaux synthétiques ; ceux-ci relâchent au cours du temps des quantités non négligeables de formaldéhyde. C'est un des polluants les plus répandus de l'air intérieur des habitations et lieux fermés de travail. Les enfants y sont notamment exposés. En 2009, une association de médecins, l'Association santé environnement France, s'est intéressée au formaldéhyde en testant des lits bébé vendus en grande distribution. Il a été démontré que tous les lits analysés, et ce quel qu'en soit le prix, émettent du formaldéhyde. En comparant les résultats de l'étude et les valeurs guide de référence édictées par les autorités de contrôle sanitaires françaises, les taux émis par les lits représentent plus d’un quart de la valeur toxique de référence – sans prendre en compte le reste des meubles et peintures polluant l’air de la chambre. Or, les nourrissons sont les plus sensibles à ce type de pollution, et ils restent dans leurs lits en moyenne 20 h par jour, ce qui les rend particulièrement vulnérables à ces produits chimiques.
Métabolisation
Chez les mammifères, le formaldéhyde semble assez rapidement dégradé par l'organisme en s'associant au glutathion (demi-vie du formaldéhyde = une minute pour les analyses de plasma sanguin faites chez le rat. Ce seraient donc surtout ses métabolites (hydroxyméthylglutathion, S-formylglutathion puis formate), qui contribueraient à sa toxicité.
Organes cibles
Les yeux ; avec un caractère irritant du formaldéhyde au-delà de certaines doses ;
Certaines muqueuses (nez, gorge, pharynx) sont les premières touchées lors d'exposition chroniques ou d'exposition temporaires à des taux plus élevés vapeurs de formaldéhyde, selon des études contrôlées d'exposition humaine à court terme de formaldéhyde (à des niveaux de départ de 0,5 à 1 ppm pour les études retenues par l'IARC 1995).
Les poumons sont touchés avec de possibles crises d'asthme, généralement pour une teneur de l'air dépassant 3 ppm chez les individus normaux (c'est-à-dire dans ce contexte « individus non sensibilisés ») selon l'IARC-2005). Dans la plupart des études portant sur la fonction pulmonaire, le formaldéhyde seul ou en combinaison avec d'autres agents (concentration de formaldéhyde : moins de 0,02 à 5 ppm) a provoqué des baisses transitoires, réversibles de la fonction pulmonaire, sans preuve d'effet durable sur la fonction pulmonaire chronique. (IARC 1995)
Peau : Des phénomènes d'allergies et sensibilisation de la peau sont possibles (dermatite de contact allergique). Des Métaplasies squameuses et dysplasies légères ont été observées en cas d'exposition professionnelle.
Toxicologie
Irritant : au-dessus d'une concentration de 0,1 mg/kg dans l'air, il peut irriter les yeux et les muqueuses, causant des conjonctivites, des maux de tête et des difficultés à respirer accompagnées de douleurs dans la gorge.
Reprotoxicité : selon le CIRC (2005), plusieurs études ont évalué directement ou indirectement les effets sur la reproduction de l'exposition professionnelle au formaldéhyde. Les résultats examinés dans ces études ont inclus des avortements spontanés, des malformations congénitales, une chute du poids à la naissance, l'infertilité et l'endométriose. Les données et rapports restent contradictoires concernant le niveau de risque d'avortement spontané et d'abaissement du poids à la naissance rapportés chez les femmes exposées professionnellement au formaldéhyde. Quelques études faites sur l'animal de laboratoire exposé à ce produit via l'inhalation ont porté sur les effets du formaldéhyde sur la grossesse et le développement fœtal, n'ayant pas clairement mis en évidence de tels effets quand l'exposition est inférieure aux doses toxiques pour la mère.
Cancérogénicité : après avoir été d'abord considéré comme « cancérogène probable », le formaldéhyde a été classé comme « cancérogène certain » par le Centre international de recherche sur le cancer (CIRC), qui dépend de l'Organisation mondiale de la santé (OMS). Il est à l'origine de cancers du nasopharynx. Son implication dans les cancers des fosses nasales et des sinus est envisagée mais des biais de confusion présents dans les études en milieu professionnel ne permettent pas de pouvoir conclure. En effet, les travailleurs exposés étaient en général exposés à un grand nombre de polluants potentiellement cancérogènes (poussières de bois dans l'industrie du bois – responsable de cancer des fosses nasales –, benzène – responsable de leucémies –, et d'autres aldéhydes comme l'acétaldéhyde) ; le rôle propre du formaldéhyde dans ces cancers est donc difficilement mis en évidence. Les animaux de laboratoire soumis à d'importantes doses de méthanal durant leur vie voient le risque de cancer du nez et de la gorge augmenter. Des études suggèrent qu'au taux moyen de l'air intérieur des habitations, le formaldéhyde n'a pas d'effet cancérogène ; son potentiel cancérogène (« à seuil »), ne s'exprimerait qu'au-delà de 5 mg·m), concentrations qui ne sont retrouvées qu'en milieu professionnel et rarement dans l'habitat, où les taux moyens sont nettement plus bas (exemple : moyennes françaises proches des 20 μg·m, soit 250 fois moins que les taux déclenchant des cancers chez l'animal de laboratoire). Son implication dans la survenue de cancers du sang (leucémies) est fortement suspectée.
Génotoxicité : le CIRC (2005) estime qu'il existe des preuves de génotoxicité pour plusieurs modèles in vitro ainsi que chez les personnes exposées et les animaux de laboratoire. Les études faites chez des travailleurs exposés au formaldéhyde ont révélé des cassures ou réagencements (cross-link) des protéines d'ADN, ce qui est cohérent avec les observations faites chez les animaux de laboratoire (rats, singes), chez lesquels le formaldéhyde inhalé a causé, de manière reproductible, des perturbations de l'ADN extrait de muqueuses nasales après exposition à inhalation. Il existe une étude rapportant des anomalies cytogénétiques de la moelle osseuse de rats ayant été exposés par inhalation, mais d'autres études n'ont pas signalé cet effet.
En dentisterie, les quantités faibles incorporées aux « pâtes canalaires » causent parfois des réponses allergiques graves (urticaire jusqu'à l'œdème de Quincke survenant dans les heures suivant l'introduction de la pâte dans les canaux dentaires, selon la littérature).
Santé au travail
Le risque d'absorber du formaldéhyde semble plus élevé :
dans la production de colles et de panneaux agglomérés, contreplaqués, de meubles et d’autres produits du bois recomposé ;
dans la fabrication de diverses matières plastiques, certains fertilisants et résines utilisées dans les moules de fonderie en sable, ainsi que de certaines peintures et vernis ;
parfois dans l’industrie du textile qui utilise ces résines comme apprêts pour rendre des tissus infroissables ;
dans les processus de synthèse d'autres produits chimiques ;
via l'utilisation de produits bactéricides en contenant (nombreuses formulations de produits désinfectants, de cosmétiques, de liquides d'embaumement et de solutions de conservation de tissus biologiques).
Voies d'exposition
En milieu de travail, l’exposition au formaldéhyde se produit par différentes voies.
Inhalation : le formaldéhyde gazeux est absorbé par les voies respiratoires. L’exposition professionnelle au formaldéhyde par inhalation provient principalement de trois types de sources :
la décomposition thermique ou chimique des résines à base de formaldéhyde ;
l’évaporation de formaldéhyde à partir de solutions aqueuses (par exemple, les liquides d’embaumement) ;
la formation de formaldéhyde résultant de la combustion d’une variété de composés organiques (par exemple, via les gaz d'échappement).
Passage percutané et contact avec la peau.
Ce risque est le plus élevé pour des métiers utilisant ou produisant des solutions aqueuses de formaldéhyde. Il cause des irritations, des dermites de contact (irritatives et allergiques).
Les symptômes sont des démangeaisons, des picotements et des rougeurs. Une sensibilisation cutanée est susceptible d’apparaître après un contact avec des solutions aqueuses de formaldéhyde de concentration égale ou supérieure à 2 %.
Un contact fréquent avec des solides contenant du formaldéhyde libre ou avec des résines (surtout si elles sont mal polymérisées) peut entraîner une sensibilisation allergique. Ces effets sont a priori facilement évitables en protégeant les régions de la peau exposées, par exemple, en portant des gants et tenues appropriées.
Les effets sanitaires d'une exposition à cette substance varient selon la voie d’exposition et la concentration ou dose absorbée, et probablement selon l'âge du patient.
Lorsqu’une personne est sensibilisée, les manifestations de l’allergie cutanée (érythème) risquent de se produire à chaque contact avec des solutions de concentrations de plus en plus faibles (à partir de 0,5 % de formaldéhyde).
En situation d'accident, du formaldéhyde peut être présent dans l’air en fortes concentrations. Il constitue alors un danger immédiat considérable.
Des concentrations égales ou supérieures à 20 ppm peuvent induire des œdèmes pulmonaires graves et éventuellement causer la mort.
Par contact important et direct avec la peau, le formaldéhyde peut entraîner des lésions.
Alimentation
Le formaldéhyde peut être présent à faible dose dans l'alimentation humaine : il apparaît naturellement dans certains aliments, tels que des fruits et des légumes, à des concentrations pouvant varier de 3 à 60 mg/kg. Répertorié comme additif (conservateur) sous le code E240, il est désormais interdit en tant que tel dans l'Union européenne.
Prévention, traitement de l'air intérieur
Une ventilation suffisante et un renouvellement de l'air intérieur sont recommandés surtout dans les logements neufs ou contenant des planchers, murs, plafonds ou meubles contenant de l'aggloméré, des moquettes ou dalles synthétiques collées.
Certaines plantes (chlorophytum par exemple) se sont montrées en laboratoire, dans le cadre du programme Phyt'air par exemple, capables de dégrader de façon modérée certains aldéhydes. Mais avec des rendements qui ne permettent pas d'apurer l'air d'un logement de façon significative. L'ADEME considère que l'argument « plantes dépolluantes » n'est pas validé scientifiquement au regard des niveaux de pollution généralement rencontrés dans les habitations et des nouvelles connaissances scientifiques dans le domaine.
On commence à trouver sur le marché des colles, agglomérés et meubles ou planchers garantis sans formaldéhyde.
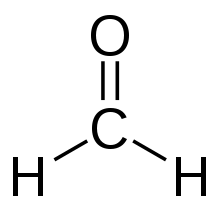
甲醛(英语:Formaldehyde),化学式HCHO,质量30.03,又称蚁醛,天然存在的有机化合物。有特殊刺激气味的无色气体,对人眼、鼻等有刺激作用。体积百分比40%的甲醛水溶液称100%福马林(Formalin)。气体相对密度1.067(空气=1),液体密度0.815g/cm³(-20℃)。它主要用于生产工业树脂,例如刨花板和涂料。1996年估计甲醛的每年生产量为870万吨。
2011年美国国家毒理学计划描述甲醛为“已知人类致癌物”。
物理性质
纯甲醛为无色透明气体,具有强烈刺激性
沸点 -19.5°C
闪点85°C
自燃点430°C
密度0.815 g/mL(液体,-20°C),1.075-1.085 g/mL(液体,37%)
极易溶于水,易溶于醇、醚、丙酮,苯等溶液。其40%的水溶液通称福尔马林;水溶液中主要以偕二醇的形式存在;一般甲醛溶液中还含有少量稳定剂和甲醇以防止氧化和聚合。
甲醛的多种形式
与许多简单的碳化合物比甲醛更为复杂,在于它有几种不同形式。作为气体甲醛具有特殊的刺激性气味,无色的气体。冷凝时气体转换为各种其它形式的甲醛(具有不同的化学式),更有实用价值。一个重要的衍生物是甲醛环状三聚物或1,3,5-三恶烷,它是一种有氯仿样气味的白色固体,化学式(CH2O)3。还有一种直链聚合物所谓的多聚甲醛。这些化合物具有相似的化学性质,并且通常可以互换。 当甲醛溶解在水中也形成水合物水甲醛(Methanediol),化学式H2C(OH)2。一个饱和水溶液约含40%(体积)或37%(质量)的甲醛,被称为「100%福尔林」。通常添加少量的稳定剂如甲醇,以抑制氧化和聚合,一个典型的商业级福尔马林含10-12%的甲醇。
自然界中产生甲醛
在高层大气过程中贡献环境中总甲醛的90%。甲醛是在甲烷以及其它碳化合物氧化(或燃烧)的中间体,例如在森林火灾,汽车尾气和烟草烟雾。通过阳光和氧气的大气作用,在大气中产生的甲烷和其他碳氢化合物,成为烟雾的一部分。甲醛也已在外层空间检测到。 在活生物体中甲醛和它的加合物无处不在。它是由内源性氨基酸代谢形成的,并且在人类和其他灵长类动物的血液中以约0.1毫摩尔浓度存在。 因为它由阳光或由存在于土壤或水中的细菌在几个小时内被分解,所以甲醛不会在环境中积累。人类快速代谢甲醛,在体内将其转换为甲酸,因此不会蓄积在体内。
制取
历史 甲醛最早是在1859年由俄罗斯化学家亚历山大布特列罗夫(1828年至1886年)提出报告,奥古斯特·威廉·冯·霍夫曼在1869年得出结论鉴定。 工业制造 1953年瑞典FORMOX公司甲醛工艺技术及催化剂Formox过程中(Formox process)。 由甲醇经高温250-400°C催化氧化制取,催化剂为金属银或铁+钼/钒氧化物混合物。发生的反应有以下两个: 银基催化剂通常工作在较高的温度下(约650℃)。这两个脱氢化学反应均产生甲醛。 原则上可通过甲烷的氧化来产生的甲醛,但是这条路线是不适于工业生产,因为甲醇比甲烷更容易氧化。
化学性质
甲醛的还原性很强,很容易被氧气等试剂氧化为甲酸,普通的甲醛中就含有ppm含量的甲酸。也可以被还原为甲醇。自身聚合生成三聚甲醛和多聚甲醛。 甲醛有亲电性,可以和芳烃发生亲电芳香取代反应,也可以与烯烃发生亲电加成。与乙醛发生交叉Cannizzaro反应生成季戊四醇,后者是制取炸药季戊四醇四硝酸酯的原料。与酚类以醋酸钠作为催化剂缩合生成酚醛树脂。与4-取代酚类反应生成杯芳烃。与硫化氢反应生成三噻烷: 甲醛也是曼尼希反应中常用的醛。空气中的甲醛气体可以通过强氧化性的高锰酸钾和其反应。
用途
工业应用 甲醛是一种更复杂化合物和材料的常见前体。由甲醛生成的产品包括脲甲醛树脂,三聚氰胺树脂,酚醛树脂,聚甲醛塑料,1,4-丁二醇,和亚甲基二苯基氰酸酯。纺织工业用甲醛的树脂作为整烫使布料防皱。甲醛是汽车制造的关键材料,用于制造传输系统,电气系统,发动机缸体,门板,车轴和制动蹄片组件。2003年销售的甲醛和衍生产品的价值超过$1,450亿。是美国和加拿大国内生产总值(GDP)的约1.2%,包括间接就业超过4万人在约11,900工厂的甲醛行业工作。 当用苯酚,脲或三聚氰胺处理,甲醛会产生硬的热固性塑料酚甲醛树脂,脲醛树脂和三聚氰胺树脂。这些聚合物是胶合板和地毯常见的永久粘合剂。它也用于湿强度树脂,加到卫生纸制品如搽面纸,餐巾纸,和卷毛巾。它们还可发泡作出绝缘性,或铸造成模制品。甲醛树脂的产量占甲醛消费量的一半以上。 甲醛也是多官能醇如季戊四醇的前体,这是用于制造油漆和炸药。其他甲醛衍生物包括二苯基甲烷二异氰酸酯,在聚氨酯涂料和泡沫剂的一个重要组成部分,和乙基六胺,这是使用在苯酚–甲醛树脂以及黑索今炸药。 消毒和杀菌灭藻 因为它可以杀死大多数细菌和真菌(包括其孢子)甲醛的水溶液可以作为消毒剂使用。甲醛溶液用于局部施用药物以使皮肤干燥,例如治疗疣。许多水族养殖爱好者使用甲醛处理寄生虫淡水性白点虫病和海水白点虫。 甲醛于产制类毒素疫苗时用于灭活该细菌。它也于疫苗生产过程中用来杀死不需要的病毒和细菌以免污染疫苗。尿路感染也常使用甲醛的衍生物(乌洛托品)来治疗,它可以防止滥用抗生素和产生耐药性细菌。在酸性环境中乌洛托品在肾脏转化为甲醛,然后在尿道中行成抗菌作用。一些外用药膏化妆品和个人卫生产品中含有甲醛的衍生物作为防止潜在有害细菌的生长。 组织标本固定液及防腐剂 用福尔马林注射,保存一个巨型乌贼标本。 甲醛保存或固定组织或细胞。经由的蛋白质伯氨基NH2-与CH2-连接。在室温下以每小时约一毫米,4%甲醛的溶液固定病理组织标本。甲醛型溶液也可用于防腐消毒和暂时保存人类和动物的遗骸。 福马林(Formalin),是甲醛含量为35%至40%(一般是37%)的水溶液,也加入10%~15%的甲醇防止聚合。具有防腐、固定尸体、消毒和漂白的功能,不同领域各有其作用,具有刺鼻的气味。
危险性
甲醛是最常见的室内空气污染毒物,约有三千多种不同建筑材料均含有甲醛,主要来源为纤维板、三夹板、隔音板、保丽龙等装潢材料。目前甲醛已被世界卫生组织确定为致癌和致畸型物质,室内浓度达0.5 mg/m会使人体产生流泪及眼睛异常敏感的症状。长期接触低剂量甲醛可引起慢性呼吸道疾病,引起鼻咽癌、结肠癌、脑瘤、细胞核基因突变等。 甲醛对皮肤及黏膜有刺激性作用,比如咽喉和眼睛鼻腔等,造成这些位置水肿,发炎、溃烂,甚至最后导致鼻咽癌等严重病变。接触过甲醛的皮肤可能出现过敏现象,严重者甚至会导致肝炎、肺炎及肾脏损害。 对婴幼儿的孕妇危害更加严重,可导致怀孕期间胎儿停止生长发育,心脑发育不全,严重可导致胎儿畸形和流产等严重后果。孕期甲醛暴露可能会增加自然流产的发生风险。 因为甲醛树脂被用于各种建筑材料,包括胶合板、毛毯、隔热材料、木制产品、地板、烟草、装修和装饰材料,且因为甲醛树脂会缓慢持续放出甲醛,因此甲醛成为常见的室内空气污染之一。甲醛一般会从源头慢慢发布,新制产品在最初数月内所发布的甲醛量最高,一段时间后,发布的甲醛量便会渐渐降低。 甲醛若在空气中的浓度超过0.1 mg/m,会导致眼睛和黏膜细胞的伤害。在体内,甲醛可能导致蛋白质不可逆的与DNA键结。动物实验显示暴露在大剂量的甲醛中会使得鼻子与喉咙致癌的机率增加。然而在大部份的建筑内甲醛含量浓度不足以产生致癌性。美国国家环境保护局将甲醛分类为可能致癌物质,国际癌症研究机构(IARC)则将其分类为人类致癌物质。 2009年3月,美国安全化妆品运动组织的一份报告中指出,强生等公司的婴儿产品含有致癌物质甲醛和二恶烷。(见1,4-二恶烷#强生。) 2010年7月31日,中华人民共和国中华全国工商业联合会家具装饰业商会举办了“对甲醛零容忍”新闻发布会,作为对中华人民共和国国家安监总局检测事件的回应。中华人民共和国国家安监总局对全国85家木质家具制造企业的检测结果显示70%以上的家具企业生产环境有毒物质浓度超标,严重影响工人的健康。发布会代表家具制造行业发表“对甲醛零容忍”宣言。
空气中甲醛浓度标准
为改善室内空气质素及加强公众对这方面的关注,香港政府于2003年实施自愿性的「室内空气质素管理计划」。这计划采用两个级别的室内空气质素指标(「卓越级」及「良好级」),作为评估楼宇室内空气质素的基准。经参考多份文献,包括世界卫生组织2000年发出的"Guidelines for Air Quality",得出「卓越级」甲醛含量为每立方米少于30微克(30μg/m³,亦等同24ppbv或0.024ppm)而「良好级」指标则要求甲醛含量每立方米少于100微克(100μg/m³,亦等同81ppbv或0.081ppm)。
检测方法
高效液相色谱仪(High Pressure/Performance Liquid Chromatography,HPLC)可应用于主动及被动采样的空气样本。主动采样可依美国环保局TO-11A方法进行分析;
比色法采用基于美国试验与材料协会(ASTM)方法D5014-94进行分析,通常使用在被动采样空气样本;
气相色谱仪Gas Chromatograph(GC)比较准确,但由于仪器体积庞大,未能够于测试现场使用
光离子化检测仪Photo Ionization Detectors(简称PID)是一种气态检测仪,可以实时量度空气中甲醛水平。这方法的线性范围覆盖至1000ppm,检出限为0.05ppm
去除方法(家居环境)
强力通风 强力通风可以有效降低甲醛浓度,但只有在室外温湿度、空气品质及噪音可以接受的情况下才能运行,不一定能让甲醛降至安全量,而且一旦停止通风甲醛浓度就会开始增加。 光等离子 空气中的O2分子和H2O分子经过特殊波长的奈米光管照射,分解成具有高氧化性光等离子的等离子气流,这些带有大量电子键的光等离子等离子气流具有破坏有机分子的能力,能够迅速中和空气中的挥发性甲醛、甲苯、VOC等气体分子,使之分解成为水和二氧化碳,该技术本身不会产生任何其他有害物质。由于中和甲醛分子而形成的水分子可以继续经过奈米光管再次作用,通过这样的链式反应将污染物彻底分解。 负离子法 纯水添加电解质导通电流,将水分子电解解离。直流电极之(-)极,析出氢气;(+)极则析出氧气。经电解质后.PH值越高的碱性电解水,水中解离的氢离子和氢氧根离子浓度乘积越高,也能够迅速中和空气中的挥发性甲醛、甲苯、VOC等气体分子发生反应,使之分解成为水和二氧化碳,该技术不会产生任何其他有害物质。 据研究和使用证明:负离子可以有效清除室内甲醛等有害气体,净化室内空气。中科院经实验证实:小粒径负离子清除甲醛的有效率达73.33%以上,长期使用达99%[5]。 光触媒 光触媒原料多位二氧化钛,是牙膏的重要成分,经加工后可于光照下产生催化作用。 把建材或含甲醛的基材表面涂喷光触媒,光触媒经紫外线照射后表面的氢氧离子会被电洞氧化成"氢氧自由基",而氢氧自由基会从其他的有机物(甲醛及各种挥发性有机物)抢走电子,而被抢走电子的有机物会因为失去键结能力而降解成为更小的分子,如二氧化碳、水。相对甲醛去除剂,这样的分解不会产生后续的有害有机化合物,所以可以避免二次污染。 光触媒对于无法经常被很强的光照射处(如橱柜内部),几乎没有效果。晚上关灯睡觉时,甲醛量可能会上升。尤幸基于室内空间容积比板材体积大得多,而甲醛释放速度普遍不会太快,所以除极端情况外,关灯睡觉的8小时中,室内甲醛浓度通常会维持于安全水平。现今光触媒已可应用实内人做光源,不再依赖太阳紫外线,所以这问题已不再影响日常使用。 甲醛清除剂 为应对政府对甲醛污染的管制,市面上有厂商贩售甲醛捕捉剂及类似产品。它们大部分是应用含有氨(胺)基之化合物;结构为R-NH2。氨(胺)基化合物和甲醛作用时的化学反应: H2CO(甲醛)+ R-NH2(氨(胺)基化合物)→ H2C=N-R + H2O 氨(胺)基之化合物虽多带有些微的氨味,但对于甲醛的清除效率高,故在市面上广泛流通售卖。但是随着化学反应的耗损,必须长期重添。另外其复合而成的化合物亦可能有毒。 活性碳 室内放置活性碳包可以吸附甲醛,碳表面的极多小孔构造可以锁住甲醛分子,但是除此之外别无其他机制,所以吸附满后就不再有用需要频繁换包,甚至已经吸附的甲醛还会在气温上升时又被释放出来。将碳包在太阳户外下曝晒可以放走它锁住的气体重新使用,然而这种回收使用顶多两三次就会无效,所以频繁换包是唯一方法。好处是抽屉中或深处房间等紫外线较少,光触媒失效的地方可以使用。 臭氧 有效浓度的臭氧亦有毒,但是臭氧可以在短时间内分解,在确定有一段时间没有人畜存在、人畜进入前一段时间可以关闭的情况下,可以开启臭氧产生器,减少甲醛累积量。 室内盆栽 关于室内植物降低甲醛相关数据,请参考"净化室内空气之植物应用及管理手册 - 行政院环境保护署"一文。并非所有植物都具备有效降低室内VOCs(挥发性有机化合物)的能力,可参考上述数据挑选。但若考量养殖容易度及综合降低室内VOCs能力,白鹤芋无疑为优先考量之一。 跟据Wolverton于1993年撰写的研究报告,一棵46厘米高的白鹤芋于强光照射下可每小时降解939微克甲醛。假设每日光照12小时,一棵46厘米高的白鹤芋可降解11268微克(11毫克)甲醛。 香港浸会大学于2010年发表的报告,发现植物降解甲醛效率其实并不高,每平方米叶面每小时净化甲醛效率只是0.1毫克。如果要达到1993年文献所指的结果,该棵植物叶面总面积要达10平方米。这意味,之前的研究可能高估了植物降解甲醛效率。 如果是实用面积80平米,层高3米的居室内,甲醛浓度为每立方米0.5毫克。室内空气即总共有120毫克甲醛。要降到安全标准(0.1毫克/立方米)就需要至少清除96毫克甲醛。即使还不考虑从装饰材料里新挥发出来的甲醛,如依赖一棵中形植物(叶面总面积为0.3平方米)也要工作240天。或者如果要在1星期内清除好,就需要34棵,相信并非可行方案。
去除甲醛方法的谬误
坊间有很多关于去除甲醛方法的存有有颇大谬误。例如以菠萝、洋葱、茶叶等放于室内环境,声称可吸附甚至分解甲醛。这些方法最后都被证实为无稽之法。即使没有嗅到气味,甲醛并未消失,只是被那些香味所掩盖。这样,反而会令市民放下戒心,忽视通风的重要性,令室内空气的甲醛含量更加高。

 词典释义:
词典释义:


 剂,
剂,
 ;
; ;
; 烷;
烷;
