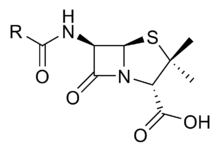
Gélules d'amoxicilline, l'un des antibiotiques les plus prescrits au monde, appartenant à la famille des bêta-lactamines
Un antibiotique (du grec anti : « contre », et bios : « la vie ») est une substance naturelle ou synthétique qui détruit ou bloque la croissance des bactéries. Dans le premier cas, on parle d'antibiotique bactéricide et dans le second cas d'antibiotique bactériostatique. Un même antibiotique peut être bactériostatique à faible dose et bactéricide à dose plus élevée.
Un grand nombre des antibiotiques existants sont constitués de molécules naturelles, fabriquées par des micro-organismes : des champignons ou d'autres bactéries. Ces dernières les produisent pour éliminer les bactéries concurrentes avec lesquelles ils sont en compétition dans leur biotope. Cependant, seul un petit nombre des antibiotiques naturels est utilisable en thérapeutique humaine, pour des raisons de disponibilité dans l'organisme ou d'effets indésirables. Un grand nombre de molécules aujourd'hui sur le marché sont des molécules de synthèse, dérivées ou non d'antibiotiques naturels, en particulier pour contourner les problèmes de résistance.
Les antibiotiques agissent de manière spécifique sur les bactéries, en bloquant une étape essentielle de leur développement : synthèse de leur paroi, de l'ADN, des protéines, ou la production d'énergie, etc. Ce blocage se produit lorsque l'antibiotique se fixe sur sa cible, une molécule de la bactérie qui participe à l'un de ces processus métaboliques essentiels. Cette interaction entre l'antibiotique et sa cible est très sélective, spécifique des bactéries et ces composés ne sont en général pas actifs ni sur les champignons ni sur les virus. Il existe aussi d'autres molécules actives sur ces autres types d'agents infectieux que l'on appelle des antifongiques ou des antiviraux et qui sont distincts des antibiotiques.
L'introduction généralisée des antibiotiques après la Seconde Guerre mondiale a été l'un des progrès thérapeutiques les plus importants du XX siècle. Les traitements antibiotiques ont fait progresser l'espérance de vie de plus de dix ans, soit plus qu'aucun autre traitement médical. Cependant, l'usage généralisé, voire abusif de certains antibiotiques, y compris en traitement préventif, curatif ou en complément alimentaire dans l'alimentation animale, dans les piscicultures, en médecine vétérinaire et humaine, ou encore comme pesticides pour le traitement des végétaux (contre le feu bactérien par exemple) a introduit une pression de sélection qui a conduit au développement de populations de micro-organismes antibiorésistants et à une baisse générale de l'efficacité thérapeutique. En milieu hospitalier, ceci conduit à une augmentation du risque nosocomial, faute de traitement adapté contre certains germes particulièrement résistants.
Généralités
Définition
De manière simplifiée un antibiotique est, dans le domaine médical, « une substance chimique organique d’origine naturelle ou synthétique inhibant ou tuant les bactéries pathogènes à faible concentration et possédant une toxicité sélective ». Par toxicité sélective, on entend que celle-ci est spécifique des bactéries et que la molécule antibiotique n'affecte pas l'hôte infecté, au moins aux doses utilisées pour le traitement.
Plus généralement, pour les microbiologistes et les chimistes, un antibiotique est une substance anti-bactérienne.
Il a existé des variantes dans cette définition qui différent par la présence ou non des concepts de toxicité sélective, d’origine microbienne et de limitation de cible aux seules bactéries.
Les antiseptiques ne sont pas des antibiotiques. Leur fonction est de tuer un maximum de germes (bactéries, champignons, virus), leur mode d'action n'est pas spécifique, ils ne s'utilisent que localement en application externe et mal employés (trop concentrés par exemple) ils peuvent provoquer des lésions et/ou retarder la cicatrisation.
Les antibiotiques ne sont généralement pas actifs contre les virus. Un produit luttant contre les virus est un antiviral. Toutefois, des études en cours tendent à démontrer une certaine efficacité de quelques antibiotiques dans des cas particuliers comme l'effet de la teicoplanine sur le virus Ebola.
Découverte
Alexander Fleming, découvreur de la pénicilline en 1928
Le premier antibiotique identifié fut la pénicilline. Si dès la fin du XIX siècle Ernest Duchesne découvrit les propriétés curatives de Penicillium glaucum, la découverte de la pénicilline est à mettre au crédit de Sir Alexander Fleming qui s’aperçut en 1928 que certaines de ses cultures bactériennes dans des boîtes oubliées avaient été contaminées par les expériences de son voisin de paillasse étudiant le champignon Penicillium notatum et que celui-ci inhibait leur reproduction. Mais l’importance de cette découverte, ses implications et ses utilisations médicales ne furent comprises et élaborées qu’après sa redécouverte, entre les deux grandes guerres notamment à la suite des travaux de Howard Walter Florey, Ernst Chain, et Norman Heatley (en) en 1939.
structure de la pénicilline
En 1932, Gerhard Domagk met au point chez Bayer AG le Prontosil, un sulfamidé, le premier antibiotique de synthèse. C’est toutefois la découverte subséquente, à l'Institut Pasteur, dans le laboratoire de chimie thérapeutique dirigé par Ernest Fourneau, des propriétés antibiotiques du sulfanilamide, agent actif du Prontosil, (découverte publiée en 1935 par Jacques et Thérèse Tréfouel, Federico Nitti et Daniel Bovet) qui ouvrira effectivement la voie à la sulfamidothérapie. Ce premier antibiotique de synthèse a ouvert une voie nouvelle dans la lutte contre de nombreuses maladies qui étaient considérées comme incurables auparavant.
René Dubos isole en 1939 la tyrothricine (un mélange de tyrocidine et de gramicidine) à partir du Bacillus brevis dont il avait observé l’action antibactérienne. L’importance de cette découverte ne fut pas tant d’ordre thérapeutique que théorique : si la gramicidine fut effectivement le premier antibiotique commercialisé, son utilisation fut limitée à une application locale — en topique — ; toxique en intraveineuse, la gramicidine s’avéra en revanche très efficace pendant le second conflit mondial pour guérir les blessures et les ulcères. Comme Howard Florey lui-même devait le rappeler plus tard, la découverte de la gramicidine fut une étape déterminante en cela qu’elle encouragea les recherches autour des applications thérapeutiques de la pénicilline qui avaient souffert jusque là de plusieurs déconvenues.
En 1944, Selman A. Waksman, Albert Schatz et E. Bugie découvrent la streptomycine, le premier antibiotique ayant un effet sur le bacille de Koch, rendant ainsi possible le traitement de la tuberculose. En 1952, commercialisation sous la marque Ilosone de l’érythromycine, premier macrolide connu, nouvellement isolée par J. M. McGuire, de la firme Eli Lilly. En 1956 est découverte la vancomycine. Suivent alors le développement des quinolones à partir de 1962 et leurs dérivés, les fluoroquinolones dans les années 1980.
Après les années 1970, la recherche sur les antibiotiques se ralentit fortement, l'arsenal thérapeutique de l'époque permettant alors de traiter efficacement la plupart des infections bactériennes. L'émergence des résistances de plus en plus nombreuses va modifier ce tableau et stimuler la reprise des travaux. En 2000, le linezolide (approuvée par la FDA le 18 avril 2000) est mise sur le marché américain. Le linezolide correspond à une nouvelle classe de composés, les oxazolidinones. C'est la première fois en 20 ans qu'une nouvelle classe de composés antibiotiques est introduite dans la pharmacopée.
Globalement, en un demi-siècle, les antibiotiques ont augmenté l’espérance de vie de ceux qui y ont accès de plus de dix ans, soit plus qu'aucun autre traitement. Comparativement, un médicament qui guérirait 100 % des cancers n’augmenterait l’espérance de vie que de cinq ans .
Les antibiotiques ont en particulier fourni des traitements efficaces pour la plupart des grandes maladies infectieuses bactériennes. Combinés à la vaccination ils ont contribué à faire largement disparaître les grandes maladies épidémiques, au moins dans les pays développés : tuberculose, peste, lèpre, typhus, fièvre typhoïde... Ils sont également utilisés dans les cas de choléra en complément de la réhydratation des malades.
Le mode d’action des antibiotiques
Il existe plus de 10 000 molécules antibiotiques connues (voir liste d'antibiotiques), la plupart d'entre elles sont des produits naturels, synthétisés par des procaryotes, des champignons, des végétaux supérieurs, des animaux ou des lichens.
Le principe d'action des antibiotiques consiste à bloquer sélectivement une étape d'un mécanisme essentiel à la survie ou à la multiplication des micro-organismes. Le mécanisme ciblé par l'antibiotique est le plus souvent spécifique des bactéries et n'a pas d'équivalent chez les eucaryotes et en particulier chez l'Homme. Ainsi, idéalement, l'antibiotique tue ou bloque la multiplication des bactéries mais n'a pas d'impact sur les cellules du patient traité. Il existe ainsi quelques grandes familles de mécanisme d'action pour les antibiotiques, ce qui permet de les regrouper en grandes classes décrites ci-après.
Inhibition de la synthèse de la paroi bactérienne
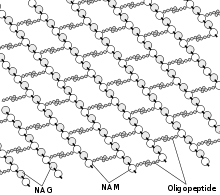
structure du peptidoglycane présent dans la paroi des bactéries et qui contribue à sa solidité mécanique. Les antibiotiques de la famille des bêta-lactames comme la pénicilline bloquent la synthèse de ce polymère et fragilisent la cellule
Certaines bactéries sont protégées de l'environnement extérieur par une paroi, qui doit croitre quand la bactérie se divise. Cette paroi contient en particulier une couche de peptidoglycane plus ou moins épaisse, un polymère spécifique comportant des acides aminés et des sucres. Il existe une machinerie de synthèse qui fabrique les composants de cette paroi et qui est composée d'enzymes et de systèmes de transport acheminant les composants à la surface cellulaire.
Il existe un ensemble d'antibiotiques qui bloquent différentes étapes de cette machinerie. Le blocage de la synthèse de la paroi fragilise fortement l'enveloppe externe des bactéries, qui deviennent très sensibles à des stress extérieurs (pression osmotique, température, stress mécanique) provoquant la lyse cellulaire. In vitro, on peut maintenir ces cellules sans paroi avec un stabilisant osmotique, on obtient alors un protoplaste.
Ces antibiotiques agissent sur des cibles extracellulaires. Ils n'ont donc pas besoin de pénétrer dans la cellule, ce qui les rend insensible aux mécanismes de résistance liés à la perméabilité ou à l'efflux (voir plus bas). En revanche, ils ne sont en général actifs que sur les germes en croissance. Les bactéries quiescentes (qui ne se divisent pas) ne sont pas perturbées par l’action de ces molécules, parce que le peptidoglycane n'est produit que lors de la croissance cellulaire, pour s'adapter à l'augmentation du volume précédant la division cellulaire.
Les principaux antibiotiques ayant ce mode d'action correspondant à la famille appelée les béta-lactames (pénicillines et céphalosporines). Ceux-ci qui agissent sur les enzymes de la machinerie de synthèse du peptidoglycane, que l'on appelle pour cette raison les « protéines fixant la pénicilline » (penicillin binding proteins" ou PBP).
La catégorie des antibiotiques inhibant la synthèse de la paroi bactérienne comprend entre autres :
la bacitracine
les pénicillines: amoxicilline
les céphalosporines
les glycopeptides comme la vancomycine
Action sur la membrane des cellules
L'existence d'une membrane plasmique intacte est nécessaire à la survie bactérienne. Son rôle est double, d'une part elle permet de séquestrer métabolites et ions nécessaires à l'intérieur du cytoplasme, d'autre part, elle permet de maintenir un gradient de protons entre l'intérieur et l'extérieur de la cellule, généré par la chaîne respiratoire et le cycle de Krebs et qui permet le stockage de l'énergie cellulaire. Ce gradient de protons alimente l'ATP synthase qui fabrique l'ATP. Toute perturbation de l'imperméabilité de la membrane rompt ces confinements, l'énergie chimiosmotique est dissipée et le contenu du cytoplasme fuit dans le milieu extracellulaire. Il existe un certain nombre de molécules antibiotiques qui agissent sur la membrane des cellules, soit en agissant comme des détergents qui désorganisent les lipides, soit en formant un pore (un trou) dans la membrane qui va permettre la fuite des composés cellulaires.
Parmi ces composés attaquant la membrane des cellules bactériennes, on trouve :
la polymyxine qui est un surfactant (détergent) interagissant avec les lipides membranaires et qui désorganise la bicouche phospholipidique membranaire. Ceci détruit l’intégrité de la membrane, les éléments hydrosolubles sortent de la cellule. Cette molécule est efficace sur les cellules en croissance et au repos ;
la gramicidine, un peptide qui s'insère dans la membrane en formant un pore cylindrique permettant la fuite des cations.
Inhibition de la synthèse des acides nucléiques
Structure de l'ADN gyrase complexée à l'ADN et à la ciprofloxacine (vert), un antibiotique de la famille des quinolones
La synthèse des acides nucléiques, ADN et ARN est absolument vitale pour les cellules, sans elle, la division cellulaire et la fabrication des protéines est impossible. Un certain nombre de composés peuvent bloquer de manière directe ou indirecte ces voies de biosynthèse des acides nucléiques et ont en conséquence une activité antibiotique.
Chez les bactéries, le ou les chromosomes sont souvent circulaires et se trouvent dans un état topologique particulier caractérisé par un surenroulement négatif. Ce surenroulement négatif est essentiel à la réplication de l'ADN (et aussi à la transcription de l'ARN) et constitue une caractéristique de l'ADN bactérien. C'est l'ADN gyrase qui introduit ce surenroulement négatif dans l'ADN. Cette enzyme, de la famille des topoisomérases est essentielle à la survie des bactéries, mais n'a pas d'équivalent chez les eucaryotes. Il existe des antibiotiques qui bloquent l'action de l'ADN gyrase, il s'agit des aminocoumarines et des quinolones. Plus récemment, ces dernières ont été supplantées par les fluoroquinolones, molécules de synthèse permettant de contourner les mécanismes de résistance aux quinolones.
D'autres molécules bloquent la réplication de l'ADN en introduisant des pontages covalents entre des bases voisines, soit sur le même brin soit entre les deux brins de l'ADN. Ces pontages déforment l'ADN, peuvent empêcher l'ouverture des brins et bloquent l'action de différentes enzymes agissant sur l'ADN. Ceci a en particulier pour conséquence d'empêcher la progression de la fourche de réplication et du réplisome et rendent donc la réplication impossible.
Ces molécules, comme la mitomycine ou l'actinomycine, si elles ont bien une activité antibiotique sur les bactéries, ne sont pas utilisées comme telles chez l'homme car elles ne sont pas sélectives et agissent aussi sur l'ADN des cellules eucaryotes. Leur capacité à ponter également notre ADN bloque aussi la réplication de nos propres cellules, ce qui leur confère en plus des propriétés antimitotiques chez l'homme. Pour cette raison, on les a utilisées en chimiothérapie anticancéreuse.
Il existe enfin des inhibiteurs spécifiques de l'ARN polymérase bactérienne qui bloquent la transcription des gènes et la synthèse des ARN messagers. Parmi ces antibiotiques, on trouve en particulier la rifampicine qui est aujourd'hui utilisée en association à d'autres antibiotiques pour le traitement de la tuberculose.
Inhibition de la synthèse protéique
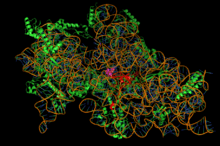
Structure de la petite sous-unité du ribosome bactérien complexée avec la streptomycine (sphères mauves, au centre).
La synthèse des protéines est un processus essentiel des cellules vivantes. L'acteur central de ce processus dans lequel l'ARN messager est traduit en protéine est le ribosome, l'organite cellulaire qui est responsable de cette étape. Les détails du mécanisme de traduction et les ribosomes des bactéries sont sensiblement différents de ceux des eucaryotes. Il existe un grand nombre de molécules antibiotiques qui exploitent ces différences et sont capables de bloquer sélectivement la traduction des protéines chez les bactéries, mais pas chez l'homme ou l'animal.
De fait, approximativement la moitié des antibiotiques utilisés en thérapeutique (disposant de l'AMM) ont pour cible le ribosome bactérien. Ces antibiotiques se répartissent en plusieurs classes, de nature chimique et de mode d'action différents. La plupart interagissent avec l'ARN ribosomique. Enfin, certains antibiotiques bloquent la traduction en inhibant l'action des facteurs de traduction associés au ribosome.
Les aminoglycosides ou aminosides (exemples : streptomycine, gentamicine, amikacine) se fixent sur la petite sous-unité des ribosomes (30 Svedberg) au niveau du site du décodage des codons, empêchent la traduction de l’ARNm et conduisent à des erreurs de lecture.
Les phénicols (exemples : chloramphénicol, thiamphénicol) bloquent la formation de la liaison peptidique. Ils se fixent sur la grande sous-unité du ribosome bactérien (50 Svedberg) mais pas sur celle des ribosomes eucaryotes.
Les cyclines (exemples : tétracycline, doxycycline, auréomycine) : en se fixant sur la sous-unité (30 S), elles bloquent l’élongation de la chaîne polypeptidique.
Les macrolides et kétolides (exemples : érythromycine, azithromycine) agissent sur la partie 50 S du ribosome et bloquent l’élongation de la chaîne polypeptidique.
La puromycine mime l’extrémité d’un ARNt, prend sa place dans le ribosome et bloque l’élongation de la chaîne polypeptidique.
L'acide fusidique bloque l'action du facteur de traduction EF-G qui permet la translocation (progression) du ribosome sur l'ARN messager.
Inhibition du métabolisme des folates
structure du sulfanilamide, un antibiotique sulfamidé et analogie avec le PABA, précurseur des folates
Une autre classe importante d'antibiotiques interfère avec la production de métabolites essentiels, bloquant la synthèse de différents constituants essentiels de la cellules : lipides, acides aminés, nucléotides.
Une voie particulièrement importante qui est fréquemment ciblée est celle de la synthèse des folates (vitamine B9). Ses dérivés, notamment le dihydrofolate et le tétrahydrofolate, interviennent dans des réactions de transfert de groupements à un atome de carbone (méthyle, formyle) et en particulier dans des réactions de méthylation. Ces réactions sont essentielles à la synthèse de la thymine et par voie de conséquence, celle de l'ADN. Ces transferts de carbone dépendant du folate interviennent également de façon centrale dans le métabolisme de certains acides aminés : méthionine, glycine, sérine et donc indirectement dans la synthèse des protéines.
Plusieurs classes de composés antibiotiques ciblent différentes étapes de cette voie des folates :
Les sulfamidés et le sulfanilamide sont des analogues structurels de l'acide p-aminobenzoïque ou PABA. Ce dernier composé est l'un des éléments qui interviennent dans la synthèse des folates chez les bactéries et chez les plantes. Le sulfanilamide est un inhibiteur de la dihydroptéroate synthase et bloque la synthèse du dihydrofolate. Le triméthoprime intervient en aval dans la voie, en inhibant la synthèse de tétrahydrofolate par la dihydrofolate réductase. Le triméthoprime est sélectif de la dihyrdrofolate réducate des bactéries et n'inhibe pas l'enzyme humaine, ce qui rend possible son utilisation thérapeutique comme antibiotique (contrairement au méthotrexate, qui inhibe la dihydrofolate réductase humaine et est utilisé comme anticancéreux)
Thérapeutique
Sur les milliers d'antibiotiques connus, seulement un peu plus d'une centaine sont efficaces et utilisables pour des applications médicales et font donc partie de la pharmacopée moderne. Les autres sont trop toxiques, trop instables ou ont une biodisponibilité insuffisante chez l'homme. Les antibiotiques actuellement utilisés sont le plus souvent des molécules dérivées de produits naturels, dont on a légèrement modifié la structure pour améliorer leurs propriétés thérapeutiques ou contourner les problèmes de résistance. D'autres enfin ne sont plus utilisés parce que les bactéries pathogènes y sont devenues résistantes, c'est par exemple le cas de la streptomycine qui était autrefois utilisée pour traiter la tuberculose.
Près de la moitié des antibiotiques utilisés en thérapeutique ciblent le ribosome bactérien et environ un quart d'entre eux sont des bêta-lactames, qui ciblent la synthèse de la paroi bactérienne. Si on regarde les prescriptions, on constate que ce sont les bêta-lactames (pénicillines et céphalosporines) qui sont les plus antibiotiques les plus utilisés, en particulier par les médecins généralistes. En France, ils représentent près des deux tiers des doses définies journalières utilisés, devant les macrolides (~15 %).
Indications des différents antibiotiques
Exemple d'antibiogramme. Sur une boite de culture, on dispose des disques imprégnés d'une solution de chaque antibiotique. Après incubation, on observe des disques d'inhibition de croissance. Plus le disque est grand, plus l'antibiotique correspondant est efficace.
Face à une infection bactérienne, le choix d'un antibiotique à utiliser dépend d'un ensemble de paramètres. Deux types de critères doivent être pris en compte, ceux qui dépendent du germe responsable lui-même et ceux qui dépendent du patient et du site de l'infection. Les premiers sont liés au spectre d'activité des différents antibiotiques, il est en effet nécessaire d'utiliser une molécule qui soit efficace sur le germe responsable de l'infection, en particulier lorsqu'on a affaire à des bactéries multirésistantes. Les seconds concernent l'interaction du médicament antibiotique avec le patient. Ceci concerne par exemple la capacité de l'antibiotique à atteindre efficacement le site de l'infection, l'existence d'un terrain allergique à certains antibiotiques ou encore la toxicité du composé utilisé (voir plus bas).
Les différents antibiotiques disponibles possèdent des spectres d'activité variés, certains étant plus actifs sur les bactéries gram positives ou gram négatives, sur les germes aérobies ou anaérobies ou encore sur les bactéries capable de pénétrer à l'intérieur des cellules infectées. Pour déterminer les antibiotiques efficaces, en particulier en cas d'échec du traitement de première intention, on réalise souvent un test antibiogramme : le germe responsable est mis en culture dans une boîte de gélose Müller-Hinton contenant plusieurs pastilles d’antibiotique qui vont inhiber plus ou moins le développement du micro-organisme, ce qui permet de comparer la sensibilité des bactéries à tel ou tel antibiotique.
Pour les infections sévères ou difficiles, on peut être amené à utiliser des combinaisons d'antibiotiques (poly-antibiothérapies). C'est en particulier le cas actuellement pour le traitement de la tuberculose, en raison des résistances acquises par le bacille de Koch pour lequel on utilise dans la phase initiale une quadrithérapie : isoniazide, rifampicine, pyrazinamide et éthambutol.
Enfin, en raison de l'émergence progressive de germes multirésistants, certaines molécules de génération récente sont réservées au traitement d'infections « difficiles », résistantes aux traitements traditionnels utilisés en première intention. C'est en particulier le cas des carbapenems comme l'imipenem ou des oxazolidinones comme le linezolide. Cette restriction à pour objectif de retarder la propagation de résistance à ces nouveaux composés et donc de prolonger l'efficacité de l'arsenal thérapeutique disponible.
Paramètres d'activité
L'analyse de l'activité d'un antibiotique donné sur une bactérie a conduit à définir un certain nombre de paramètres qualitatifs et quantitatifs. Le premier d'entre eux est le spectre d'activité qui définit la liste des espèces bactériennes sur lesquelles un antibiotique agit. Le spectre est propre à chaque antibiotique, et peut varier dans le temps à la suite de l'apparition de nouvelles résistances chez les différentes espèces bactériennes. L'autre concept majeur en antibiothérapie est celui de concentration minimale inhibitrice ou CMI (en anglais MIC, pour Minimal inhibitory concentration). Dans la pratique, on définit la CMI comme la concentration minimale d'antibiotique permettant d'inhiber (bactériostase) totalement la multiplication bactérienne, après 18 à 24 heures de contact à 37 °C. Ceci se décline en plusieurs variantes :
la CMI50 est la plus faible concentration inhibant, en 18 à 24 heures, la multiplication de 50 % des bactéries ;
la CMI90 est la plus faible concentration inhibant, en 18 à 24 heures, la multiplication de 90 % des bactéries.
On définit également la concentration minimale bactéricide (CMB), qui est la plus faible concentration permettant de détruire ou de tuer (bactéricidie) 99,99 % des bactéries après 18 à 24 heures de contact avec l'antibiotique. La CMI et la CMB sont caractéristiques d'un antibiotique pour une souche donnée. L'analyse de la concentration minimale bactéricide et de la concentration minimale inhibitrice (CMB/CMI) permet de caractériser l'effet de l'antibiotique étudié sur une souche bactérienne donnée. Lorsque le rapport CMB / CMI = 1, l'antibiotique est dit « bactéricide absolu », s'il est proche de 1, l'antibiotique est dit « bactéricide », s'il est supérieur à 2, l'antibiotique est dit simplement « bactériostatique ». En dépit d'efforts de standardisation des méthodes de détermination des CMI, il subsiste des différences d'un auteur à l'autre qui sont liées à la variabilité des conditions expérimentales utilisées : divers facteurs peuvent jouer : Composition des milieux, taille de l'inoculum, souches de phénotypes différents, etc.
Il existe également d'autres paramètres qui servent à caractériser le mode d'action d'un antibiotique et en particulier sa pharmacologie chez le patient :
la concentration sérique maximale après l'administration de l'antibiotique, ou Cmax ;
l'index thérapeutique sérique est égal à Cmax / CMI50. Plus ce paramètre est élevé, plus l'antibiotique sera efficace ;
le temps d'antibiotique utile est la durée pendant laquelle la concentration sérique d'un antibiotique donné est supérieure à sa CMI pour un germe donné. Il correspond à la durée pendant laquelle il va avoir une activité sur les bactéries infectieuses dans l'organisme du patient ;
le Tmax est le temps qu'il faut attendre pour atteindre la concentration sérique maximale Cmax ;
la surface sous la courbe est un très bon indicateur de l'activité d'un antibiotique. On trace la courbe de l'évolution de la concentration de l'antibiotique dans le temps ; on place la ligne horizontale qui correspond à la CMI90. La surface sous la courbe est celle comprise entre la courbe des concentrations et la ligne de la CMI90. La surface sous la courbe est propre à un antibiotique pour un germe donné.
Effets secondaires
Mécanismes
Plusieurs mécanismes peuvent expliquer les effets indésirables liés à la prise d'antibiotique, parmi lesquels on trouve :
Immunotoxicité : le médicament joue alors le rôle d'élément sensibilisateur. Les principales classes d'antibiotiques concernées sont les bêta-lactamines et les sulfamides. On distingue selon la classification de Gell et Coombs, les réactions de type 1 provoquant des phénomènes anaphylactiques, asthme, choc anaphylactique). Les pénicillines peuvent induire des réactions anaphylactiques avec une prévalence de 0,01% (réf. 1968 mais largement citée dans la littérature) de type 2 (cytopénie, anémie hémolytique...), de type 3 (vascularite immuno-allergique...), de type 4 (hypersensibilité retardée).
de type 1 provoquant des phénomènes anaphylactiques, asthme, choc anaphylactique). Les pénicillines peuvent induire des réactions anaphylactiques avec une prévalence de 0,01% (réf. 1968 mais largement citée dans la littérature)
de type 2 (cytopénie, anémie hémolytique...),
de type 3 (vascularite immuno-allergique...),
de type 4 (hypersensibilité retardée).
Réactions anaphylactoïdes : la perfusion trop rapide de vancomycine peut entraîner un syndrome dit de l'Homme Rouge (Red Man Syndrome), lié à un phénomène d'histamino-libération.
Troubles métaboliques : L'acide fusidique ou la rifampicine peuvent entraîner une hyperbilirubinémie. L'amphotéricine B augmente le risque d'hypokaliémie.
L'acide fusidique ou la rifampicine peuvent entraîner une hyperbilirubinémie.
L'amphotéricine B augmente le risque d'hypokaliémie.
Interactions médicamenteuses (induction et inhibition enzymatique) : Certains antibiotiques sont des inhibiteurs enzymatiques. C'est le cas des macrolides, de certaines cyclines telle la doxycycline, du métronidazole, de certains anti-fongiques azolés (fluconazole,itraconazole, kétoconazole, miconazole). Ils peuvent alors entraîner un surdosage des antivitaminiques K (AVK), de la théophyline, des dérives de l'ergot de seigle (ergotisme, nécrose des extrémités), risque majorée d'hypoglycémie (avec les azolés). Certains antibiotiques sont des inducteurs enzymatiques. C'est le cas de la rifampicine, de la rifabutine. Ils peuvent alors diminuer le taux des œstroprogestatifs, majorer l'hépatotoxicité de l'isoniazide..
Certains antibiotiques sont des inhibiteurs enzymatiques. C'est le cas des macrolides, de certaines cyclines telle la doxycycline, du métronidazole, de certains anti-fongiques azolés (fluconazole,itraconazole, kétoconazole, miconazole). Ils peuvent alors entraîner un surdosage des antivitaminiques K (AVK), de la théophyline, des dérives de l'ergot de seigle (ergotisme, nécrose des extrémités), risque majorée d'hypoglycémie (avec les azolés).
Certains antibiotiques sont des inducteurs enzymatiques. C'est le cas de la rifampicine, de la rifabutine. Ils peuvent alors diminuer le taux des œstroprogestatifs, majorer l'hépatotoxicité de l'isoniazide..
Phototoxicité des fluoroquinolones, des cyclines ou du voriconazole.
Toxicité
Certains antibiotiques ne sont pas totalement spécifiques des bactéries et ont une certaine toxicité sur les cellules humaines, en particulier en cas de surdosage. C'est en particulier le cas pour certains antibiotiques qui ciblent la synthèse des protéines et le ribosome, comme les aminoglycosides. Il existe en effet une assez grande similarité de fonctionnement entre le ribosome des bactéries et celui qui est présent dans les mitochondries des animaux, ce qui, à forte dose, peut conduire à une inhibition des ribosomes mitochondriaux et donc à un effet toxique. Ce mécanisme est responsable de la nephrotoxicité des aminoglycosides à trop forte dose (voir plus bas).
Manifestations pulmonaires
Des bronchospames, des insuffisances respiratoires aigües peuvent être liés à des réactions anaphylactoïdes.
Des pneumopathies interstitielles immuno-allergiques peuvent être provoquées par les bêta-lactamines, les sulfamides ou les cyclines. On décrit aussi des pneumopathies alvéolaire aigües liée à la prise de bêta-lactamines ou de cyclines. Les nitrofurantoïnes peuvent rarement provoquer des pneumopathies interstitielles desquamations. Les sulfamides et les bêta-lactamines peuvent induire des angéites leucocytoclasiques.
Manifestations rénales
Néphropathie toxique : on observe des nécroses tubulaires aigües notamment provoquées par les aminosides (prévalence entre 7% et 25%, la gentamicin (26%) étant plus néphrotoxique que la tobramycin (12%)), les céphalosporines, l'amphotéricine B (une dysfonction rénale est observée dans 60% à 80% des cas, mais dans une large mesure, ces perturbations sont transitoires) et les polymyxines, des néphropathies tubulo-interstitielles provoquées par les bêta-lactamines, les sulfamides, la rifampicine, les fluoroquinolones, les glycopeptides et les nitrofurantoïnes.
Des néphropathies immuno-allergiques peuvent être provoquées par de très nombreuses classes d'antibiotiques . Les bêta-lactamines et la rifampicine sont les plus souvent incriminées.
À noter les cristalluries provoquées par les fluoroquinolones ou les sulfamides, les nitrofurantoïnes, et les lithiases rénales provoquées par les pénicillines, les céphalosporines, les nitrofurantoïnes ou la sulfadiazine. On décrit aussi des glomérulonéphrites induite par la rifampicine ou l'isoniazide ou par la prise de cyclines .
Manifestations neurologiques
Les aminosides présentent une toxicité cochléo-vestibulaire. Celle-ci est cumulative et irréversible en cas de traitement prolongé. Précisément, on note une vestibulo-toxicité de l'ordre de 15 % des patients traités (certaines études rapportent une vestibulotoxicité de 10 % pour les streptomycine, et de 20 % pour la gentamicine).
Une hypertension intra-crânienne peut être liée à la prise de fluoroquinolones, de tétracyclines, des nitrofurantoïnes, du sulfaméthoxazole.
Des troubles neuro-sensoriels sont possibles après la prise de fluoroquinolones. Indiquons que rarement l'hydroxyquinoléine peut entraîner des neuropathies sensitives ainsi que des névrites optiques , et l'imidazolé (auquel les quinoléines sont associées dans le traitement des amoeboses intestinales), peut entrainer, à forte dose, une neuropathie sensitive.
De façon assez peu spécifique, insomnies et vertiges peuvent être observés après la prise de nombreuses classes d'antibiotiques.
Manifestations hématologiques
Comme d'autres médicaments, les antibiotiques peuvent parfois induire des syndromes hématologiques :
Cytopénies observées avec les bêta-lactamines, les sulfamides et sont en général réversibles. On estime à 1% la prévalence d'une neutropénie induite par la prise de bêta-lactamines, chez les patients ayant une fonction hépatique normale et pour une prise de moins de 10 jours. À noter, les effets myélotoxiques des oxazolidinones, notamment pour les traitements au long cours
Des anémies hémolytiques (immune, déficit en G6PD) sont décrites après la prise de sulfamides, de céphalosporines. La sulfasalazine peut provoquer une anémie mégaloblastique
Les sulfamides peuvent entraîner une agranulocytose, une anémie hémolytique, une aplasie médullaire. Le chloramphénicol provoque rarement une aplasie médullaire ou une anémie sidéroblastique.
Des coagulopathies sont décrites, en particulier des hypoprothrombinémies à la suite de la prise de bêta-lactamines, de cyclines mais aussi la prise de sulfamides, de chloramphénicol.
La dapsone peut provoquer une méthémoglobinémie.
Par ailleurs, selon un mécanisme allergique, les antibiotiques peuvent induire un syndrome d'hypersensibilité médicamenteuse, lequel s'accompagne en règle générale d'une hyperéosinophilie.
Manifestations hépatiques
Parmi les effets secondaires documentés au niveau hépatique, on peut citer :
Hépatites cytolytiques avec les kétolides, l'isoniazide, la rifampicine,
Hépatites cholestatiques avec les avec l'amoxicilline-acide clavulanique, l'érythromicine
L'acide fusidique ou la rifampicine peuvent entraîner une hyperbilirubinémie.
Allergies
Rash en réaction à l'administration d'amoxicilline.
Les antibiotiques sont parmi les médicaments ceux pour lesquels les réactions allergiques sont les plus fréquentes. C'est en particulier le cas des bêta-lactames et des macrolides. L'allergie à l'un des antibiotiques d'une famille rend probable l'existence d'une allergie aux autres antibiotiques de la même classe. En revanche, il n'y a pas de raison qu'il existe des allergies croisées entre molécules de classes différentes, compte tenu des différences importantes de structure chimique, de mode d'action et de biodisponibilité. Les allergies aux pénicillines sont particulièrement fréquentes mais peuvent disparaître après plusieurs années.
Les manifestations allergiques peuvent inclure des éruptions cutanées (rash), de l'urticaire, de l'œdème, de la gêne respiratoire et plus rarement des manifestations plus graves (œdème de Quincke, choc anaphylactique...). Indiquons les effets antabuses qui peuvent être provoqués par les imidazolés.
Système digestif
Des nausées, des vomissements peuvent être observées avec toutes les classes d'antibiotiques.
Chez l'homme, le tube digestif contient une flore intestinale commensale importante qui contribue au processus de digestion. Les traitements antibiotiques et en particulier ceux utilisant des composés à large spectre tuent non seulement les bactéries pathogènes responsables des infections, mais de manière collatérale certaines de ces bactéries commensales. Ceci conduit à un déséquilibre momentané de la flore bactérienne digestive et peut ainsi causer des troubles du transit intestinal plus ou moins importants qui se manifestent en général par des diarrhées pendant la durée du traitement.
Des diarrhées motrices sont essentiellement observées après la prise de macrolides ou d'acide clavulanique. Les tétracyclines peuvent entraîner des œsophagites
Plus rarement, et jusqu'à deux mois après l'arrêt du traitement, cela peut faciliter aussi la recolonisation du tube digestif par des bactéries pathogènes. Certaines de ces bactéries sont susceptibles de favoriser des infections bénignes ou graves, par exemple Clostridium difficile ou Klebsiella Oxytoca.
L'administration ou la consommation de probiotiques tels que Lactobacillus et Bifidobacterium, pourrait permettre de réduire le risque de développement d'une infection à C. difficile lors d'une antibiothérapie. Une telle administration n'a cependant pas pour l'instant démontré d'impact significatif en termes de morbi-mortalité des infections digestives graves à C. difficile (colite pseudomembraneuse). Ces « substances d'origine microbienne » ont en commun l'absence de démonstration d'une activité clinique spécifique.
Antibiotiques et cancer
Une étude épidémiologique a aussi mis en évidence que la prise d'antibiotiques était statistiquement associée à une augmentation modeste mais significative du risque de contracter certains cancers chez les participants ayant eu des prescriptions répétées d'antibiotiques. Cette augmentation était de 20 à 50 % du risque relatif par rapport aux personnes non-exposées (comparée à 2300 % pour l'usage du tabac dans le cancer du poumon). Ces études montrent aussi qu'il n'y a pas de lien causal direct et cet effet n'est pas clairement expliqué.
Résistance aux antibiotiques
Lorsqu'une population de bactéries est soumise à l'action d'un antibiotique dans son milieu, elle subit une pression de sélection, qui favorise les cellules qui sont les mieux capables de résister à l'effet de ces molécules. Petit à petit, l'émergence de modifications génétiques permettant un niveau de résistance plus élevé se trouve ainsi sélectionnée. L'action des antibiotiques sur les bactéries induit ainsi un processus d'évolution darwinienne '« en accéléré » que l'on peut observer à l'échelle de temps humaine. Les premiers antibiotiques ont été introduits à la fin des années 1930 et aujourd'hui, la résistance à ces composés de première génération, pénicilline, streptomycine, s'est très largement répandue chez les bactéries, si bien que l'on a cessé de les utiliser pour des fins thérapeutiques. Le tableau suivant indique les dates d'introduction des grandes familles d'antibiotiques dans l'arsenal thérapeutique et les dates d'apparition des premières résistances sur des souches cliniques.
Antibiotique Année d'introduction Apparition des premières résistances Sulfamides 1936 1940 Pénicilline G 1943 1946 Streptomycine 1943 1959 Chloramphénicol 1947 1959 Tétracycline 1948 1953 Erythromycine 1952 1988 Ampicilline 1961 1973 Ciprofloxacine 1987 2006
De nombreux antibiotiques sont des produits naturels ou dérivés de produits naturels, souvent synthétisés par des bactéries elles-mêmes pour éliminer leur compétiteurs dans le milieu environnant. Ces bactéries productrices d'antibiotiques ont en général développé en même temps des mécanismes de résistance leur permettant d'éviter les effets du composé qu'elles produisent. Des gènes de résistance aux antibiotiques pré-existaient donc souvent dans la biosphère bactérienne, avant leur utilisation par l'homme. L'émergence plus ou moins rapide de résistance chez les organismes pathogènes n'est donc pas surprenante, elle est souvent liée soit à l'acquisition par transfert d'un de ces gènes de résistance, soit à une adaptation d'un de ces gènes de résistance à une modification des molécules utilisées. Ainsi, l'amélioration progressive des bêta-lactames par l'industrie (exemple : céphalosporines de 1, de 2 puis de 3 génération) s'est accompagnée d'une évolution concomitante des bêta-lactamases qui se sont progressivement adaptées aux nouveaux composés, sous l'effet de la pression de sélection.
Mécanismes de résistance
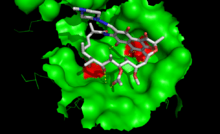
Rifampicine fixée à sa cible, l'ARN polymérase bactérienne. La surface de l'enzyme est indiquée en vert. Les mutations conférant la résistance à la rifampicine correspondent aux acides aminés en rouge
Il existe différents mécanismes de résistance, certains généraux qui fonctionnent contre un large spectre d'antibiotiques et d'autres très spécifiques d'un seul. Il existe également des mécanismes de transfert d'une espèce à une autre, ce qui favorise la dissémination de la résistance et qui sont présentés plus bas. Dans tous les cas, le mécanisme aboutit à une action fortement réduite de l'antibiotique sur sa cible ou à une perte d'effet de cette action. Il existe une grande variété de mécanismes d'action que l'on peut regrouper dans les grandes catégories suivantes :
La mutation de la cible de l'antibiotique. Chaque antibiotique agit en se fixant sur une cible précise dans la cellule : paroi, ribosome... La présence d'une modification consécutive à une mutation modifie le site de fixation et empêche ainsi la liaison de l'antibiotique. C'est un des mécanismes de résistance à la streptomycine, l'un des premiers antibiotiques utilisés pour traiter la tuberculose. C'est aussi l'un des principaux mécanisme de résistance à la rifampicine qui est l'un des antibiotiques qui a remplacé la streptomycine. On observe des mutations de l'ARN polymérase bactérienne qui bloquent la liaison de la rifampicine. Les acides aminés mutés sont situés à proximité immédiate du site de fixation (voir figure à droite). La modification de la cible de l'antibiotique. Une enzyme spécifique effectue une modification chimique covalente de la cible, par exemple une méthylation, ce qui inhibe la fixation de l'antibiotique, comme dans le cas précédent, mais sans qu'il y ait altération du génome. Ce type de mécanisme est rencontré dans la résistance aux macrolides, où il existe une méthylase qui confère la résistance en modifiant l'ARN ribosomique au niveau du site de liaison de l'antibiotique. La sur-expression de la cible de l'antibiotique. En produisant davantage de la macromolécule ciblée, la bactérie arrive à maintenir suffisamment d'activité biologique pour se développer, malgré la présence de l'antibiotique ; Le contournement métabolique. La bactérie active une voie métabolique alternative qui prend le relai de voie métabolique bloquée par l'antibiotique. La fonction biologique est ainsi maintenue. La modification de l'antibiotique. De nombreuses souches résistantes fabriquent une enzyme qui modifie ou qui clive la molécule d'antibiotique, la rendant inactive. C'est le mécanisme principal de résistance aux β-lactamines (famille de la pénicilline et des céphalosporines) qui implique les enzymes de la famille des β-lactamases La réduction de la perméabilité membranaire. La bactérie « ferme » les pores par lesquels l'antibiotique pénètre dans la cellule. Ces pores sont normalement constitués par des protéines qui forment de canaux et que l'on appelle des porines. Les bactéries résistantes réduisent leur nombre de porines. L'efflux des antibiotiques. Les bactéries sont capables d'éliminer les antibiotiques par pompage actif hors de la cellule, qui « recrache » littéralement les composés toxiques au dehors. C'est l'un des principaux mécanismes de résistance de Pseudomonas aeruginosa, pathogène opportuniste responsable de nombreuses infections nosocomiales. Défense altruiste. Des bactéries très résistantes sont capables de synthétiser l’indole en très grande quantité pour subvenir aux besoins des bactéries sensibles. Ce composé organique possède une double fonction de résistance : efflux des antibiotiques et activation d’une voie métabolique empêchant la synthèse de radicaux libres qui peut être favorisée par l’antibiotique.
Résistance naturelle
On peut parler de résistance naturelle si toutes les souches d’une même espèce sont résistantes à un antibiotique. C’est l’expression d’une propriété innée reflétant l’empêchement d’accéder à la cible ou l’absence de la cible. Exemple : l'imperméabilité des parois des bactéries Gram- ou leur absence de paroi.
On rencontre ce type de résistance chez les souches sauvages, n'ayant jamais été en contact avec un antibiotique.
Résistance acquise
Chromosomique
La résistance acquise survient lorsqu'un individu d'une population de bactéries normalement sensibles devient résistant. Cette résistance lui confère un avantage sélectif qui lui permet de se multiplier en présence de l'antibiotique, tandis que les autres sont inhibées ou tuées. L'apparition de la résistance est en général la conséquence d'une mutation qui apparait dans le chromosome, c'est pourquoi on parle de résistance chromosomique. En conditions normales, l'apparition de mutation est un processus spontané avec des fréquences d’apparition variables, comprises entre 10 et 10, suivant l'antibiotique, la souche et la nature du mécanisme de résistance. C’est un événement rare. L’antibiotique n’est pas l’agent mutagène, il sélectionne seulement les mutants devenus résistants. Cela peut conduire à la résistance simultanée à toute une famille d'antibiotiques.
La mutation peut par exemple se produire dans le gène qui code la protéine ciblée par l'antibiotique. La protéine mutante ne fixe plus aussi bien l'antibiotique qui ne peut plus agir.
Les mutations apparaissent de manière indépendante, donc les risques de sélectionner simultanément par mutation spontanée des résistances multiples à plusieurs antibiotiques sont très faibles. Une double résistance multiplie les probabilités d’apparition de résistance à chaque molécule, c’est-à-dire 10 à 10.
La résistance chromosomique est en général largement confinée à l'espèce chez laquelle elle apparait, car elle n'est pas facilement transférable à une autre cellule, faute de mécanisme spécifique de transfert.
Plasmidique
Les plasmides sont des petits ADN circulaires capables de réplication autonome dans les bactéries, à côté du chromosome. Les plasmides naturels portent en général un certain nombre de gènes et en particulier des gènes de résistances à des antibiotiques, ainsi que des gènes de transfert permettant le passage du plasmide d'une bactérie à une autre. Ce transfert s'effectue en général par conjugaison, un processus par lequel la bactérie émettrice fabrique un pilus, sorte de filament creux au travers duquel l'ADN du plasmide est injecté pour passer dans une autre cellule bactérienne. La synthèse du pilus est en général aussi sous le contrôle de gènes portés par le plasmide.
Il peut s'agir d'un transfert entre bactéries de la même espèce, mais aussi entre bactéries d'espèces voisines. Ce mécanisme de conjugaison est un mécanisme de transfert actif d'ADN très efficace et permet une propagation rapide des résistance. Souvent, plusieurs gènes de résistance sont regroupés sur le même plasmide qui est ainsi transféré de cellule en cellule.
Le premier cas de résistance fut observé en 1951 sur un patient japonais. Il souffrait d'une infection à Shigelle (une entérobactérie, c’est-à-dire un bacille gram négatif, mobile). La Shigelle provoquait une dysenterie qui pouvait être soignée par des sulfamidés, mais elle était devenue résistante à ces sulfamidés. Les chercheurs ont démontré que cette résistance était accompagnée par des résistances in vitro à d’autres antibactériens.
Ils ont isolé dans le tube digestif d’autres malades, des souches d’Escherichia coli (une autre Entérobactérie, très répandue dans l’eau, le sol, le lait et les selles) qui avaient acquis une résistance aux sulfamidés par un transfert horizontal entre les deux espèces.
Il existe d'autres mécanismes de transfert d'ADN entre espèces bactériennes qui permettent la propagation de gènes de résistance aux antibiotiques entre bactéries. Ces mécanismes ne sont toutefois pas spécifiques des plasmides et peuvent également intervenir pour le transfert de résistances chromosomiques.
La transduction : le vecteur est un virus bactériophage. En se répliquant, le phage intègre une partie du génome bactérien. En quittant la cellule, il emporte des gènes supplémentaires (bactériens) qui pourront être transfectés dans une autre bactérie. Ce système est efficace, mais les échanges sont limités en taille (le phage ne peut pas transférer un long morceau d'ADN bactérien) aux organismes proches phylogénétiquement pour la reconnaissance phage/bactérie.
La transformation : la bactérie acquiert et incorpore de l’ADN exogène nu présent dans son environnement. Cela peut être de l’ADN d’une bactérie morte qui, une fois capté, permet l’expression de ses gènes par la nouvelle bactérie. C’est un événement très rare qui existe chez les bactéries Gram positives.
Résistances acquises courantes
Le pneumocoque (Streptococcus pneumoniae) a développé une résistance par modification d’une protéine membranaire spécifique où se fixent les pénicillines (la PLP) imposant des doses plus élevées d’antibiotique (typiquement, l’amoxicilline), voire contraignant à prescrire une céphalosporine de 3 génération (souvent la ceftriaxone). Les résistances en France sont documentées depuis 1978. En 2000, on comptait environ 50 % de souches résistantes, en particulier dans les grandes villes.
La résistance au Streptococcus pneumoniae est suivie en France par le Centre national de référence des pneumocoques, AP-HP Hôpital européen Georges-Pompidou, et il publie son rapport dans le Bulletin épidémiologique hebdomadaire ou BEH. (voir lien en bas d'article).
Les staphylocoques méti-résistants, particulièrement redoutables, sont insensibles aux pénicillines (chez eux aussi par modification de leurs PLP), mais aussi par production d’une bêta-lactamase et d’une méticilinase. Les infections à staphylocoque méti-R sont typiquement des infections nosocomiales sévères, responsables d’une lourde mortalité. Les glycopeptides sont une alternative thérapeutique classique.
La production de bêta-lactamase concerne plusieurs souches bactériennes : gonocoques, haemophilus influenzae,anaérobies, entérocoques.
La surconsommation : un problème de santé publique
En médecine humaine
Les spécialistes critiquent dans ce contexte la prescription parfois trop à la légère (fréquente) de certains antibiotiques (surprescription), y compris quand ils sont inefficaces (contre les virus par exemple).
Le phénomène serait aussi amplifié :
par l’usage de doses trop faibles (y compris dans des médicaments en vente libre)
ou sur une durée trop courte (moins de 8 jours), ou trop longues
ou par l'absorption de petites quantités d'antibiotiques contenues dans certains aliments, notamment des viandes ou poissons d'élevage.
Les antibio-résistances ont conduit les épidémiologistes et les autorités sanitaires à préconiser un usage plus raisonné des antibiotiques (un peu à la manière de la gestion internationale concertée par l’OMS des médicaments antipaludéens).
Les antibiotiques sont sans effet sur les virus ; toutefois, il arrive que ceux-ci soient prescrits dans le cas où l’organisme est affaibli, pour éviter que celui-ci ne devienne vulnérable à des surinfections bactériennes. Cependant, nombreux (en France) sont les médecins qui prescrivent systématiquement des antibiotiques pour des affections virales, alors qu'ils ne seront pas efficaces et qu'ils ne font que renforcer la résistance des bactéries aux antibiotiques.
Ces résistances aux antibiotiques deviennent extrêmement préoccupantes, elles sont l'objet d'avertissements réguliers des agences gouvernementales et internationales. Par exemple :
plus d'un tiers des affections au staphylocoque doré sont désormais impossibles à traiter avec les antibiotiques, causant amputations et décès. Il est probable que les 3/4 des 4 200 décès pour infections nosocomiales soient le fait de bactéries multirésistantes aux antibiotiques.
la résistance du pneumocoque à la pénicilline G est passée en France, de 0,5 % à 45 % entre 1984 et 2001. La France - qui est un des pays les plus grands consommateurs d'antibiotiques - compte le plus grand nombre d’échecs thérapeutiques contre des pneumocoques totalement résistants à la pénicilline.
En médecine vétérinaire
En 1997, 48 % du total des ventes européennes d'antibiotiques est destiné à un usage vétérinaire. En 2013, d'après l'OMS, au moins 50 % des antibiotiques mondiaux sont destinés aux animaux.
Les antibiotiques peuvent être utilisés en élevage comme médicaments vétérinaires, à des fins curatives ou préventives, ainsi qu'à des fins de «facteurs de croissance » :
pour protéger les élevages (porcins, bovins, volailles) des maladies, de manière systématique, avant même que ces animaux ne deviennent malades (comme s'il s'agissait d'un aliment naturel qui jouerait un rôle de prévention) ;
ou même comme « stimulateurs de croissance » de ces animaux, pour augmenter de façon importante la rentabilité de l'élevage.
Ces additifs antibiotiques pour l’alimentation animale sont interdits en Europe depuis le 1 janvier 2006 (la Suède l'avait interdit depuis 1986) mais toujours autorisée à visée préventive et curative, notamment collectivement pour un groupe d'animaux, du fait de la promiscuité dans l'élevage industriel qui rend impossible le traitement individuel. Ils sont autorisés au Canada mais les agriculteurs de la filière avicole ont décidé d'arrêter de les utiliser ; ils sont aussi autorisés aux États-Unis.
Consommation dans le monde
Aux États-Unis, 80 % des antibiotiques vendus sont destinés aux animaux (2 % pour les animaux domestiques, 98 % pour l'élevage).
En France, 699,09 t d'antibiotiques ont été vendus en 2013 à destination des animaux (1,25 pour les carnivores domestique, 98,75 % pour l'élevage), il s'agit du plus faible volume depuis 1999 (début du suivi national des ventes d'antibiotiques) avec une baisse de 46.7 %. Cette baisse de volume est a pondérer avec le fait que les antibiotiques récents sont plus actifs avec des doses moindres. C'est pourquoi on calcule l'exposition des animaux aux antibiotique avec la mesure ALEA (Animal Level of Exposure to Antimicrobials) qui prend en compte la posologie (durée et dosage du traitement) des animaux d'une espèce sous antibiotiques (poids vif traité) que l'on divise par la masse de la population animale concernée totale (potentiellement traitable). Ainsi, un ALEA de 0,305 pour les bovins signifie que les traitements antibiotiques ont traité 35 % du poids vif des bovins, l'indice peut donc être être supérieur à 1 selon le nombre et la durée des traitements. L'exposition en 2013 est en baisse de 5,5 % par rapport à 1999 toute espèce confondue mais augmente notamment pour les bovins (+14.7 %) et les volailles (+30 %) tandis qu'elle diminue pour les porcs (-25 %) et les lapins (-50 %).
Poids vif traité et ALEA pour les différentes espèces en France en 2013
|
Bovins |
Veaux voie orale |
Chats & Chiens |
Chevaux |
Poissons |
Lapins |
Ovins & Caprins |
Porcs |
Volailles |
Autres |
Total |
| Poids vif traité (tonnage) |
2 839 593 |
525 249 |
104 770 |
108 806 |
8 027 |
273 824 |
231 361 |
2 730 607 |
2 043 147 |
18 300 |
8 363 438 |
| ALEA |
0,305 |
2,628 |
0,668 |
0,366 |
0,178 |
2,701 |
0,404 |
0,951 |
0,117 |
0,525 |
0,550 |
↑ Estimation, traitements de groupe uniquement (les sachets repas, boli et pâtes orales ont été exclus de l'analyse)
Chaque année, la Direction générale de l’alimentation contrôle plus de 20 000 prélèvements de produits animaux ou d’origine animale pour rechercher d’éventuelles traces de résidus de médicaments vétérinaires.
Cela a pour conséquence le passage de gènes résistantes à l'homme (pollution des eaux et sols par les excréments, cuisson pas assez forte pour les détruire) et la présence d'antibiotiques dans la viande si le délai légal de fin de traitement avant abattage n'a pas été respecté. D'après la Direction générale de l'alimentation, cela se produit peu avec moins d'un prélèvement positif sur deux cents en 1998 mais ce n'est pas négligeable à l'échelle nationale.
Historique
Les antibiotiques avant les sulfamides et la pénicilline
Depuis l'antiquité on a pu recourir empiriquement à des moisissures se développant sur le pain, le soja... pour soigner des infections ; c'est cependant après l'adoption de la théorie des germes, puis sous l'impulsion de la théorie de l'évolution, que commence véritablement l'histoire de ce qui allait s'appeler les antibiotiques : les micro-organismes ayant été identifiés comme causes de maladies, les scientifiques se mirent à chercher des substances qui pourraient en inhiber, partiellement ou totalement, le développement. La diffusion des antibiotiques à partir de la fin des années 1940 eut un impact considérable sur la santé des populations, la pratique médicale et la recherche scientifique. Leur utilisation en médecine vétérinaire ainsi qu'en agriculture conduisirent à des changements également conséquents.
Certaines observations, fortuites ou provoquées, incitèrent différents scientifiques à identifier des bactéries inoffensives qui pourraient s’opposer au développement de bactéries pathogènes. En 1877 déjà, Pasteur et Jules Joubert observèrent que l’injection à des rats d’une solution contenant de l’anthrax ainsi que diverses bactéries du sol ne conduisait pas les rats à développer la maladie du charbon. Par ce travail, Pasteur apporta la première description claire et univoque de l’antagonisme microbien que d’autres avaient pu indiquer avant lui. En outre, il entrevit les possibilités thérapeutiques de ce phénomène J.-A. Auzias-Turenne, mort en 1870, avait déjà prôné l’utilisation des antagonismes microbiens à des fins thérapeutiques. Ses idées à ce sujet se trouvent dans son ouvrage posthume La Syphilisation .En 1885, Arnaldo Cantani traita des cas de tuberculose pulmonaire par des pulvérisations de Bacterium termo dans les poumons. En 1887, Rudolf Emmerich montra quant à lui que des animaux auxquels on avait préalablement injecté le streptocoque ne développaient pas le choléra.En 1888 Victor Babeş montre que certaines bactéries saprophytes inhibent le développement de Mycobacterium tuberculosis. En 1889, Bouchard montra que l’injection de Pseudomonas aeruginosa prévenait le développement de l’anthrax chez les rats.
C’est en 1888 qu’une substance antibactérienne fut extraite de Bacillus pyocyaneus par E. von Freudenreich. En 1889, Rudolf Emmerich et Oscar Löw effectuent des essais cliniques sur une substance antibiotique, la pyocyanase produite par Bacillus pyocyaneus une bactérie appelée aujourd’hui Pseudomonas aeruginosa. Instable et toxique, le médicament fut abandonné (mais connut quelques applications sous forme de pommade pour les dermatoses) .
Plusieurs centaines d’exemples d’antagonisme microbien furent ainsi mis en évidence sans avoir de suite pratique. Cela est en partie dû à l’attention accordée alors à une autre voie de recherche, chimiothérapique, à la suite de la découverte de l’arsphénamine (Salvarsan). Par ailleurs l’utilisation thérapeutique des bactériophages, récemment découverts, semblait également à l’époque une voie prometteuse.
Origine de la dénomination « antibiotique »
Si le terme d’antibiose fut proposé en 1889 par Paul Vuillemin, en opposition au phénomène de symbiose, pour décrire le phénomène d’antagonisme entre deux espèces microbiennes, la paternité du terme antibiotique (sous forme adjective ou substantive) est discutée : certains en créditent René Dubos (dès 1940) , d’autres Selman A. Waksman (en 1941, à la suite de sa découverte de la streptomycine qualifiée par lui de « médicament antibiotique » ; voire dès 1932)
Waksman proposa en 1947 les définitions suivantes afin de diminuer les ambiguïtés sur le sens du terme antibiotique :
antibiotique : « inhibition de la croissance ou des activités métaboliques de bactéries ou d’autres micro-organismes par une substance chimique d’origine microbienne »
une substance antibiotique biochimique ou un antibiotique biochimique : « une substance chimique d’origine microbienne, possédant des propriétés antibiotiques » , définition qui exclut les antibiotiques chimiques contenant de métaux lourds toxiques (ex. : mercurescéine en solution aqueuse du mercurochrome, ou autres organomercuriels tels que dans l'ancienne formule du mercryl, ou calomel (chlorure mercureux), de moins en moins utilisés en raison de la toxicité durable de certains de leurs composants et de leur caractère sensibilisant (Le Mercurochromet, la Mercurescéine sodiquet, le Mercryl laurylé ou mercurobutol, le Merfènet teinture composé de borate de phénylmercure), le Merseptyl ou le thiomersal (= mercurothiolate de sodium) se sont avérés sensibilisants et facteurs de dermatoses
L’apparition d'antibiotique de synthèse mena à une nouvelle définition énoncée en 1957 par Turpin et Velu :
- « Tout composé chimique, élaboré par un organisme vivant ou produit par synthèse, à coefficient chimiothérapeutique élevé dont l’activité thérapeutique se manifeste à très faible dose, d’une manière spécifique, par l’inhibition de certains processus vitaux, à l’égard des virus, des micro-organismes ou même de certaines cellules des êtres pluricellulaires »
On relèvera dans cette définition la mention d’usages à destination non seulement de bactéries, mais aussi de virus, et même d’êtres pluricellulaires qui pourrait surprendre tant les récentes campagnes à destination du public — du moins en France — ont rappelé la destination exclusivement antibactérienne des antibiotiques. De nos jours plusieurs définitions coexistent, elles différent par la présence ou non des concepts de toxicité sélective, d’origine bactérienne et de limitation de cible aux seules bactéries.

 词典释义:
词典释义:

 (
( )
) 治疗
治疗
 类药
类药 苗;
苗; ,病原
,病原 ;
; ;
; ,含药物
,含药物 ,药用
,药用 ;
; ,过敏;
,过敏;

 ; 抗生
; 抗生
 antibiotiquem抗
antibiotiquem抗
 ; 抗生
; 抗生


 因
因
 强效抗
强效抗 片
片 药
药