Le carbone est l'élément chimique de numéro atomique 6, de symbole C. C'est la tête de file du groupe des cristallogènes.
Étymologie
Le nom carbone vient du latin carbo, carbōnis signifiant « charbon ».
Historique
Le nom carbone n'apparaît dans le dictionnaire de l'Académie française, qu'à sa 6 édition (1832-5). La Nomenclature chimique de G. DE MORVEAU (1787) lui consacre cependant déjà un article (article Carbone du TLFi, TLFi).
En 1865 dans une analyse des impacts sur la forêt de la consommation de bois de chauffage à Paris, Becquerel publie les poids de carbone des principales formes de bois d'énergie achetés à l'époque à Paris. Selon lui :
1 stère de bois dur (chêne, l'orme, le charme, le hêtre et le frêne) a un contenu carbone d'environ 140 kilos ;
1 stère de bois blanc (bouleau, le tremble, le peuplier et les bois résineux), 87 kilos ;
1 stère de bois à fagots et cotrets, 122 kilos.
Préhistoire
Le carbone est présent sur Terre depuis la formation de celle-ci : il a été produit par nucléosynthèse au cœur des étoiles qui ont explosé avant la formation du système solaire. Il existe sous forme de sédiments, charbon, pétrole, et également sous sa forme pure graphite, diamant. Les diamants naturels pouvant se trouver dans la kimberlite des cheminées d'anciens volcans, notamment en Afrique du Sud et dans l'Arkansas. On peut parfois trouver des diamants microscopiques dans certaines météorites.
Histoire
Elle est marquée par la considération accrue de l'importance du carbone.
Deuxième millénaire (tradition de moines fondeurs, comme les Pères Chartreux, etc. - Élaboration (métallurgie) de fontes et aciers.
Élaboration de la cémentation, « plus vieux » traitement connu en thermochimie.
1797 : Découverte de la forme « diamant » (voir article diamant synthétique).
1828 : Découverte des composés organiques et de la chimie organique (voir article Friedrich Wöhler).
1842 : Avec la résistance des matériaux, August Wöhler pose les fondements de la future « science des matériaux ».
2004 : Découverte du Graphène par Andre Geim, composé d'une seule couche de Graphite.
Nucléosynthèse
L'élément carbone n'est pas directement issu du Big Bang (nucléosynthèse primordiale), car les conditions de sa formation n'étaient pas réunies (la dilatation et le refroidissement de l'univers ont été trop rapides).
Le carbone est en revanche produit en masse dans le cœur des étoiles très massives, dites de la branche horizontale, où trois noyaux d'hélium fusionnent (réaction triple alpha).
Isotopes et masse atomique
Le carbone possède deux isotopes stables dans la nature, C ( abondance = 98,93 %) et C (abondance = 1,07 %). Le premier, C, a été choisi comme nucléide de référence unique pour la masse atomique 12, après plusieurs propositions (anciennement l’hydrogène, puis conjointement avec l’oxygène pour les chimistes). La masse atomique du carbone, 12,0107, est légèrement supérieure à 12 en raison de la présence de l'autre isotope, C.
Le radioisotope C a une période de 5 730 ans et est couramment utilisé pour la datation d'objets archéologiques jusqu'à 50 000 ans. Il ne sera d'aucune utilité pour les archéologues de demain intéressés par les trésors de la civilisation actuelle car les explosions thermonucléaires réalisées dans l'atmosphère à partir des années 1960 ont créé des excès considérables.
Le radioisotope C a une période de 20 minutes. Cette courte période et la relative facilité de substituer un atome de C à un atome de carbone C (stable) en font un isotope utilisé en médecine nucléaire, notamment en tomographie à émission de positon. Les radiotraceurs les plus utilisés à ce jour sont le C-Raclopride qui se fixe préférentiellement sur les récepteurs dopaminergiques D2, et le C-Acétate utilisé en imagerie cardiaque.
Structure électronique
Le carbone possédant 6 électrons adopte une configuration électronique à l'état fondamental 1s 2s 2p. Il possède 4 électrons sur sa couche de valence, ce qui lui permet de former quatre liaisons covalentes, dont des liaisons de type
(première liaison avec un atome) ou de type
(seconde ou troisième liaison). Les liaisons de type
sont toujours accompagnées d'une liaison de type
. Le recouvrement des fonctions électroniques dans une liaison
est plus faible. Ces liaisons sont donc moins « solides ».
Formes du carbone
Corps simple
Huit formes du carbone : diamant, graphite, lonsdaléite, buckminsterfullerène et 2 autres fullerènes, amorphe, et nanotube de carbone Le diamant et le graphite sont les deux formes allotropiques les plus répandues du carbone, elles diffèrent par leur aspect (en haut) et leurs propriétés. Cette différence est due à leur structure (en bas).
Le carbone est présent dans la nature dans deux formes allotropiques principales :
le graphite, empilement de structures cristallines hexagonales et monoplanes (graphènes, et de couleur grise. C'est la forme stable à température et pression ambiante ;
le diamant, de structure cristalline tétraédrique (structure type « diamant ») est transparent. C'est la forme stable à haute température et haute pression, métastable à température et pression ambiante.
Dans les conditions de pression normales, le carbone est sous la forme graphite, dans laquelle chaque atome est lié à trois autres dans une couche d'anneaux hexagonaux fusionnés, comme ceux des composés aromatiques hydrocarbonés. Grâce à la délocalisation des orbitales π {\displaystyle \pi } , le graphite conduit l'électricité. Le graphite est mou, car les liaisons chimiques entre les plans sont faibles (2 % de celles des plans) et les couches glissent donc facilement les unes par rapport aux autres.
Sous très haute pression, le carbone cristallise dans un système cubique à face centrée nommé diamant, dans lequel chaque atome est lié à quatre autres (distance interatomique de 136 pm). Le diamant, grâce à la résistance des liaisons carbone-carbone, est, avec le nitrure de bore, la matière la plus dure à rayer. À température ambiante, la métamorphose en graphite est si lente qu'elle paraît invisible. Sous certaines conditions, le carbone se cristallise en lonsdaléite, une forme similaire au diamant mais hexagonale. De toutes les pierres précieuses, le diamant est la seule à se consumer complètement.
 |
|
 |
|
Le diamant, une des formes cristallines les plus recherchées du carbone
|
|
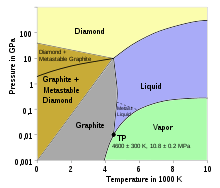
Diagramme de phases simplifié du carbone : phases en fonction de la pression et de la température.
|
En plus du graphite (pur sp) et du diamant (pur sp), le carbone existe sous forme amorphe et hautement désordonnée (a-C). Ces formes amorphes du carbone sont un mélange de sites à trois liaisons de type graphite ou à quatre liaisons de type diamant. De nombreuses méthodes sont utilisées pour fabriquer du a-C : pulvérisation, évaporation par faisceau d'électrons, dépôt à l'arc électrique, ablation laser…
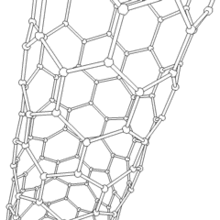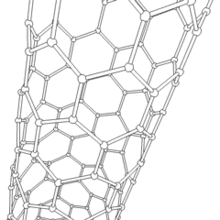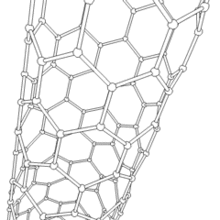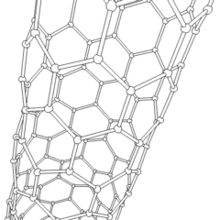
Nanotube de carbone
Le carbone se sublime à 5 100 K. Sous forme gazeuse, il se constitue habituellement en petites chaînes d'atomes appelées carbynes. Refroidies très lentement, celles-ci fusionnent pour former les feuilles graphitiques irrégulières et déformées qui composent la suie. Parmi ces dernières, on trouve en particulier, la forme sphérique monofeuillet appelée fullerène, ou de son nom complet buckminsterfullerène, C60, et ses variétés (Cn n ≤20 ≤100), qui forment des structures extrêmement rigides.
Les oignons de carbone sont des structures basées sur une structure de type fullerène, mais dont la paroi est constituée de plusieurs couches de carbone.
Les formes cylindriques du carbone sont appelées nanotubes (nanotube de carbone, abréviation : NTC). Elles ont été découvertes dans le culot se formant à la cathode de l'arc électrique durant la synthèse de fullerènes. Ces objets de diamètre nanométrique et de longueur atteignant parfois le millimètre se présentent comme des plans de carbone d'épaisseur monoatomique (ou graphène) enroulés sur eux-mêmes et formant un tube de diamètre nanométrique). Les nanotubes dont la paroi n'est constituée que d'un seul plan de carbone sont dits "monofeuillets". Les nanotubes fabriqués par la méthode de l'arc électrique sont presque tous « multifeuillets ».
Le graphène est constitué d'un plan unique de carbone d'épaisseur monoatomique. Le graphène peut être simplement obtenu en prélevant un plan unique de carbone d'un cristal de graphite.
Conjointement à ces structures, on observe un grand nombre de nanoparticules polyédriques. À l'image des oignons et des nanotubes multifeuillets, les observations en microscopie électronique en transmission haute résolution ((en) HRTEM : High-resolution Transmission Electron Microscopy) révèlent que ces nanoparticules de carbone sont constituées de plusieurs couches de graphène, fermées, laissant une cavité nanométrique en leur centre.
Composés du carbone
Le carbone est le composant essentiel des composés organiques, qui contiennent fréquemment au moins une liaison carbone-hydrogène. Cependant le carbone existe aussi dans la nature sous forme inorganique, principalement sous la forme de dioxyde de carbone, et sous forme minérale.
Carbone organique
La chimie du carbone est essentiellement covalente. Le carbone est à la base d'une multitude de composés pouvant contenir un grand nombre d'atomes, en association avec l'hydrogène, l'oxygène, l'azote, les halogènes, le phosphore, le soufre, et les métaux, par liaisons simples, doubles ou triples. L'étude et la synthèse de ces composés constitue la chimie organique. Les principaux composés organiques du carbone sont les « hydrocarbures » des molécules associant carbone et hydrogène. On classe les hydrocarbures en trois familles :
les alcanes, où le carbone forme des liaisons sp (« simples ») : méthane CH4, éthane C2H6, etc. ;
les alcènes, où au moins un carbone forme des liaisons (« double ») (carbones sp) : éthène (éthylène) C2H4, propène C3H6, etc. ;
les alcynes, où au moins un carbone forme des liaisons (« triple ») (carbones sp) : éthyne (acétylène) C2H2, propyne C3H4, etc.
Suivant le nombre d'atomes de carbone, on fait précéder le suffixe -ane, -ène ou -yne :
méth-
éth-
prop-
but-
pent-
hex-
hept-
oct-
non-
déc-
La rotation est libre autour des liaisons simples carbone-carbone. En revanche, les liaisons doubles ou triples sont rigides : la liaison double est planaire, les angles de liaison autour des atomes de carbone sont 120°. Cela conduit à la formation de diastéréomères, c'est-à-dire de composés ayant la même formule chimique mais une disposition différente des atomes dans l'espace. La liaison triple est linéaire.
En outre, le carbone sp peut former des composés chiraux (du grec kheir (ἣ χείρ), la main). Le cas le plus simple est un composé possédant 4 substituants différents autour d'un atome de carbone. Suivant la disposition dans l'espace de ces substituants, on obtient deux molécules qui sont différentes : elles ne sont pas superposables, il s'agit d'une paire d'énantiomères. Les énantiomères sont l'image l'un de l'autre dans un miroir (comme nos deux mains).
Dans les hydrocarbures aromatiques, les atomes de carbone forment des cycles ou noyaux stabilisés par des liaisons π délocalisées.
Carbone inorganique
Ce type d'atomes de carbone est relativement rare en termes de variété par rapport aux carbones organique et minéral. Il se présente le plus souvent sous forme de complexes inorganiques ou organo-métalliques qui intègrent un atome de carbone nu ou une molécule de CO ou de CO2, dans leurs sphères de coordination. Par exemple :
C dans [Fe5C(CO)15] et [Ru6C(CO)17] ;
CO dans les nombreux complexes du type Ni(CO)4 ou Fe(CO)5 ;
CO2 dans le complexe [Ni(CO2){P(C6H11)3}2]0,75C6H5Me.
Carbone minéral
La molécule de dioxyde de carbone CO2 existe à l'état gazeux dans l'atmosphère terrestre. Une certaine quantité de ce CO2 se dissout dans les eaux océaniques et continentales, et une partie du CO2 dissous réagit avec la molécule d'eau pour former de l'acide carbonique H2CO3 suivant la réaction : H2O + CO2(dissous) ⇔ H2CO3.
Puis H2CO3 (dihydrogénocarbonate, ou acide carbonique), étant un diacide, cède ses deux protons dans la mesure des constantes d'acidité des couples acido-basiques (H2CO3/HCO3) et (HCO3/CO3) et de la composition initiale en solutés acido-basiques de l'eau selon les équations : H2CO3 + H2O ⇔ HCO3 (ion hydrogénocarbonate, ou bicarbonate) + H3O (ion hydronium, ou proton hydraté) et : HCO3 + H2O ⇔ CO3 (ion carbonate) + H3O.
Or il se trouve que dans l'eau de mer, ce système de carbonates est présent en grandes quantités et dans des proportions telles qu'il joue un rôle tampon fondamental dans l'acidité de l'eau océanique (pH 8,1-8,4) qu'il permet de rendre très stable. Ce taux de carbonates (et de borates, pour être exact) s'appelle l'alcalinité ou titre alcalimétrique complet (TAC, mesuré en degrés français, ou kH mesuré en °allemands ; il existe d'autres unités. Le mieux est de parler en ppm, ou parties par million). Ce pH a permis à des quantités "géologiques" de tests calcaires de protozoaires planctoniques de former des roches sédimentaires calcaires constituées essentiellement d'un cristal de carbonate de calcium et de magnésium (mélange qu'on appelle le calcaire) : la pierre de Paris, le marbre, etc. Toute cette chimie est traditionnellement incluse dans la chimie inorganique, c'est-à-dire minérale, bien qu'il y ait évidemment de nombreux points sur lesquels cela ne se justifie pas. Ainsi, on pourra qualifier le carbone contenu dans le dioxyde de carbone, l'acide carbonique, l'hydrogénocarbonate et le carbonate, de carbone inorganique. C'est aussi valable pour le carbone diamant et les autres variétés allotropiques du cristal de carbone.
Dangers du carbone et de ses composés
Le carbone pur a une faible toxicité pour les humains et peut être manipulé et même ingéré en toute sécurité sous la forme de graphite ou de charbon de bois. Il est résistant à la dissolution ou l'attaque chimique, même dans le contenu acide du tractus digestif, par exemple.
En revanche, le (di)sulfure de carbone CS2, quoique de structure similaire au dioxyde de carbone, est un liquide hautement toxique utilisé comme solvant (vulcanisation du caoutchouc).
Les autres oxydes de carbone sont le monoxyde de carbone CO, et le suboxyde de carbone C3O2, moins commun. Le monoxyde de carbone est un gaz incolore et inodore, formé par combustion incomplète des composés organiques ou du carbone pur (charbon). Le monoxyde de carbone se lie plus fortement que l'oxygène, à l'hémoglobine sanguine pour former de la carboxyhémoglobine, un composé stable. Le résultat de cette réaction est l'empoisonnement des molécules d'hémoglobine, ce qui peut être mortel (voir l'entrée en question).
L'ion cyanure CN a un comportement chimique similaire à un ion halogénure. Les sels contenant l'ion cyanure sont hautement toxiques. Le cyanogène, un gaz de composition (CN)2 est également proche des halogènes.
Avec les métaux, le carbone forme des carbures C ou des acétylures C2. Quoi qu'il arrive, avec une électronégativité de 2,5, le carbone préfère former des liaisons covalentes. Quelques carbures sont des treillis covalents, comme le carbure de silicium, SiC, qui ressemble au diamant, et est d'ailleurs utilisé pour la taille de ceux-ci.
La toxicité des nouvelles structure de carbone (fullerène, nanotubes, graphène) est aujourd'hui très étudiée. À l'état natif, ces nanostructures restent difficiles à filtrer dans l'air et pourraient être un danger qu'il est nécessaire d'évaluer. Voir le site de : l'Institut National de Recherche et de Sécurité pour la prévention des accidents du travail et des maladies professionnelles (INRS) et le document associé. À noter que dans le cadre de leur utilisation, ces composés se trouvent généralement dispersés dans un solvant, ou fixés sur un substrat solide.

 词典释义:
词典释义:
 [
[ 6号元素]
6号元素]
 水化合物
水化合物 酸气, 二氧化
酸气, 二氧化

 循环
循环 14
14 渣, 焦
渣, 焦 残渣
残渣
 14
14
 +one酮
+one酮

 ;
; ;
; ;
;  素
素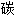





 ,
,  一
一




 ,
,  四
四




 ,
,  二
二



 ,
,  三
三




 , 硬
, 硬
 钼
钼
 锰
锰
 素工具
素工具




 14年代[测、确]定
14年代[测、确]定 合金状态图
合金状态图
 电极
电极 灭火器
灭火器 生铁
生铁 中毒
中毒 , 一氧化
, 一氧化

 容器
容器 ,
,  渣
渣 六偶体
六偶体 黑溶胶
黑溶胶
 量
量




