L'azote est l'élément chimique de numéro atomique 7, de symbole N (du latin nitrogenium). C'est la tête de file du groupe des pnictogènes. Dans le langage courant, l'azote désigne le corps simple N2 (diazote), constituant majoritaire de l'atmosphère terrestre, représentant presque les 4/5 de l'air (78,06 %, en volume).
L'azote est le 34 élément constituant la croûte terrestre par ordre d'importance.
Les minéraux contenant de l'azote sont essentiellement les nitrates, notamment le nitrate de potassium KNO3 (constituant du salpêtre) ou nitre, qui servait autrefois à faire des poudres explosives, et le nitrate de sodium NaNO3 (constituant du salpêtre du Chili).
Histoire
Nomenclature et origine
Antoine Lavoisier a choisi le nom azote, composé de a- (privatif) et du radical grec ζωτ-, « vivant » et signifie donc « privé de vie », du fait que contrairement à l'oxygène, il n'entretient pas la vie des animaux.
L'origine du symbole N est son nom latin « nitrogenium » qui provient du grec nitron gennan, ce qui signifie « formateur de salpêtre » (nitrate de potassium). Le terme anglais nitrogen a conservé cette racine pour désigner l'azote.
Chronologie
Bien que des composés contenant l'élément chimique azote fussent connus depuis l'Antiquité, (par exemple le salpêtre, c'est-à-dire les nitrates de sodium et de potassium), le diazote ne fut isolé par Daniel Rutherford qu'en 1772, et indépendamment par Carl Wilhelm Scheele et Henry Cavendish.
Le protoxyde d'azote N2O fut également préparé par Joseph Priestley en 1772.
L'ammoniac NH3 fut préparé en 1774, également par J. Priestley.
Le premier composé accepteur - donneur faisant intervenir l'azote, H3N.BF3 fut préparé en 1809 par Louis Joseph Gay-Lussac.
Le premier composé présentant une liaison azote - halogène, le trichlorure d'azote NCl3 fut préparé par Pierre Louis Dulong qui perdit un œil et trois doigts en étudiant les propriétés de ce corps très instable et violemment explosif.
Isotopes
L'azote possède 16 isotopes connus de nombre de masse variant de 10 à 25, ainsi qu'un isomère nucléaire, N. Deux d'entre eux sont stables et présents dans la nature, l'azote 14 (N) et l'azote 15 (N), le premier représentant la quasi-totalité de l'azote présent (99,** %). On assigne à l'azote une masse atomique standard de 14,0067 u. Tous les radioisotopes de l'azote ont une durée de vie courte, l'azote 13 (N) ayant la demi-vie la plus longue, 9,965 minutes, tous les autres ayant une demi-vie inférieure à 7,15 secondes, et la plupart d'entre eux inférieure à 625 ms.
Entités contenant l'élément chimique azote
L'élément chimique azote est présent dans des entités ne contenant que l'élément chimique N et dans les composés de l'azote, à différents degrés d'oxydation.
Entités ne contenant que l'élément chimique N
Il existe plusieurs entités chimiques ne contenant que l'élément chimique azote, la molécule de diazote, l'atome, et deux ions de l'azote.
Le diazote
Le diazote N2 est la forme la plus courante d'entité ne contenant que l'élément chimique azote. La triple liaison liant les deux atomes est une des liaisons chimiques les plus fortes (avec le monoxyde de carbone CO). De ce fait, le diazote est cinétiquement inerte. C'est le composant le plus abondant de l'atmosphère terrestre. Industriellement, le diazote est obtenu par distillation de l'air ambiant.
Sa réactivité principale est la formation d'ammoniac par le procédé Haber
-
N2 (g) + 3H2 (g) → 2NH3 (g)
L'atome
Il peut être obtenu en laboratoire à partir de diazote sous faible pression (0,1 - 2 mmHg) en présence d'une décharge électrique. À sa formation succède pendant plusieurs minutes une pale lueur jaune. Celle-ci résulte de la désexcitation de N2 suite à la recombinaison de deux atomes N. Cette forme excitée de diazote peut être mise en évidence en présence de CO2. Il se forme alors CO et de l'oxygène atomique dans un état triplet.
Les ions de l'azote
Il existe deux ions stables de l'azote :
l'ion nitrure N qui n'existe que dans les solides (nitrures métalliques) ou dans les complexes métalliques. l'ion azoture N3, forme basique de l'acide azothydrique HN3 ; Il peut former aussi bien des sels inorganiques comme l'azoture de sodium NaN3 que des composés organiques substitués tel la zidovudine dans lesquels il se comporte généralement comme un pseudohalogénure.
Composés de l'azote
L'azote forme des composés avec de nombreux autres éléments chimiques. Il est présent dans des composés organiques et inorganiques. L'azote est une des composantes de nombreux minerais et de l'air. L'azote est un gaz.
Azote et hydrogène
Le principal composé comportant une des liaisons chimique N-H est l'ammoniac NH3. D'autres composés contiennent également cette liaison :
les ions ammonium NH4 les ions amidure NH2 les amines primaires RNH2 et secondaires R2NH l'acide azothydrique HN3 l'hydrazine N2H4
et une grande famille de composés moins courants, les azanes et les azènes, comme le trans-diazène N2H2 et son isomère le 1,1-diazène, le triazène N3H3, le triazaneN3H5, etc.
Azote et oxygène
Les oxydes d'azote
Huit oxydes d'azote sont connus; Par nombre d'oxydation (moyen) croissant :
l'azoture de nitrosyle N4O découvert en 1993 le protoxyde de diazote N2O, communément appelé protoxyde d'azote le monoxyde d'azote NO le trioxyde de diazote N2O3 le dioxyde d'azote NO2 son dimère le tétraoxyde de diazote N2O4 pentaoxyde de diazote N2O5 le trioxyde d'azote NO3
Tous sont thermodynamiquement instables au regard de la décomposition en N2 et O2 à température ambiante.
Les oxoanions de l'azote
Les principaux oxoanions de l'azote, stables en milieu aqueux, sont les ions nitrate NO3 et nitrite NO2. L'ion nitrate est la base conjuguée d'un acide fort, l'acide nitrique. L'ion nitrite est la base conjuguée d'un acide faible, l'acide nitreux. Ce dernier n'est pas stable et, dans l'eau, il se dismute en monoxyde d'azote (qui se réoxyde en dioxyde d'azote en présence d'air) et en ion nitrate.
Azote et halogène
Le plus stable des halogènures d'azote, NF3 ne fut préparé qu'en 1928, plus d'un siècle après le très instable trichlorure NCl3. Le tribromure d'azote NBr3, très explosif, ne fut isolé qu'en 1975. Le triiodure NI3 n'a jamais été isolé, mais son adduit I3N.NH3, solide noir hautement instable au choc et à la température, a été préparé en 1812. Des combinaisons comme N2F2 et bien d'autres existent également.
Azote et métaux
De nombreux azotures métalliques existent. Plusieurs voies de synthèse sont possibles :
La réaction entre le métal et le diazote à chaud
-
3Ca + N2 → Ca3N2
La réaction entre le métal et l'ammoniac à haute température
-
3Mg + 2NH3 → Mg3N2 + 3H2
La décomposition d'amidures
-
3Zn(NH2)2 → Zn3N2 + 3NH3
Des réactions de transfert
-
Al2O2 + 3C + N2 → 2AlN + 3CO
-
2ZrCl4 + 4H2 + N2 → 2ZrN + 8HCl
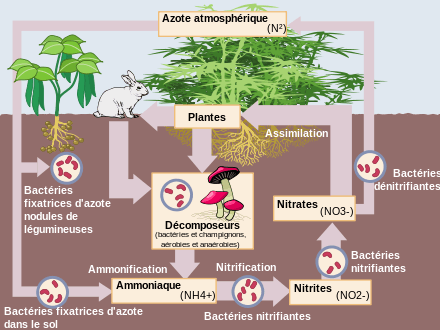
Le cycle de l'azote.
Un excédent d'azote (source d'eutrophisation de l'eau, des sols et des écosystèmes) est relevé partout en Europe (ici pour 2005), selon les données disponibles de la Commission européenne et de l'Agence européenne de l'environnement
Exploitation et usages
Diazote
Aujourd'hui, l'azote gazeux ou diazote est généralement obtenu par liquéfaction de l'air, dont il est le principal constituant avec une concentration de 78,06 % en volume et de 75,5 % en masse. La production mondiale est d'environ 150 millions de tonnes par an.
Le gaz diazote lui-même a en particulier les applications suivantes :
Emballage de denrées alimentaires (MAP): L'inertage des aliments emballés augmente leur durée de conservation en remplaçant l'air ambiant (contenant de l'oxygène) par de l'azote (pureté de 95 à 99,5 %)* gaz « neutre » utilisé pour protéger (grâce à la constitution d'une atmosphère inerte confinée) des produits, des objets ou des contenants (citernes par exemple) dans l'industrie, les musées ou autres lieux : protection contre la corrosion, des insectes, champignons…
En biologie, l'azote liquide est utilisé comme milieu pour la congélation des cellules et pour le broyage manuel des tissus lors de l'extraction de l'ADN ou des protéines.
Gaz utilisé comme pesticide doux pour éliminer par asphyxie les vers du bois ou certains organismes (ex : Petite vrillette) ayant colonisé des objets anciens fragiles (cadres, sculptures et objets de bois, incunables, les parchemins, gravures, etc.) ;
Gaz de gonflage de pneumatiques. Bien que l'air contienne déjà 78 % d'azote (de diazote pour être plus précis), certains professionnels de l'aviation ou de la formule 1, (par exemple), augmentent cette proportion et gonflent les pneumatiques avec de l'azote presque pur. Ce gaz ayant la propriété d'être inerte et stable conserve une pression plus constante même en cas d'échauffement intense du pneumatique. Une polémique existe d'ailleurs quant à l'introduction de cette méthode pour les véhicules particuliers. En effet, ceux-ci sont soumis à des contraintes bien moindres ce qui rend la différence avec l'air moins notable. Par contre le gonflage devient payant et on lui reproche souvent d'avoir un prix non justifié (le gonflage à l'air est souvent gratuit et jugé satisfaisant). Ceux qui l'utilisent devraient avoir, en principe, à rectifier le gonflage plus rarement, mais ils doivent néanmoins contrôler les pressions régulièrement.
Gaz utile pour gonfler les accumulateurs hydrauliques en raison de sa passivité vis-à-vis des huiles.
Construction mécanique: Beaucoup de machines de découpe modernes fonctionnent avec un rayon laser, celui-ci nécessite de l'azote comme gaz moteur ou comme gaz d'inertage.
Agent de lutte contre les incendies : allié à 50 % d'argon et parfois avec du dioxyde de carbone, il est présent dans certaines installations d'extinction automatique à gaz protégeant des salles informatiques ou des stockages particuliers ne devant pas être endommagés par de la poudre ou de l'eau. Conservé dans des bonbonnes métalliques sous une pression d'environ 200 bars, il est libéré dans un local où un début d'incendie a été détecté. Le volume de diazote injecté remplace une partie de l'atmosphère de la pièce et entraine une chute du taux d'oxygène dans l'air. Le niveau généralement retenu de 15 % de comburant interrompt le phénomène de combustion sans effet létal sur la respiration humaine.
Azote liquide : agent réfrigérant.
Métallurgie : l'azote est régulièrement injecté dans des fours de production de métaux hautement oxydables (p.ex. l'aluminium et ses alliages) pour en empêcher la réaction avec l'oxygène de l'air. Il est également utilisé pour éviter la corrosion lors de brasures (p.ex. brasure du cuivre).
Le diazote, contrairement aux gaz inhibiteurs chimiques halogénés et aux CFC ne présente a priori aucun effet nocif pour l'environnement (pas d'impact sur l'effet de serre, ni sur la couche d'ozone). Mais il requiert des réservoirs volumineux, des canalisations adaptées et des mesures constructives pour faire face à la détente brutale d'un équivalent de 40 à 50 % du volume protégé.
Danger du gaz diazote : l'utilisation de diazote pour créer des atmosphères confinées inertes est à l'origine de plusieurs morts par asphyxie, lorsqu'une personne pénètre sans s'en rendre compte dans une enceinte inertée ; il est nécessaire de vérifier la présence d'une proportion suffisante d'oxygène dans de tels espaces confinés avant d'y pénétrer, ou de s'équiper d'un appareil respiratoire autonome.
En plongée, l'azote contenu dans l'air respiré sous pression est à l'origine du phénomène de la narcose. La pression partielle d'azote devient en effet "toxique" pour l'organisme à partir de PpN2= 3,6 bars et la narcose est réelle à PpN2=4,6 Bars (soit une plongée à environ 50 m de profondeur). C'est aussi l'élément principal dictant la durée des paliers de décompression.
Usage des composés de l'azote
Paradoxalement, et malgré son nom, l'élément chimique « azote » est (avec le carbone, l'oxygène et l'hydrogène) un des composants principaux du Vivant et des écosystèmes ainsi que des agrosystèmes. Il entre dans la composition des protéines (pour environ 15 %). L'azote est présent dans de très nombreux produits chimiques, dont certains pesticides dits à (« urées substituées »).
L'azote a été exploité et l'est encore en tant qu'engrais naturel dans l'urée animale (ou humaine) et le guano (excréments secs d'oiseau ou de chauve-souris), notamment au Chili, au Pérou, en Inde, en Bolivie, en Espagne, en Italie et en Russie. Le nitre (nitrate naturel minéral) était autrefois récolté pour produire la poudre à canon.
Les balles de tennis de table sont fabriquées en celluloïd dont la composante majeure est la nitrocellulose.
Aujourd'hui, ses composés sont essentiellement produits industriellement par synthèse chimique pour de nombreux usages, dont par exemple :
fertilisants agricoles (engrais) ; les sels d'ammonium sont absorbés par les plantes, qui sont alors forcées d'absorber plus d'eau (équilibre osmotique). Ces sels forcent ainsi la plante à grossir. Si d'autres minéraux sont présents en suffisance (phosphore, potassium en particulier) cet azote dope la croissance des plantes cultivées. De l'azote est pour cette raison utilisé sous forme de nitrate d'ammonium, NH4NO3, de sulfate d'ammonium, (NH4)2SO4, de monophosphate d'ammonium, NH4H2PO4, ou d'urée, CO(NH2)2. C'est aujourd'hui le principal usage de l'azote dans le monde, qui est également responsable d'une pollution généralisée (eutrophisation, dystrophisation) de l'environnement (eaux de nappes, estuaires, certains littoraux, avec l'apparition de vaste zones mortes dans les océans jugées très préoccupantes par l'ONU).
produits pharmaceutiques : certains composés organiques nitrés, telle la nitroglycérine, sont utilisés pour soigner certaines affections cardiovasculaires ; le protoxyde d'azote (gaz hilarant) est utilisé comme anesthésiant ;
certains composés organiques nitrés, telle la nitroglycérine, sont utilisés pour soigner certaines affections cardiovasculaires ;
le protoxyde d'azote (gaz hilarant) est utilisé comme anesthésiant ;
l'ammoniac NH3, utilisé comme matière première de production de polymères, d'explosifs, d'engrais, ou comme fluide réfrigérant dans certains installations industrielles ;
combustibles (l'hydrazine et autres dérivés comme combustibles de fusée) ;
explosifs (composés chimiques organiques qui possèdent plusieurs groupes -ONO2 ou -NO2 : dynamite) ;
gaz propulseurs pour bombes aérosols (N2O) ou aérographes ;
conservateur (nitrite de sodium, NaNO2, sous le numéro E E250) ;
azoture de sodium, utilisé pour gonfler instantanément les coussins gonflables de sécurité (d'une automobile par exemple) en cas de choc.
Bilan azoté
La principale source d'azote alimentaire se retrouve dans les acides aminés. En effet les seuls organismes capables d'utiliser de l'azote atmosphérique sont les bactéries. Le bilan azoté est la seule manière connue de mesurer l'azote de manière non-invasive. En géologie par exemple, on irradie les cailloux pour quantifier la teneur en atome de certains éléments comme l'azote. Ceci n'est pas reproductible chez l'Homme pour des raisons éthiques.
Le bilan azoté est déduit en fonction des apports et des pertes en azote.
En pratique, le bilan azoté est estimé en fonction de l'excrétion urinaire d'urée selon deux formules :
la formule de Lee et Hartley
la formule de Mac Kenzie

 词典释义:
词典释义:
 固定(作用)
固定(作用)
 盐;
盐; 7号元素]
7号元素]

 型氮
型氮 液化
液化 氧化氮
氧化氮
