Le cuivre est un élément chimique de symbole Cu et de numéro atomique 29. Naturellement présent dans la croûte terrestre, il est essentiel au développement de toute forme de vie.
Il est majoritairement utilisé par l'homme sous forme de métal. Le cuivre pur est un des seuls métaux colorés (voir la section Propriétés physiques). Il présente sur ses surfaces fraîches une teinte rose saumon et est aussi appelé le « métal rouge ». On le désigne parfois sous le nom de cuivre rouge par opposition aux laitons (alliages de cuivre et de zinc) improprement nommés « cuivre jaune ». Métal ductile, il possède des conductivités électrique et thermique particulièrement élevées qui lui confèrent des usages variés. Il intervient également comme matériau de construction et entre dans la composition de nombreux alliages, les cupro-alliages.
Le cuivre est le plus ancien métal utilisé par l’homme. Les plus anciennes traces de fusion du cuivre dans des fours à vent ayant été découvertes dans le plateau iranien sur le site archéologique de Sialk III daté de la première moitié du V millénaire av. J.-C. — il y a donc près de sept mille ans. Allié à l’étain, il donna lieu à une révolution technologique, « l'âge du bronze », aux alentours de 2 300 ans avant notre ère.
L’histoire méditerranéenne du cuivre est intimement liée à l'île de Chypre : c’est en effet sur cette île que furent exploitées les premières mines de cuivre natif, qui permirent aux civilisations minoenne, mycénienne et phénicienne de prospérer. Elles organisèrent le commerce du métal rouge en Méditerranée, si bien que les Romains l’appelèrent aes cyprium (littéralement « métal de Chypre »), issu du grec ancien Κύπρος désignant l'île elle-même. Le terme s’est transformé au fil du temps pour devenir « cuivre ».
Caractéristiques
Métal de couleur rougeâtre ou rouge, le cuivre possède une exceptionnelle conductivité thermique et électrique. Le métal très pur est très résistant à la corrosion, mais aussi très malléable.
L'ion cuivrique Cu est soluble dans l'eau, et à faible concentration, il a un effet bactériostatique et fongicide. Dans certaines applications, cette propriété sert à prévenir le développement des germes et champignons (canalisations d'eau sanitaire, culture de la vigne, coques de bateaux et boiseries...).
Il est par ailleurs un oligo-élément vital pour toutes les plantes supérieures et les animaux. Il est naturellement présent dans le corps humain et indispensable au bon fonctionnement de nombreuses fonctions physiologiques : système nerveux et cardiovasculaire, absorption du fer, croissance osseuse, bonne marche des fonctions immunitaires et régulation du cholestérol.
Identification Dureté (Mohs) : 3,5-4,5 Densité : 8,93 Clivage : absent Fracture : écailleuse Rupture : ductile (peu d'impuretés ou impuretés insolubles) ou cassante (impuretés solubles comme le phosphore) Couleur : rouge métallisé Éclat : métallique Système cristallin : cubique Classe cristalline et groupe d'espace : hexakisoctaédrique - m3m Réseau de Bravais : cubique à face centrée macle : macle très fréquente sur {111} par accolement ou pénétration Solubilité : acide nitrique, ammoniaque
Dureté (Mohs) : 3,5-4,5
Densité : 8,93
Clivage : absent
Fracture : écailleuse
Rupture : ductile (peu d'impuretés ou impuretés insolubles) ou cassante (impuretés solubles comme le phosphore)
Couleur : rouge métallisé
Éclat : métallique
Système cristallin : cubique
Classe cristalline et groupe d'espace : hexakisoctaédrique - m3m
Réseau de Bravais : cubique à face centrée
macle : macle très fréquente sur {111} par accolement ou pénétration
Solubilité : acide nitrique, ammoniaque
Propriétés optiques Transparence : opaque Éclat : métallique Trait : rouge métallisé, rouge pâle Fluorescence : aucune
Transparence : opaque
Éclat : métallique
Trait : rouge métallisé, rouge pâle
Fluorescence : aucune
Propriétés physiques
Sur la photo ci-dessus, le cuivre, juste au-dessus de son point de fusion, conserve sa couleur rose éclatante lorsqu’une lumière suffisante éclipse la couleur orange due à l’incandescence.

Barres de distribution électriques en cuivre fournissant l’énergie à un grand bâtiment.
Dans le tableau périodique des éléments, le cuivre est de la même famille que l’argent et l’or, parce que chacun possède une orbitale s occupée par un seul électron sur des sous-couches totalement remplies, ce qui permet la formation de liaisons métalliques (configuration électronique [Ar] 3d 4s). Comme l’argent et l’or, le cuivre se travaille facilement, étant ductile et malléable. La facilité avec laquelle on peut lui donner la forme de fils, ainsi que son excellente conductivité électrique le rendent très utile en électricité. On trouve usuellement le cuivre, comme la plupart des métaux à usage industriel ou commercial, sous une forme polycristalline à grains fins. Les métaux polycristallins présentent une meilleure solidité que ceux sous forme monocristalline, et plus les grains sont petits, et plus cette différence est importante.
Le cuivre présente une couleur rougeâtre, orangée ou brune due à une couche mince en surface (incluant les oxydes). Le cuivre pur est de couleur rose saumon. Le cuivre, l’osmium (bleu) et l’or (jaune) sont les trois seuls métaux purs présentant une couleur autre que le gris ou l’argent. La couleur caractéristique du cuivre résulte de sa structure électronique : le cuivre constitue une exception à la loi de Madelung, n’ayant qu’un électron dans la sous-couche 4s au lieu de deux. L’énergie d’un photon de lumière bleue ou violette est suffisante pour qu’un électron de la couche d l’absorbe et effectue une transition vers la couche s qui n’est qu’à-demi occupée. Ainsi, la lumière réfléchie par le cuivre ne comporte pas certaines longueurs d’ondes bleue / violette et apparaît rouge. Ce phénomène est également présent pour l’or, qui présente une structure correspondante 5s/4d. Le cuivre liquide apparaît verdâtre, une caractéristique qu’il partage avec l’or lorsque la luminosité est faible.
Propriétés électriques
La similitude de leur structure électronique fait que le cuivre, l’argent et l’or sont analogues sur de nombreux points : tous les trois ont une conductivité thermique et électrique élevée, et tous trois sont malléables. Parmi les métaux purs et à température ambiante, le cuivre présente la seconde conductivité la plus élevée (59,6×10 S/m)), juste après l’argent. Cette valeur élevée s’explique par le fait que, virtuellement, tous les électrons de valence (un par atome) prennent part à la conduction. Les électrons libres en résultant donnent au cuivre une densité de charges énorme de 13,6×10 C/m. Cette forte densité de charges est responsable de la faible vitesse de glissement des courants dans un câble de cuivre (la vitesse de glissement se calcule comme étant le rapport de la densité de courant à la densité de charges). Par exemple, pour une densité de courant de 5×10 A·m (qui est normalement la densité de courant maximum présente dans les circuits domestiques et les réseaux de transport), la vitesse de glissement est juste un peu supérieure à 1/3 mm/s.
Propriétés chimiques
Le cuivre ne réagit pas avec l’eau, mais réagit lentement avec l’oxygène de l’air en formant une couche d’oxyde de cuivre brun-noir. Contrairement à l’oxydation du fer par une atmosphère humide, cette couche d’oxyde empêche toute corrosion en masse. Une couche verte de carbonate de cuivre, appelée vert-de-gris, se remarque souvent sur les constructions anciennes en cuivre, telles que la statue de la Liberté. La toxicité alimentaire des oxydes formés a justifié l'étamage (ajout d'une couche protectrice d'étain) traditionnel des instruments et récipients culinaire en cuivre.
Le cuivre réagit avec le sulfure d’hydrogène — et toutes les solutions contenant des sulfures, formant divers sulfures de cuivre à sa surface. Dans des solutions contenant des sulfures, le cuivre, présentant un avilissement de potentiel par rapport à l’hydrogène, se corrodera. On peut observer ceci dans la vie de tous les jours, où les surfaces des objets en cuivre se ternissent après exposition à l’air contenant des sulfures.
Le cuivre se dissout lentement dans les solutions aqueuses d’ammoniaque contenant de l’oxygène, parce que l’ammoniac forme avec le cuivre des composés hydrosolubles. Le cuivre réagit en présence d’une association d’oxygène et d’acide chlorhydrique pour former toute une série de chlorures de cuivre. Le chlorure de cuivre(II) bleu/vert, lorsqu’il est porté à ébullition en présence de cuivre métallique, subit une réaction de rétrodismutation produisant un chlorure de cuivre(I) blanc.
Le cuivre réagit avec une solution acide de peroxyde d'hydrogène qui produit le sel correspondant :
Cu + 2 HCl + H2O2 → CuCl2 + 2 H2O.
Lorsque le cuivre est en contact avec des métaux présentant un potentiel électrochimique différent (par exemple le fer), en particulier en présence d’humidité, la fermeture d’un circuit électrique fera que la jonction se comportera comme une pile électrochimique. Dans le cas par exemple d'une canalisation en cuivre raccordée à une canalisation en fer, la réaction électrochimique entraîne la transformation du fer en d’autres composés et peut éventuellement endommager le raccord.
Au cours du XX siècle aux États-Unis, la popularité temporaire de l’aluminium pour les câblages électriques domestiques a fait que les circuits de nombre d’habitations se composaient en partie de fils de cuivre et en partie de fils d’aluminium. Le contact entre les deux métaux a occasionné des problèmes pour les usagers et les constructeurs (cf. article consacré aux câbles d’aluminium).
Les fondeurs ne placent jamais à proximité les stocks d'aluminium et de cuivre. Même s'il existe des alliages cupro-aluminium spécifiques, les traces d'aluminium dans un alliage cuivreux provoquent de graves inconvénients techniques. Connaissant par contre les propriétés du cuivre pur, les hommes de l'art ont développé des cuivres alliés, par exemple des cuivres à environ 1 % de Chrome, le Cr permettant de durcir le métal obtenu.
Gîtologie
On trouve le cuivre natif sous forme minérale (par exemple, dans la péninsule de Keweenaw, Michigan). Il est sous forme polycristalline, les plus grands monocristaux mesurant 4,4×3,2×3,2 cm. Les minéraux tels que ses sulfures : chalcopyrite (CuFeS2), bornite (Cu5FeS4), covelline (CuS), chalcosine (Cu2S) sont des sources de cuivre, de même que ses carbonates : azurite (Cu3(CO3)2(OH)2) et malachite (Cu2CO3(OH)2) et un de ses oxydes : cuprite (Cu2O).
Dans des zones poreuses des basaltes : les réactions entre solution hydrothermale et minerais ferrifères génèrent le cuivre des principaux gisements de ce minéral. Dans la presqu'île de Keenawa, les couches de basalte alternent avec des grès et des conglomérats, les cavités sont emplies par le cuivre associé à la calcite, l'épidote, des minéraux cuprifères, des zéolites, un peu d'argent ; d'importantes masses de cuivre (jusqu'à 500 000 kg) y ont été rencontrées.
Dans des grès et des schistes, où le cuivre était probablement d'origine hydrothermale.
Présent dans les météorites.
Dosage du cuivre
La quantité de cuivre dans différents milieux est quantifiable par différentes méthodes analytiques. Pour dissocier le cuivre de la matrice de son milieu, il faut, la plupart du temps, effectuer une digestion à l’aide d’un acide (en général l’acide nitrique et/ou l’acide chlorhydrique). Le centre d’expertise en analyse environnementale du Québec utilise des techniques couplées soient l’ICP-MS pour les analyses dans la chair de poissons et des petits invertébrés et l’ICP-OES pour les analyses dans l’eau qui doit préalablement être acidifiée.
Isotopes
Le cuivre possède 29 isotopes connus, de nombre de masse variant de 52 à 80, ainsi que sept isomères nucléaires. Parmi ces isotopes, deux sont stables, Cu and Cu, et constituent l'ensemble du cuivre naturel dans une proportion d'environ 70/30. Ils possèdent tous les deux un spin nucléaire de 3/2. La masse atomique standard du cuivre est de 63,546(3) u.
Les 27 autres isotopes sont radioactifs et ne sont produits qu’artificiellement. Le plus stable des radioisotopes d'entre eux est Cu avec une demi-vie de 61,83 heure. Le moins stable est Cu avec une demi-vie d'environ 75 ns. La plupart des autres ont une demi-vie inférieure à une minute.
Composés du cuivre
Les composés du cuivre se présentent sous plusieurs états d'oxydation, généralement +2, par lesquels ils confèrent une couleur bleue ou verte due aux minéraux qu'ils constituent, comme la turquoise. Cette propriété des sels de cuivre Cu fait qu'ils ont été largement utilisés à travers l'histoire dans la fabrication des pigments. Les éléments architecturaux et les statues en cuivre se corrodent et acquièrent une patine verte caractéristique. Le cuivre se retrouve de manière significative dans les arts décoratifs, à la fois sous forme métallique et sous forme de sels colorés.

Cristaux de cuivre natif de 12 × 8,5 cm

Poudre d’oxyde de cuivre(I)
Les composés de cuivre présentent quatre états d’oxydation :
le cuivre(I), souvent nommé cuivreux
le cuivre(II), souvent nommé cuivrique
le cuivre(III)
le cuivre(IV)
Les deux premiers sont les plus fréquents.
Cuivre(I)
Le cuivre(I) est la principale forme que l’on rencontre dans ses gîtes. Les halogénures cuivreux sont bien connus, sauf le fluorure : CuCl, CuBr, CuI. On détecte souvent les sucres grâce à la capacité de ces derniers à convertir les composés de cuivre(II) bleus en composés d’oxyde de cuivre(I) (Cu2O), tel que le réactif de Benedict. Ce sont généralement des composés toxiques.
Cuivre(II)
Le cuivre(II) se rencontre très couramment dans notre vie de tous les jours. Le carbonate de cuivre(II) constitue le dépôt vert qui donne leur aspect spécifique aux toits ou coupoles recouverts de cuivre des bâtiments anciens. Le sulfate de cuivre (II) est constitué d’un pentahydrate bleu cristallin qui est peut-être le composé de cuivre le plus commun au laboratoire. Il est blanc sous sa forme anhydre et bleu sous sa forme hydratée, il peut ainsi servir de test à la présence d'eau. On s’en sert aussi de fongicide, sous le nom de bouillie bordelaise. En lui ajoutant une solution aqueuse d’hydroxyde de sodium, on obtient la précipitation d’hydroxyde de cuivre(II), bleu, solide. L’équation simplifiée de la réaction est :
-
Cu + 2 HO → Cu(OH)2.
Une équation plus complexe montre que la réaction fait intervenir deux ions hydroxyde avec déprotonation du composé de cuivre (II) 6-hydraté :
-
Cu(H2O)6 + 2 HO → Cu(H2O)4(OH)2 + 2 H2O.
Une solution aqueuse d’hydroxyde d'ammonium (NH4 + HO) provoque la formation du même précipité. Lorsqu’on ajoute un excès de cette solution, le précipité se redissout, formant un composé d’ammoniaque bleu foncé, le cuivre (II) tétraamine:
-
Cu(H2O)4(OH)2 + 4 NH3 → Cu(H2O)2(NH3)4 + 2 H2O + 2 HO.
Ce composé était jadis important dans le traitement de la cellulose. D’autres composés bien connus de cuivre(II) comprennent l’acétate de cuivre(II), le carbonate de cuivre(II), le chlorure de cuivre(II), le nitrate de cuivre(II) et l’oxyde de cuivre(II). Il existe de nombreuses méthodes de détection des ions cuivre, l’une faisant intervenir le ferrocyanure de potassium, qui donne un précipité brun et des sels de cuivre.
Cuivre(III)
Un composé représentatif du cuivre(III) est le CuF6. Les composés de cuivre(III) sont peu courants mais sont impliqués dans une grande variété de réactions en biochimie non organique et en catalyse homogène. Les cuprates supraconducteurs contiennent du cuivre(III), tel que YBa2Cu3O7-δ.
Cuivre(IV)
Les composés de cuivre(IV), tels que les sels de CuF6, sont très rares.
Historique
Âge du cuivre
Le cuivre est, avec l'or, le premier métal à avoir été utilisé par l'Homme parce qu'il fait partie des rares métaux qui se trouvent naturellement en tant que minéral pur, sous une forme native. En Europe occidentale, on situe l'âge du cuivre ou Chalcolithique, entre 3 200 et 2 000 environ av. J.-C., suivant les régions (Italie, Suisse, Alpes, Cévennes, Espagne et Portugal). Cette période technologique est bien plus ancienne à l'est de la Méditerranée. Des objets en cuivre datant de 8 700 av. J.-C. ont été retrouvés au Moyen-Orient. C'est le cas d'un pendentif en cuivre retrouvé au nord de l’actuel Irak.
Il est probable que l’or et le fer météorique étaient les seuls métaux utilisés par l’homme avant la découverte du cuivre. On a retrouvé des traces de fusion du cuivre, dues au raffinage de celui-ci à partir de composés simples comme l’azurite et la malachite, datant d'environ 5 000 avant notre ère. Parmi les sites archéologiques d’Anatolie, Çatal Höyük (~6 000 av. J.-C.) recèle des artefacts en cuivre et des couches de plomb fondu, mais pas de cuivre fondu. Le plus ancien artefact en cuivre fondu découvert (un ciseau en cuivre du site chalcolithique de Prokuplje, en Serbie) date de 5 500 av. J.-C. Un peu plus tard, le peuple de Can Hasan (~5 000 av. J.-C.) a laissé des traces de l'utilisation de cuivre fondu. Les sites métallurgiques des Balkans semblent avoir été plus avancés que ceux d’Anatolie. Il est donc assez probable que la technique de fusion du cuivre prenne son origine dans les Balkans. On utilisait par ailleurs le moulage à la cire perdue vers 4 500 à 4 000 av. J.-C. en Asie du Sud-Est. Quant aux débuts de l'exploitation minière, des sites miniers d'Alderley Edge dans le Cheshire, Royaume-Uni, ont été datés au carbone 14 et remonteraient à 2 280 et 1 890 av. J.-C.
Cette pièce en cuivre corrodée provenant de Zakros, Crète, a la forme d’une peau d’animal, typique de cette époque.
La métallurgie du cuivre semble s’être développée indépendamment dans plusieurs parties du monde. En plus de son développement dans les Balkans vers 5 500 av. J.-C., elle s’était développée en Chine avant 2 800 av. J.-C., dans la Andes autour de 2 000 av. J.-C., en Amérique centrale vers l’an 600 et en Afrique occidentale vers l’an 900 avant notre ère. On le trouve de manière systématique dans la civilisation de la vallée de l’Indus pendant le III millénaire avant notre ère. En Europe, Ötzi, une momie masculine bien conservée datant de la période 3 300–3 200 av. J.-C., a été retrouvée accompagnée d’un fer de hache en cuivre pur à 99,7 %. Des concentrations élevées d’arsenic trouvées dans sa chevelure font penser qu’il travaillait à la fusion du cuivre. Au fil des siècles, l’expérience acquise en métallurgie du cuivre a aidé au développement de celle des autres métaux ; par exemple, la connaissance des techniques de fusion du cuivre a conduit à la découverte des techniques de fusion du fer.
Sur le continent américain, la production dans le "Old Copper Complex", situé dans le Michigan et le Wisconsin actuels, date d’environ 6 000 à 3 000 av. J.-C.. Certains ouvrages affirment que les anciennes civilisations américaines, telles que les Mound Builders connaissaient une méthode de trempe du cuivre qui n’a toujours pas été redécouverte. Selon l’historien Gerard Fowke, il n’existe aucune preuve d’un tel « savoir-faire perdu » et la meilleure technique connue pour durcir le cuivre à cette époque était le battage.
Âge du bronze

En Alchimie, le symbole du cuivre, peut-être un miroir stylisé, était également le symbole de la déesse et de la planète Vénus

Mine de cuivre au chalcolithique, vallée de Timna, désert du Néguev, Israël
Le fait d’allier du cuivre avec du zinc ou de l’étain, pour obtenir du laiton ou du bronze se pratiqua 2 300 ans après la découverte du cuivre lui-même. Les artefacts de cuivre et de bronze provenant des cités sumériennes datent de 3 000 av. J.-C., et les objets égyptiens en cuivre et en alliage cuivre-étain sont à peu près aussi anciens. L’utilisation du bronze s’est tellement propagée en Europe autour de 2 500 à 600 av. J.-C. que cette période a été nommée âge du bronze. La période de transition, dans certaines régions, entre la période précédente (Néolithique) et l’âge du bronze a été nommée « chalcolithique » (« pierre-cuivre »), certains outils en cuivre très pur étant utilisés en même temps que les outils de pierre. Le laiton (alliage cuivre-zinc) était aussi connu des Grecs, mais ne vint compléter le bronze de manière significative que sous l’Empire romain.
Antiquité et Moyen Âge
En Grèce, le nom donné à ce métal était chalkos (χαλκός). Le cuivre constituait, pour les romains, les Grecs et d’autres peuples de l’Antiquité une ressource importante. À l’époque romaine, il était connu sous le nom d’aes Cyprium (aes étant le terme latin générique désignant les alliages de cuivre tels que le bronze et les autres métaux, et Cyprium parce que la plus grande partie venait de Chypre). Ensuite, on simplifia ce terme en cuprum, d’où le nom anglais copper. Dans la mythologie et l’alchimie, le cuivre était associé avec la déesse Aphrodite (Vénus), du fait de son éclat brillant, de son utilisation ancienne pour la production de miroirs, et de son association avec Chypre, île consacrée à la déesse. En astrologie et en alchimie, les sept corps célestes connus des anciens étaient associés à sept métaux également connus dans l’Antiquité, et Vénus était associée au cuivre.
Le premier usage connu du laiton, en Grande-Bretagne, date du IIIau II siècle av. J.-C.. En Amérique du Nord, l’extraction du cuivre commença avec une métallurgie marginale pratiquée chez les Amérindiens. On sait que le cuivre natif était extrait de sites sur l’Isle Royale à l’aide d’outils primitifs en pierre entre 800 et 1 600.
L’industrie du cuivre était florissante en Amérique du Sud, en particulier au Pérou, vers le début du premier millénaire de notre ère. La technologie du cuivre a progressé plus lentement sur d’autres continents. Les réserves de cuivre les plus importantes en Afrique sont situées en Zambie. Des ornements funéraires en cuivre datant du XV siècle ont été découverts, mais la production commerciale de ce métal n’a pas commencé avant le début du XX siècle. Il existe des artefacts australiens en cuivre, mais ils n’apparaissent qu’après l’arrivée des Européens ; la culture aborigène ne semble pas avoir développé sa métallurgie.
Vital pour le monde métallurgique et technologique, le cuivre a également joué un rôle culturel important, en particulier dans la monnaie. Les Romains, entre le VI et le III siècle av. J.-C. se servaient de morceaux de cuivre comme monnaie. Au début, on ne prenait en compte que la valeur du cuivre lui-même, mais progressivement, la forme et l’apparence de la monnaie de cuivre devinrent prépondérants. Jules César avait sa propre monnaie, faite d’un alliage cuivre - zinc, alors que les monnaies d’Octave étaient réalisées en alliage Cu-Pb-Sn. Avec une production annuelle estimée d’environ 15 000 tonnes, les activités romaines en termes d’extraction et de métallurgie du cuivre avaient atteint une échelle qui n’a été dépassée qu’à l’époque de la révolution industrielle ; les provinces dans lesquelles l’activité minière était la plus importante étaient l’Hispanie, Chypre et l’Europe centrale.
Les portes du Temple de Jérusalem étaient en bronze corinthien, obtenu par dorure par appauvrissement. Le bronze corinthien était prisé à Alexandrie, où certains pensent que l’alchimie a pris naissance. Dans l’Inde ancienne (avant 1 000 av. J.-C.), le cuivre était utilisé en médecine holistique ayurvédique pour la fabrication d’instruments chirurgicaux et autres équipements médicaux. Les anciens Égyptiens (~2 400 av. J.-C.) se servaient du cuivre pour stériliser les blessures et l’eau de boisson, puis plus tard, (~1 500 av. J.-C.) pour soigner les maux de tête, les brûlures, et le prurit. Hippocrate (~400 av. J.-C.) se servait du cuivre pour soigner les ulcères variqueux des jambes. Les anciens Aztèques combattaient les atteintes à la gorge par gargarisme composé de divers mélanges à base de cuivre.
Le cuivre est également présent dans certaines légendes et histoires, telle que celle de la « pile de Bagdad ». Des cylindres de cuivre, soudés au plomb, datant de 248 av. J.-C. à 226 ap. J.-C., ressemblent à des éléments de pile, conduisant certaines personnes à penser qu’il s’agissait peut-être de la première pile. Cette affirmation n’a, à l’heure actuelle, pas été confirmée.
La Bible fait également allusion à l’importance du cuivre : « Il existe, pour l’argent, des mines, pour l’or, des lieux où on l’épure. Le fer est tiré du sol, la pierre fondue livre du cuivre. » (Job 28:1–2) [NdT : traduction de la Bible de Jérusalem].
Époque moderne
La grande montagne de cuivre de ***** était une mine située en Suède, qui a fonctionné pendant un millénaire, du X siècle à 1992. Au XVII siècle, elle produisait environ les deux tiers des besoins européens et permit, à cette époque, de financer une partie des guerres menées par la Suède. Le cuivre était considéré comme trésor national ; la Suède possédait une monnaie (papier) garantie par du cuivre.
Tout au long de l’histoire, l’utilisation du cuivre dans le domaine de l’art s’étendit bien au-delà de la monnaie. Il a été utilisé par les sculpteurs de la Renaissance, dans la technique pré-photographique connue sous le nom de daguerréotype, et pour la statue de la Liberté. Le placage et le doublage en cuivre des coques de navires étaient largement répandus. Les navires de Christophe Colomb furent parmi les premiers à bénéficier de cette protection. La Norddeutsche Affinerie de Hambourg fut la première usine galvanoplastique, dont la production a commencé en 1876. Le scientifique allemand Gottfried Osann inventa la métallurgie des poudres et l’appliqua au cuivre en 1830 en déterminant le poids atomique de ce métal. Par ailleurs, on découvrit également que le type et la quantité de métal d’alliage (e.g. étain) affectait la sonorité des cloches, ce qui a entraîné la fonderie de cloches. La fusion éclair a été développée par Outokumpu en Finlande et fut appliquée pour la première fois à l’usine de Harjavalta en 1949. Ce processus économe en énergie fournit 50 % de la production mondiale de cuivre brut.
Dans le monde sociologique et économique, le cuivre s’est avéré un élément crucial, du fait essentiellement des conflits impliquant des mines de cuivre. La grève de Cananea de 1906 à Mexico porta sur les problèmes d’une organisation mondiale. La mine de cuivre de Teniente (1904–1951) mit en lumière les problèmes politiques liés au capitalisme et à la structure de classes. La plus grosse mine de cuivre du Japon, la mine d’Ashio, fut le théâtre d’une émeute en 1907. La grève des mineurs de l’Arizona en 1938 fut déclenchée par les problèmes liés au travail des américains, notamment le droit de grève.
Au XXI siècle
Au XXI siècle, le cuivre est utilisé dans différentes industries, entre autres pour le câble électrique, les tuyaux de plomberie et les supraconducteurs.
Symbolique
Les noces de cuivre symbolisent les 32 ans de mariage dans le folklore français.
Traditionnellement, le cuivre est associé à la planète Vénus. Les alchimistes utilisaient le symbole ♀ pour le représenter. C'est donc un métal associé à la féminité, la jeunesse et l'amour. Des miroirs anciens, symbole de narcissisme, étaient faits de cuivre.
Calendrier républicain
Dans le calendrier républicain, le Cuivre était le nom attribué au 24 jour du mois de nivôse.
Régionalisme
Au Québec, un terme couramment utilisé pour déterminer le cuivre est coppe. Le passé industriel de cette province du Canada a amené les travailleurs d'usine à s'approprier certains termes industriels. Richard Desjardins, chansonnier québécois, y fait référence dans la chanson Et j'ai couché dans mon char. Il souligne alors, les variations du prix du cuivre dans les années 1970-1980 en Amérique du Nord : la gang est splittée, c'était rien qu'un époque. Sa valeur est tombée, comme le prix de la coppe.
Dans le monde hispanique et surtout en Amérique du Sud, on utilise l'expression « sin un cobre » (littéralement « sans le cuivre »), se traduisant chez nous « sans le sou » ou sans argent. L'usage de l'expression se trouve dans certaines monnaies de peu de valeur qui étaient fabriquées en cuivre.
Minerai de cuivre
Mine de cuivre à ciel ouvert, Chino Copper Mine, Nouveau-Mexique, États-Unis
Le cuivre est un des rares métaux qui existent à l'état natif. Ce fait d'ailleurs expliquant probablement qu'il fut le premier métal utilisé par les hommes. L'occurrence du cuivre natif est cependant assez faible. On le trouve le plus fréquemment sous forme de sulfure ou de sulfo-sel. On le trouvait en quantités importantes dans l'île de Chypre surnommée l'île aux mille mines.
Sulfures
La chalcopyrite : CuFeS2 : (Cu2S, Fe2S3)
La bornite : Cu5FeS4 : (5Cu2S, Fe2S3)
La covelline: CuS
La chalcocite : Cu2S
Sulfo-sel
L’énargite : Cu3AsS4 : (3Cu2S, As2S5)
Oxydes
Le cuivre s'oxyde :
ion cuivreux Cu, ou ion Cu(I) : Cuprite Cu2O ;
Cuprite Cu2O ;
ion cuivrique Cu, ou ion Cu(II) : Tenorite CuO.
Tenorite CuO.
Les potentiels standards des principales demi-réactions sont :
-
Cu2O(s) + H2O + 2 e ⇄ 2 Cu(s) + 2 OH ;
-
| Cu + e ⇄ Cu |
E = +0,159 V ; |
| Cu + 2 e ⇄ Cu (s) |
E = +0,340 V ; |
| Cu + e ⇄ Cu (s) |
E = +0,522 V. |
Carbonates
Azurite : Cu3(CO3)2(OH)2 : (2CuCO3, Cu(OH) 2)
Malachite : Cu2(CO3)(OH)2 : (CuCO3, Cu(OH) 2)
Silicates
Chrysocolle: (Cu, Al)2H2(Si2O5)(OH)4* n(H2O)
Sulfate et chlorure
Brochantite : Cu4(SO4)(OH) 6
Atacamite : Cu2Cl(OH) 3
Production du cuivre
Extraction du minerai
Chuquicamata est la plus grande mine de cuivre à ciel ouvert au monde
.svg.png)
Production de cuivre en 2005
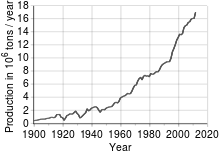
Tendance de la production mondiale
L’essentiel du minerai de cuivre est extrait sous forme de sulfure, dans de grandes mines à ciel ouvert, des filons de porphyre cuprifère qui ont une teneur en cuivre de 0,4 à 1,0 %. Exemples : Chuquicamata, au Chili ; Bingham Canyon Mine, dans l’Utah et El Chino Mine au Nouveau-Mexique (États-Unis). La teneur moyenne en cuivre des roches de la croûte terrestre est d’environ 68 ppm en masse, et 22 ppm en termes d’atomes. En 2005, le Chili était le premier producteur mondial de cuivre avec au moins un tiers de la production mondiale, suivi par les États-Unis, l’Indonésie et le Pérou, d’après le British Geological Survey.
Les principaux pays producteurs sont le Chili, avec quatre des cinq plus importantes mines du cuivre du monde, les États-Unis, le Pérou, l'Australie, la Russie, l'Indonésie, le Canada, la Zambie et la Pologne. Les gisements remarquables pour le cuivre natif sont :
Bolivie : Coro-Coro, Province de Pacajes, Département de La Paz.
Canada : Mine Normandie, Saint-Joseph-de-Coleraine, Les Appalaches RCM, Chaudière-Appalaches, Québec
États-Unis : Presqu'île de Keenawa, et Lac –Supérieur, Comté de Keweenaw, Michigan
France : Les Clausis, Saint-Véran, Hautes-Alpes Pélites Permiennes du Dôme de Barrot, Alpes-Maritimes Chessy, Rhône Saint-Jean-de-Jeannes, Mont Roc, et le Burc, Tarn
Les Clausis, Saint-Véran, Hautes-Alpes
Pélites Permiennes du Dôme de Barrot, Alpes-Maritimes
Chessy, Rhône
Saint-Jean-de-Jeannes, Mont Roc, et le Burc, Tarn
Pologne : Bassin de Lubin (Basse-Silésie)
On a utilisé le cuivre depuis au moins 10 000 ans, mais plus de 95 % de tout le cuivre jamais extrait et fondu l’a été depuis 1900. Comme pour nombre de ressources naturelles, la quantité totale de cuivre sur terre est importante (environ 10 tonnes dans le premier kilomètre de la croûte terrestre, correspondant à environ 5 millions d’années de réserves au taux d’extraction actuel). Toutefois, seule une petite partie de ces réserves est économiquement viable, étant donnés les prix et les technologies actuelles. Diverses estimations des réserves de cuivre disponibles pour l’extraction vont de 25 à 60 ans, en fonction des hypothèses de départ, telles que la demande en cuivre.
Dans le monde moderne, le recyclage est une des principales sources de cuivre. De ce fait, ainsi que du fait d’autres facteurs, l’avenir de la production et de la fourniture en cuivre est l’objet de nombreux débats, incluant le concept de pic du cuivre, analogue à celui de pic pétrolier.
Le cours du cuivre, une des mesures de la disponibilité en approvisionnement en cuivre par rapport à la demande mondiale, a quintuplé au cours des 60 dernières années ; faible en 1999, passant de 0,60 US$ par livre (US$ 1,32/kg) en juin 1999 à US$ 3,75 par livre (US$ 8,27/kg) en mai 2006, et chutant à partir de cette date à US$ 2,40 par livre (US$ 5,29/kg) en février 2007 ; il est ensuite remonté à US$ 3,50 par livre (US$ 7,71/kg = 3,89 £ = 5 €) en avril 2007. Au début de février 2009, cependant, l’affaiblissement de la demande mondiale et une chute brutale du cours des matières premières depuis les valeurs élevées de l’année précédente ramenèrent le cours du cuivre à US$ 1,51 par livre.
Le Conseil intergouvernemental des pays exportateurs de cuivre (CIPEC), disparu depuis 1992, a tenté jadis de jouer le même rôle que celui de l’OPEP pour le pétrole, mais il n’a jamais exercé la même influence, en particulier parce que le second plus gros producteur, les États-Unis, n’en ont jamais fait partie. Créé en 1967, ses principaux membres étaient le Chili, le Pérou, le Zaïre et la Zambie.
Utilisations
Les propriétés du cuivre (haute conductivité électrique et thermique, résistance à la corrosion, recyclabilité) font de ce métal une ressource naturelle très utilisée. Dans l'électricité, l'électronique, les télécommunications (réseaux câblés, microprocesseurs, batteries), dans la construction (tuyauterie d'eau, couverture), dans l'architecture, les transports (composants électro-mécaniques, refroidisseurs d'huile, réservoirs, hélices), les machines-outils, des produits d'équipement (plateformes pétrolières) et de consommation (ustensiles de cuisine) mais aussi des pièces de monnaie comme l'euro.
La pièce de 1 euro (l'Arbre étoilé dessiné par Joaquin Jimenez pour les euros frappés en France) est constituée d'un centre « blanc » en cupronickel (75 % Cu 25 % Ni) sur âme de nickel et d'une couronne « jaune » en maillechort (75 % Cu 20 % Zn 5 % Ni). Les alliages (centre et couronne) sont inversés pour la pièce de 2 euros.
Métallurgie et affinage

Cuivre, métal pur à 99,95 %
Le cuivre devient pâteux vers 830 °C et fond autour de 1 100 °C (voir température de fusion : 1 084,45 °C).
L'affinage industriel du cuivre s'effectue par électrolyse d'anodes de cuivre brut dans une solution de sulfate de cuivre. Les ions cuivre migrent vers la cathode et les impuretés restent dans le bain. Ce procédé permet d'obtenir du métal pur à 99,95 %.
Recyclage
Le cuivre se prête particulièrement bien au recyclage. Contrairement à de nombreuses autres matières premières, il est recyclable à l'infini, sans altération ni perte de performances. Le processus de recyclage permet une économie d’énergie jusqu’à 85 % par rapport à la production de cuivre primaire. D'autre part le recyclage émet moins de gaz à effet de serre. « La seule production de cathodes à partir de cuivre recyclé permet d’économiser près de 700 000 tonnes de CO2 chaque année ».
En 2008, 2,5 millions de tonnes de cuivre recyclé ont été utilisées en Europe, soit 43 % de l’utilisation totale sur la période selon l’ICSG. Le recyclage provient de deux sources :
la revalorisation du « cuivre secondaire » issu des produits arrivés au terme de leur cycle de vie, qui sont récupérés, triés et dont le cuivre peut être refondu ;
la réintroduction directe des chutes d’usine dans le processus productif (également appelée « refonte des chutes neuves »).
Parmi les applications contenant les plus fortes proportions de cuivre et présentant le potentiel de recyclage le plus élevé, on peut citer les câbles, les canalisations, valves et raccords, les toitures et bardages cuivre, les moteurs industriels, l’équipement ménager, ainsi que l’équipement informatique et électronique.
L’augmentation constante de la demande, en hausse de 134 % depuis 1970, associée aux importantes fluctuations du prix de la matière première, font du recyclage du cuivre un complément indispensable à la production primaire. Outre l’argument environnemental, la disponibilité du cuivre recyclé à des prix compétitifs constitue aujourd’hui une nécessité économique et une partie essentielle de la chaîne de valeur du cuivre.
On estime que 80 % du cuivre utilisé depuis l’Antiquité est toujours en circulation.
Rôle biologique
Un oligo-élément indispensable à la vie
Le cuivre est un oligo-élément indispensable à la vie (hommes, plantes, animaux, et microorganismes). Le corps humain contient normalement du cuivre à une concentration d’environ 1,4 à 2,1 mg par kg. On trouve du cuivre dans le foie, les muscles et les os. Le cuivre est transporté par la circulation sanguine au moyen d’une protéine nommée céruléoplasmine. Après absorption du cuivre au niveau de l’intestin, il est acheminé vers le foie, lié à l’albumine. Le métabolisme et l’excrétion du cuivre sont contrôlés par la fourniture au foie de céruléoplasmine, et le cuivre est excrété dans la bile. Au niveau cellulaire, le cuivre est présent dans nombre d’enzymes et de protéines, y compris le cytochrome c oxydase et certaines superoxydes dismutases (SOD). Le cuivre sert au transport biologique d’électrons, e.g. les protéines « bleu cuivre », azurine et plastocyanine. La dénomination « bleu cuivre » vient de leur intense couleur bleue due à une bande d’absorption (autour de 600 nm) par transfert de charge coordinat / métal (LMCT). Nombre de mollusques et certains arthropodes, tels quel la limule font appel, pour le transport de l’oxygène, à un pigment à base de cuivre, l’hémocyanine, plutôt qu’à l’hémoglobine, possédant un noyau fer, et leur sang est donc bleu, et non rouge, lorsqu’il est oxygéné.
Diverses agences de santé dans le monde ont défini des normes nutritionnelles journalières. Les chercheurs spécialisés en microbiologie, toxicologie, nutrition et évaluation des risques sanitaires travaillent ensemble à définir avec précision les quantités de cuivre requises par l'organisme, en évitant les déficits ou les surdosages en cuivre. En France les Apports nutritionnels conseillés (ANC) par l’Agence française de sécurité sanitaire des aliments sont de 1 mg / jour chez l’enfant jusqu’à 9 ans, 1,5 mg / jour chez l’adolescent jusqu’à 19 ans, et 2 mg / jour chez l’adulte.
Excès et manque de cuivre
Chez l'homme et les mammifères, le cuivre est notamment nécessaire à la formation de l'hémoglobine, il intervient dans la fonction immunitaire et contre le stress oxydant. Comme il facilite l’assimilation du fer, un déficit en cuivre peut souvent donner lieu à des symptômes analogues à une anémie. Chez certaines espèces, il remplace même le fer pour le transport de l'oxygène. C’est le cas de la limule (arthropode) dont le sang est bleu, ou de certains chironomes qui sont verts.
Un déficit en cuivre est également associé à une diminution du nombre de certaines cellules sanguins (cytopénie) et a une atteinte neurologie de type myélopathie. Le déficit se voit essentiellement après une chirurgie digestive (dont la chirurgie bariatrique et les surcharges en zinc (le zinc étant absorbé de manière compétitive avec le cuivre par le tube digestif)).
Inversement, une accumulation de cuivre dans les tissus peut provoquer chez l’homme la maladie de Wilson.
Propriétés antibactériennes
Depuis l’Antiquité, le métal rouge est utilisé par l’homme pour ses vertus sanitaires, notamment pour soigner les infections et prévenir les maladies. Avant même la découverte des micro-organismes, les Égyptiens, les Grecs, les Romains et les aztèques utilisaient des préparations à base de cuivre pour leurs maux de gorge, éruptions cutanées et pour l’hygiène quotidienne. Au XIX siècle, après la découverte du lien de causalité entre le développement de germes pathogènes et la déclaration des maladies, de nombreux scientifiques se sont intéressés à l’exploitation des propriétés antibactériennes du cuivre. Actuellement, le cuivre est utilisé par l’industrie pharmaceutique, dans des applications allant des antiseptiques et antifongiques aux produits de soins et d’hygiène (crèmes, ampoules d’oligo-éléments…).
S’il est bénéfique à faibles doses, l'ion Cu peut cependant, comme la plupart des éléments chimiques, se révéler toxique pour certains organismes à des concentrations très élevées (des cas de contaminations ont été identifiés à l'âge du bronze sur des squelettes d’hommes ou d’animaux à proximité des anciennes mines de cuivre de l'actuelle Jordanie) ou lorsqu’il est associé à d’autres matériaux comme le plomb (une telle association pourrait aggraver le risque de maladie de Parkinson).
En mars 2008, l’Agence américaine pour la Protection de l’Environnement (EPA) a homologué le cuivre et ses alliages en tant qu’agents antibactériens capables de lutter contre la prolifération de certaines bactéries responsables d’infections potentiellement mortelles. Le cuivre, le bronze et le laiton sont ainsi les premiers matériaux officiellement autorisés à revendiquer des propriétés sanitaires aux États-Unis. Cette reconnaissance est une étape importante pour l’utilisation du cuivre comme agent antibactérien.
Dans le domaine de la construction, les vertus bactériostatiques et antifongiques du cuivre, sa résistance à la corrosion et son imperméabilité justifient également son utilisation dans les canalisations d'eau, et dans certains pays, pour les toitures et gouttières (ni mousse ni plantes ne s'y installent). Le cuivre est le matériau le plus utilisé à travers le monde pour la distribution d’eau sanitaire, et celui pour lequel on dispose du retour d’expérience le plus important, portant sur plusieurs décennies d’utilisation. Des canalisations en cuivre contribuent à prévenir et limiter le risque de contamination des réseaux d’eau par certaines bactéries comme les légionelles, responsables de la légionellose, maladie pulmonaire mortelle dans 10 % des cas. Selon le P Yves Lévi, Directeur du Laboratoire Santé Publique et Environnement, Université Paris-Sud 11 : « Si aucun matériau ne peut garantir l’absence totale de bactéries dans les réseaux, le cuivre permet néanmoins de limiter les risques ».
Les propriétés antibactériennes sont à l’origine d’une autre application : les peintures dites antifouling, ou anti-salissures, dont sont recouvertes les coques des bateaux. Celle-ci empêche la prolifération et la fixation d'algues et de micro-organismes marins qui ralentissent les embarcations et augmentent les risques de corrosion. Le cuivre pur est le principal composant actif de ces peintures (jusqu’à 2 kg de poudre de cuivre par litre). Aujourd’hui utilisées pour la plupart des bateaux, elles ont remplacé les feuilles de cuivre qui étaient autrefois clouées sur les parties immergées de la coque des navires et qui avaient le même effet. Inventée par les phéniciens, cette technique avait été généralisée à la fin du XVIII siècle par tous les chantiers navals. Dans la marine, le cuivre et ses alliages (bronze ou laiton) sont également utilisés pour leur résistance à la corrosion (clous, hublots, accastillage, hélice). Le même principe est parfois appliqué pour protéger les toitures : un simple fil de cuivre tendu sur le faite d'un toit empêche l’apparition de mousses ou d’algues qui pourraient y pousser.
Depuis 2007, une nouvelle application d’avenir a vu le jour dans plusieurs pays à travers le monde : l’utilisation de surfaces de contact en cuivre (poignées de porte, tirettes de chasse d'eau, barres de lits) en milieu hospitalier pour réduire les risques d’infections nosocomiales.
En janvier 2010, l’hôpital privé St Francis en Irlande a été équipé de poignées de porte en cuivre dans le but de limiter les risques d’infections nosocomiales C’est la première fois qu’un établissement de santé va exploiter les propriétés antibactériennes du cuivre dans le but de se prémunir contre ce type d’infection et d’accroître la sécurité de ses patients. Les résultats très prometteurs des études de laboratoire et de terrain menées en Grande-Bretagne depuis 2007 sur le potentiel antibactérien du métal rouge sont à l’origine de la décision des dirigeants de l’hôpital. Les résultats de l’expérimentation de l’hôpital de Birmingham montrent en effet que les surfaces en cuivre permettent d’éradiquer 90 à 100 % des micro-organismes tels que le staphylocoque doré résistant à la méthicilline (SARM) en milieu hospitalier.
En France, c'est le service de réanimation et de pédiatrie de l'hôpital public de Rambouillet qui va le premier, tester le cuivre pour lutter contre les maladies nosocomiales (sur les poignées de porte, barres de lits, mains courantes, plaques de propreté).
Toxicologie et précautions
Écotoxicologie
Sur cette pierre tombale, deux clous de laiton riches en cuivre ont libéré de très faibles doses de cuivre. Ces doses, bien qu'infimes ont tué la totalité des bactéries, mousses et lichens, laissant la pierre comme neuve
Le cuivre, quand il est présent sous forme d'ions ou de certains composés biodisponibles peut être écotoxique même à faible dose notamment pour certains organismes aquatiques, et sur terre pour les mousses et lichens (ce pourquoi il est employé dans de nombreux antifoolings et agent de traitement des bois utilisés à l'extérieur.
Risques pour l'agriculture et l'élevage
Du fait de ses propriétés algicides, bactéricides et antifongiques, le cuivre est également utilisé comme pesticide pour l’agriculture. Conformément à la Directive européenne 2092/91, il peut être utilisé en agriculture biologique sous forme d’hydroxyde de cuivre, d’oxychlorure de cuivre, de sulfate de cuivre et d’oxyde de cuivre. Il est en particulier utilisé en viticulture biologique sous forme de Bouillie bordelaise pour lutter contre le mildiou. Cette technique ancestrale est efficace, mais doit être raisonnée : un épandage trop intensif peut entraîner une accumulation de cuivre dans le sol et - à long terme - en détériorer la qualité. Des effets toxiques ont par exemple été observé chez le mouton pâturant près de vignes. Ce mammifère est l'un des plus sensibles au cuivre - parmi ceux dont les réactions au cuivre ont été étudiées : 15 mg de Cu par kg d'aliment est le seuil létal). L’Union Européenne a donc fixé à 150 mg⋅kg la teneur maximale des sols en cuivre en agriculture biologique.
Les moûts de raisin issus de la viticulture biologique peuvent renfermer du cuivre. Celui-ci est soustrait des vins par traitement au ferrocyanure de potassium ou par le monosulfure de sodium qui le précipite à l’état de sulfures éliminées avec les levures et les lies.
D'autres problématiques liées à une utilisation du cuivre en trop grande quantité existent, par exemple dans l’élevage porcin, où le cuivre est parfois utilisé comme complément alimentaire. Facteur de croissance pour le porcelet en post-sevrage, il est parfois incorporé à des niveaux jusqu'à 30 fois supérieurs aux besoins de l’animal. De telles pratiques conduisent à une trop forte concentration de cuivre dans les lisiers, qui après épandage, peuvent alors poser des problèmes environnementaux (des phénomènes de phytotoxicité pourraient apparaître à moyen terme dans certaines régions d'élevage intensif). Une réduction des apports de cuivre dans l'alimentation du porc serait un moyen de diminuer ces risques environnementaux.
Risques pour l'homme
Pour l’homme, le cuivre ingéré à très haute dose, en particulier sous ses formes oxydées (vert-de-gris, oxyde cuivreux) peut se révéler nocif. Quelques cas d’exposition prolongée au cuivre ayant entraîné des désordres sur la santé ont été observés. La "Fiche de données toxicologiques et environnementales des substances chimiques" de l’INERIS consacrée au cuivre et à ses dérivés peut être consultée librement.
C'est un oligoélément indispensable à la spermatogenèse (un taux anormalement bas de cuivre dans le plasma séminal est associé à l'oligospermie et à l'azoospermie), mais il peut, comme d'autres métaux, avoir un effet inhibiteur sur la motilité des spermatozoides. C'est ce que révèle une étude menée dans les années 1970 sur les métaux suivants : cuivre, laiton, nickel, palladium, platine, argent, or, zinc et cadmium).
D'autres travaux menés in vitro sur des rats ont montré dans les années 1980 que l’inhalation prolongée de chlorure de cuivre pouvait entraîner une immobilisation non réversible du sperme chez le rat. Les auteurs, du Département d'études vétérinaires de l'université de Sydney, remarquent que cet effet pourrait expliquer l'efficacité contraceptive des stérilets en cuivre, en plus de l'effet mécanique du stérilet qui inhibe le processus contraceptif en milieu utérin humain . Une autre étude montre que c'est une phagocytose activée par les leucocytes de la cavité utérine qui expliquerait l'efficacité des stérilets de cuivre.
Applications

Anciens ustensiles de cuisine en cuivre, dans un restaurant de Jérusalem

Assortiment de raccords en cuivre

Toiture en cuivre du Minneapolis City Hall, recouverte de patine
Toiture en cuivre du dôme de la gare de Limoges-Bénédictins, ici artificiellement vieilli, exception faite des ornementations en vert clair.
Environ 98 % du cuivre est utilisé sous forme métallique, profitant de ses propriétés physiques spécifiques - malléabilité et ductilité, bonne conductivité thermique et électrique et du fait qu’il est résistant à la corrosion. Le cuivre s’avère souvent trop mou pour certaines applications, aussi est-il intégré à de nombreux alliages. On compte parmi ceux-ci le laiton, alliage de cuivre et de zinc ou le bronze, alliage de cuivre et d'étain. On peut usiner le cuivre, bien qu’il soit souvent nécessaire de faire appel à un alliage pour les pièces de forme complexe, comme les pièces filetées, afin de conserver des caractéristiques d’usinabilité satisfaisantes. Sa bonne conductivité thermique permet de l’utiliser pour les radiateurs et les échangeurs de chaleur.
Applications mécaniques et électriques
On retrouve du cuivre dans un grand nombre d’applications contemporaines et dans de nombreuses industries différentes : télécommunications, bâtiment, transports, énergie et énergies renouvelables. Du fait de sa très bonne conductivité électrique et thermique, le cuivre est utilisé dans de nombreuses applications. Il est le meilleur conducteur électrique parmi l’ensemble des métaux non précieux. À titre d’exemple, la conductivité électrique du cuivre (59,6×10 S.m) est supérieure de 58 % à celle de l’aluminium (37,7×10 S.m).
Les équipements électriques et électroniques contiennent jusqu'à 20 % de leur poids en cuivre. Du fait de sa grande densité (8,94 g/cm) il ne peut cependant pas être utilisé dans les lignes haute tension aériennes où l’aluminium s’impose en raison de sa légèreté. Ses propriétés électriques sont largement exploitées, et son utilisation en tant que conducteur, dans les électroaimants, les relais, les barres de distribution et les commutateurs. Les circuits intégrés ainsi que les cartes à circuits imprimés utilisent de plus en plus le cuivre au lieu de l’aluminium du fait de sa conductivité électrique plus élevée. Il est également utilisé comme matériau pour la fabrication des radiateurs pour ordinateurs, du fait de sa meilleure conductivité thermique que celle de l’aluminium. Les tubes à vide, les tubes à rayons cathodiques et les magnétrons présents dans les fours à micro-onde font appel au cuivre, comme les guides d’ondes pour l’émission de micro-ondes.
Dans certaines applications thermiques (les radiateurs d’automobile par exemple), pour des raisons économiques, il est parfois remplacé par des matériaux moins performants en termes de rendement (aluminium, matériaux de synthèse). Le cuivre est rarement utilisé pur, sauf pour les conducteurs électriques et dans le cas où l'on souhaite une grande conductivité thermique. Le cuivre pur est très ductile (capacité élevée d'allongement sans rupture). Il est montré que les conductivités thermique et électrique du cuivre sont liées très fortement. Cela résulte du mode de transmission de la chaleur et de l'électricité dans les métaux, qui se fait majoritairement par déplacement d'électrons. On notera à ce titre que le cuivre servant dans ce domaine doit être extrêmement pur (minimum 99,90 % selon les normes internationales). Les impuretés solubles dans la matrice de cuivre telles que le phosphore (même en très faible proportion) diminuent très fortement la conductivité. Le cuivre est couramment utilisé en laboratoire comme cible dans les tubes à rayons X pour la diffraction sur poudres. La raie K α {\displaystyle \alpha } du cuivre a pour longueur d'onde moyenne 1,54182 Å.
Architecture et industrie
Alors que, pour les applications électriques, on utilise du cuivre non oxydé, le cuivre utilisé en architecture est du cuivre phosphoreux désoxydé (également nommé Cu-DHP). Depuis l’antiquité, on utilise le cuivre comme matériau de couverture étanche, ce qui donne à nombre de bâtiments anciens l’aspect vert de leurs toitures et coupoles. Au début se forme de l’oxyde de cuivre, bientôt remplacé par du sulfure cuivreux et cuivrique, et enfin par du carbonate de cuivre. La patine finale de sulfate de cuivre (dénommée vert-de-gris) est très résistante à la corrosion.
Statuaire : la statue de la Liberté, par exemple, comporte 179 220 livres (81,29 tonnes métriques) de cuivre.
Allié au nickel, par exemple dans le cupronickel et le monel, il est utilisé en construction navale en tant que matériau résistant à la corrosion.
Du fait de son excellente dissipation thermique, il est utilisé pour la boîte à feu des chaudières à vapeur de Watt.
Les composés de cuivre sous forme liquide servent à la préservation du bois contre les dégâts causés par la pourriture sèche, en particulier lors du traitement de parties originales de structures en cours de restauration.
On peut placer des fils de cuivre sur des matériaux de toiture non conducteurs pour limiter le développement des mousses (on peut également utiliser le zinc à cet effet.)
Le cuivre sert également pour empêcher les éclairs de frapper directement un bâtiment. Placées en hauteur au-dessus du toit, des pointes de cuivre (paratonnerres) sont reliées à un câble de cuivre de forte section lui-même connecté à une grande plaque métallique enterrée. La charge est dispersée dans le sol, au lieu de détruire la structure principale.
Le cuivre présente une bonne résistance à la corrosion, cependant inférieure à celle de l’or. Il a d’excellentes propriétés en soudage et brasage et peut également être soudé à l’arc, bien que les résultats obtenus soient meilleurs avec la technique de soudage à l’arc sous gaz neutre, avec apport de métal.
Applications des composés de cuivre
Environ 2 % de la production de cuivre sert à la production de composés. Les applications principales sont les compléments alimentaires et les fongicides pour l’agriculture.
Applications biomédicales
Dans les hôpitaux en tant que surface biostatique, et pour entourer certaines parties des navires afin de les protéger contre les anatifes et les moules, originellement utilisé pur, mais maintenant remplacé par le métal de Muntz. Les bactéries ne se développent pas sur une surface en cuivre du fait de ses propriétés biostatiques. On utilise dans les hôpitaux des poignées de porte en cuivre pour réduire les risques de contagion, et la maladie du légionnaire est stoppée par l’utilisation de canalisations en cuivre dans les circuits d’air conditionné.
Le sulfate de cuivre (II) est utilisé comme fongicide et pour limiter la prolifération des algues dans les étangs et piscines domestiques. On l’utilise sous forme de poudre et de pulvérisation, en jardinage, pour lutter contre le mildiou.
Le cuivre 62 PTSM, composé contenant du cuivre-62 radioactif sert de marqueur radioactif en tomographie par émission de positron (PET) pour la mesure des débits sanguins au niveau du cœur.
Le cuivre-** en tant que marqueur radioactif en tomographie par émission de positron (PET) en imagerie médicale. Associé dans un complexe chélaté, il peut être utilisé pour le traitement du cancer par radiothérapie.
Applications en aquaculture
Les alliages de cuivre ont pris une place importante en tant que matériaux utilisés dans les filets dans l’industrie de l’aquaculture. Ce qui place les alliages de cuivre à part des autres matériaux est qu’ils sont antimicrobiens. Dans un environnement marin, les propriétés antimicrobiennes et algicides des alliages de cuivre empêchent l’encrassement biologique. En plus de leurs propriétés antifouling, les alliages de cuivre présentent des propriétés de résistance structurale et à la corrosion en milieu marin. C’est la combinaison de toutes ces propriétés – antifouling, haute résistance mécanique et à la corrosion – qui font des alliages de cuivre des matériaux de choix pour les filets et comme matériaux de structure dans les exploitations de pisciculture commerciales à grande échelle.
Usages divers
En tant que composant des glaçures pour céramique et pour colorer le verre.
Instruments de musique, en particulier les cuivres, les cymbales et les timbales.
Produit d’extinction Classe D utilisé sous forme de poudre pour éteindre les feux de lithium par étouffement du métal en combustion et en jouant le rôle de dissipateur thermique.
Fibres textiles, pour réaliser des tissus de protection antimicrobiens.
Armement :
Les munitions pour armes de poing sont constituées couramment d’une chemise en cuivre entourant le cœur de la balle.
Le cuivre, sous forme de laiton, est également souvent utilisé pour réaliser des boîtiers.
Le cuivre est également utilisé comme matériau pour les douilles d’obus à charge creuse destinées à percer les blindages, ainsi que dans les explosifs utilisés en démolition (lame).
Le cuivre sert fréquemment en galvanoplastie, en général comme substrat pour le dépôt d’autres métaux, comme le nickel.
En pyrotechnie, le cuivre colore une flamme en bleu.
Alliages
Les alliages de cuivre sont très largement utilisés dans de nombreux domaines. Les alliages les plus célèbres sont certainement le laiton (cuivre-zinc) et le bronze (cuivre-étain) qui ont été élaborés bien avant qu'on ne fasse les premières coulées de cuivre pur. Les fonts baptismaux de la collégiale Saint-Barthélemy de Liège ont fasciné les chercheurs à ce niveau. Il a fallu se rendre à l'évidence que le laiton est plus facilement élaborable que le cuivre pur et le zinc pur séparés.
Pièces mécaniques : le cuivre pur ou légèrement allié présente des propriétés mécaniques satisfaisantes mais il n'est généralement pas utilisé en raison de sa densité élevée.
Pièces de frottement et d'usure : voir l'article tribologie.
Pièces devant résister à la corrosion, l'oxyde de cuivre est stable à température ambiante et recouvre généralement par une fine couche isolante les pièces en cuivre.
Économie du cuivre

Tendance de la production mondiale : 1900-2000
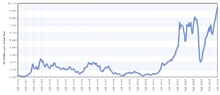
Prix du cuivre 2003–2011 en USD par tonne
Le cuivre est le troisième métal le plus utilisé au monde après le fer et l'aluminium. La forte corrélation du cuivre à la conjoncture industrielle fait de l'étude du marché du cuivre un excellent indicateur avancé de l'état de l'économie.
En 2004, les principaux producteurs étaient le Chili (37,3 %), les États-Unis (8 %, dont 62 % en Arizona), le Pérou (7,1 %) et l'Indonésie (5,7 %). En Europe, le principal producteur était la Pologne avec 585 000 tonnes par an. Le Chili, qui exporte le tiers de sa production, est le premier pays exportateur de cuivre, suivi par le Pérou et l'Australie. Les plus gros importateurs sont la Chine (28 %), le Japon (23 %), l'Inde (10 %) et la Corée du Sud (8 %).
En avril 2006, le cours du cuivre était à environ 6 300 euros par tonne, en forte hausse par rapport à 2005, due principalement à la demande asiatique. Sur les 8 premiers mois de l'année 2006, la hausse s'est montée à 69 %.
En 2008, la production minière de cuivre a dépassé les 15 millions de tonnes (contre 500 000 tonnes en 1900). La production mondiale de cuivre raffiné dépasse quant à elle les 18 millions de tonnes. La consommation mondiale totale de cuivre (cuivre primaire raffiné + cuivre recyclé) a plus que doublé entre le début des années 1970 et 2008 pour atteindre 23,5 millions de tonnes.
Les plus importantes sociétés productrices de cuivre sont la compagnie nationale chilienne Codelco, puis l'américain Freeport-McMoRan, l'anglo-australien Rio Tinto et l'anglo-suisse Xstrata.
Le cuivre, ses contrats à terme et ses options se négocient sur 3 Bourses des métaux à travers le monde : le London Metal Exchange (LME), le Comex, marché des métaux du Nymex (New York Mercantile Exchange), et le SHME (Shanghaï Metal Exchange). À Londres, le cuivre est négocié en lots de 25 tonnes et coté en dollars américains par tonne. À New York, il est négocié en lots de 25 000 livres et coté en cents américains par livre. À Shanghai, il est négocié en lots de 5 tonnes et coté en yuan par tonne.
À la suite de la crise de 2008-2009, le cuivre, qui cotait 9000 $ par tonne en juillet 2008 à Londres, a plongé à un plus bas de 2800 $ par tonne fin 2008, puis repris 140 % en 2009 et atteint 8501 $ par tonne en octobre 2010.
Le recyclage primaire a gagné 20 % en cinq ans dans le monde, puis a chuté de 2,6 % à la suite de la crise de 2008 (par rapport à 2007), en raison d'une moindre refonte des «chutes neuves ».
Le recyclage secondaire a augmenté de 3 % en 2008 dans le monde (soit + 49 % de 2002 à 2008) (pour 23,5 millions de tonnes utilisée dans le monde en 2008, ce qui correspond à une consommation ayant cru de 140 % depuis 1976, les besoins ont augmenté de 140 %. 2 Mt ont ainsi été recyclées en 2005, soit 13 % de la production totale de ce métal.
Les ferrailleurs participent pleinement au recyclage en rachetant les anciens métaux et déchets de métaux aux particuliers et entreprises. En 2015, le cours de cuivre au rachat varie de 4 à 5 euros le kilo en France.
L'Europe (en incluant la Russie) serait le premier utilisateur mondial de cuivre recyclé, avec plus de 40 % de sa consommation, et serait la région ou la proportion de cuivre recyclé a progressé (passant de 41,3 % en 2007 à 43 % en 2008), avec 2,5 millions de tonnes de cuivre recyclés utilisées en 2008.
Les derniers chiffres indiquent, selon l'ICSG, que plus du tiers des besoins mondiaux et 42 % des besoins européens proviennent du recyclage en 2009. Ce taux atteint même 70 % dans la construction. La Chine est le premier producteur de cuivre de recyclage secondaire.
De 1967 et 1988, les gros pays producteurs de cuivre s’étaient regroupés au sein d’un consortium : le CIPEC. Créé et dissous à l’initiative du Chili, le CIPEC représentait environ 30 % du marché mondial de cuivre, et plus de 50 % des réserves mondiales connues.
En 2014, la France est nette importatrice de cuivre, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 6 400 €.
Réserves mondiales
Les réserves mondiales estimées de cuivre s'élevaient à 630 millions de tonnes en 2010, dont près du quart au Chili. La production mondiale était de 16,2 millions de tonnes en 2010, assurée essentiellement par le Chili (34,1 %), le Pérou (7,9 %), la Chine (7,1 %) et les États-Unis (6,9 %).

 词典释义:
词典释义:

 锅
锅 矿
矿
 制品,
制品,  器
器 器
器 版,
版,  版画
版画 管乐器
管乐器 管乐队
管乐队 ;
; ;
; 管乐器:orchestre de~s
管乐器:orchestre de~s
 管乐队
管乐队



 (O. F. H. C
(O. F. H. C )
)



 板
板



 合金
合金





 绿
绿 钢
钢 合金
合金 矿;
矿;  绿
绿 催
催

 氧
氧 皮
皮


 值
值

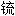 , 冰
, 冰
 氨法
氨法
 合金
合金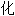 三
三
 氨液
氨液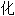

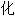
 , 瓦
, 瓦 矿
矿 锌电池
锌电池
 电池
电池 质冷凝器
质冷凝器 红
红 皂
皂 氨丝
氨丝
 铵
铵





.svg.png)





