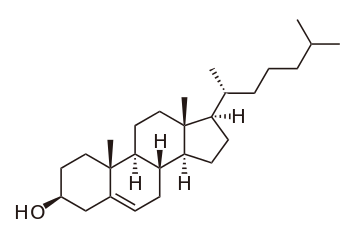
Le cholestérol est un lipide de la famille des stérols qui joue un rôle central dans de nombreux processus biochimiques. Le cholestérol tire son nom du grec ancien chole- (bile) et de stereos (solide), car il fut découvert sous forme solide dans les calculs biliaires en 1758 par François Poulletier de La Salle. Mais ce n'est qu'en 1814 que le chimiste français Eugène Chevreul lui donna le nom de cholestérine.
Le mot « cholestérol » désigne une molécule unique. Ce qui signifie que les termes de « bon » et « mauvais cholestérol » ne servent pas à désigner deux molécules différentes, mais font référence aux lipoprotéines de haute densité (HDL) et lipoprotéines de basse densité (LDL), les transporteurs du cholestérol dans le sang. Voir en particulier la teneur en cholestérol dans l'alimentation et athérosclérose.
Histoire
Le cholestérol est découvert sous forme solide dans les calculs biliaires en 1758 par François Poulletier de La Salle.
Le nutritionniste américain Ancel Keys réalise après la Seconde Guerre mondiale l'étude des 7 pays (en), étude épidémiologique sur plusieurs décennies qui met en évidence une corrélation entre le taux de cholestérol sanguin et les accidents cardiovasculaires. Ces résultats lui font émettre l'« hypothèse lipidique » selon laquelle le cholestérol est le facteur de risque majeur responsable de la forte mortalité cardio-vasculaire mais cette étude souffre de biais de comparaison ou des confondeurs.
À la suite de cette étude longitudinale, des essais cliniques sont menés sur des populations d'anciens combattants américains mis au régime hypocholestérolémiant mais ces tentatives n'ont pas d’impact significatif sur leur mortalité, l'« hypothèse lipidique » n'est pas validée.
En 1954, le chercheur français Jean Cottet réalise que des ouvriers agricoles intoxiqués par le pesticide qu'ils répandent dans les champs ont un taux de cholestérol qui s'est effondré. Un de ses amis chimiste de l'Imperial Chemical Industries (Michael Oliver) synthétise un médicament dérivé de ce pesticide, le clofibrate. Le test de cette molécule sur des rats puis des patients confirme son effet hypolipémiant. L'Organisation mondiale de la santé réalise un essai clinique sur 15 000 Européens pour évaluer l'effet du clofibrate sur la prévention de l'infarctus, mais cette étude est négative, l'essai devant même être arrêté prématurément, le groupe sous clofibrate ayant une prévalence plus élevée que le groupe sous placebo.
Malgré cette étude réfutant le lien entre baisse du cholestérol et surmortalité, une famille de molécules médicamenteuses hypolipémiantes dérivées de ce médicament est lancée, les fibrates.
Dans les années 1990, deux études sur la simvastatine et la pravastatine montrent leur effet de prévention sur des hommes ayant un taux de cholestérol élevé. Certains soulignent que les recommandations tendant à viser un taux optimal de cholestérol (plus particulièrement sa fraction LDL), ne sont en fait étayées par aucune étude, ces dernières ayant toujours été faites à des doses fixes de statines quel que soit le taux initial de cholestérol, la baisse de ce dernier n'étant pas un objectif. Il semble que les statines ont un effet de prévention vasculaire mais sans lien avec le taux de cholestérol.
Structure
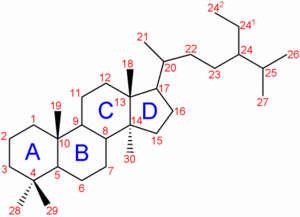
Numérotation du cholestérol.
La molécule de cholestérol comprend quatre cycles carbonés notés A,B,C et D (noyau cyclopentano-perhydro-phénanthrénique), 8 carbones asymétriques (les carbones 3, 8, 9, 10, 13, 14, 17 et 20), ce qui fait 2 soit 256 stéréoisomères dont un seul existe : le 3β-ol lévogyre. Le cholestérol possède un groupe hydroxyle -OH sur le carbone 3 (C3). Ce groupe constitue la tête polaire et donc la partie hydrophile du cholestérol. La fonction -OH du cholestérol peut être estérifiée par un acide gras qui rend la molécule totalement insoluble dans l'eau.
Localisation
Le cholestérol est présent sous forme de stérides (cholestérol estérifié) dans la plupart des tissus des vertébrés, et en particulier le foie, le cerveau, et la moelle épinière.
Rôle
C'est un composant majeur des membranes cellulaires animales qui contribue à leur stabilité et au maintien de leurs structures en s'intercalant entre les phospholipides (formant la bicouche de la membrane).
Il fluidifie la membrane car il empêche sa gélification en évitant la cristallisation des acides gras, et diminue la perméabilité membranaire aux molécules hydrosolubles.
Il a un rôle de « tampon thermique » : à 37 °C, il limite le mouvement des phospholipides, donc la fluidité membranaire diminue ; à des températures plus basses, il empêche l'entassement des phospholipides.
Dans la membrane, il permet la formation de radeaux lipidiques, zone essentielle à l'ancrage de protéines fonctionnelles.
Dans les neurones, il permet la synthèse des neurotransmetteurs par exocytose et donc la propagation de l'influx nerveux.
Le métabolisme du cholestérol est également précurseur de nombreuses molécules :
les hormones stéroïdiennes : cortisol, cortisone, et aldostérone ;
les hormones stéroïdiennes sexuelles : progestérone, œstrogènes, et testostérone ;
le cholécalciférol (vitamine D3) ;
l'hème A ;
les protéines prénylées ou farnésylées ;
l'ubiquinone ou coenzyme Q10 ;
le dolichol ;
le facteur nucléaire NF kappa B ;
la protéine tau ;
les sels biliaires.
Métabolisme
Synthèse
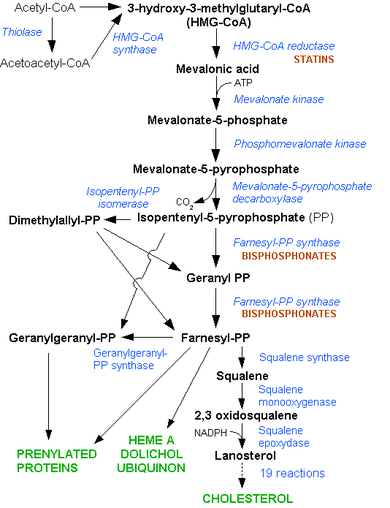
La synthèse du cholestérol par la voie de l'hydroxyméthyl-CoA réductase.
La synthèse du cholestérol se fait dans le cytoplasme des cellules du foie et de l'intestin principalement. La synthèse débute par la condensation de trois molécules d'acétate (=3×2 atomes de carbone) en hydroxy-méthyl-glutarate (ou HMG = 1×6 carbones). L'hydroxy-méthyl-glutarate est ensuite réduit en mévalonate (=1×6 carbones) par une enzyme, l'hydroxyméthylglutaryl-CoA réductase (ou HMGCoA réductase), en présence de coenzyme A. Cette étape est régulée par les statines. Le mévalonate est ensuite décarboxylé en isoprénoïdes à cinq carbones (l'isopentényl pyrophosphate et le diméthylallyl pyrophosphate). La condensation de six molécules d'isoprénoïdes aboutit au squalène (6×5=30 carbones). Enfin, le squalène subit l'action de la squalène cyclase qui crée les cycles du cholestérol à partir des insaturations présentes dans le squalène.
Régulation
Une partie du cholestérol peut ne pas être absorbée lors de la digestion. Par exemple, une bactérie intestinale présente chez l'homme transforme le cholestérol en coprostanol, stable et non absorbable et donc éliminée dans les selles. Plus on mange de cholestérol et moins notre corps en absorbe, en pourcentage. C'est un premier niveau de régulation. Exemples : si vous mangez 400 mg de cholestérol, votre organisme l'absorbe à 40 %. Si vous en mangez 800 mg, votre organisme l'absorbe à 20 %.
Concernant le cholestérol absorbé ou produit par l'organisme, il existe trois niveaux de régulation du cholestérol, le but étant de diminuer le taux de cholestérol de la cellule quand il est en excès :
le cholestérol libre dans la cellule inhibe la production de ses propres récepteurs membranaires LDLR. Pour ce faire, il inhibe la transcription du gène qui code les LDLR. Par conséquent, le flux entrant de cholestérol dans la cellule est diminué ;
le cholestérol libre inhibe la HMG-coA réductase, ce qui empêche la poursuite de la réaction de synthèse du cholestérol ;
enfin, le cholestérol libre stimule l’acyl transférase (ACAT), enzyme catalysant son estérification en stéride. Ceci favorise le stockage du cholestérol libre.
La synthèse de mévalonate, deuxième étape de la synthèse du cholestérol, est très régulée par le métabolisme. L'activité de l'HMG-CoA réductase, enzyme catalysant cette synthèse, est diminuée lorsque l'apport alimentaire en cholestérol est élevé ou par des médicaments de la famille des statines. Dans le cas d'une alimentation équilibrée, la proportion de cholestérol d'origine endogène est estimée entre 50 % et 80 % selon les auteurs (environ 700 mg/j), le reste du cholestérol étant d'origine alimentaire (entre 50 % et 20 % donc). L'augmentation des apports en cholestérol d'origine alimentaire inhibe la synthèse du cholestérol d'origine endogène.
À partir des éléments précédents, on peut dire que le cholestérol alimentaire influe très peu sur la cholestérolémie.
Dégradation
Le cholestérol est dégradé dans le foie en acides biliaires (dont l'acide chénodésoxycholique) par la 7-α-hydroxylase. La colestyramine, un médicament utilisé pour traiter l'hypercholestérolémie, diminue l'absorption intestinale des acides biliaires, et par conséquent leur concentration dans les cellules hépatiques. Ceci entraîne une activation de la 7-α-hydroxylase favorisant la dégradation du cholestérol.
Transport du cholestérol dans le sang : LDL, VLDL et HDL
En tant que composé hydrophobe, le cholestérol n'est pas soluble dans le sang. C'est pourquoi il est assimilé à une graisse, alors que c'est un stérol. Son transport est assuré par différents types de lipoprotéines :
Les lipoprotéines de basse densité (ou LDL : low-density lipoprotein) transportent le cholestérol (ainsi que des triglycérides et des vitamines liposolubles) des lieux de sécrétion vers les cellules de l'organisme. Ces cellules expriment des récepteurs à leur surface pour indiquer leur besoin en cholestérol (ou autres substances).
Hypothèse du « mauvais » cholestérol : des taux importants de LDL conduiraient au dépôt de cholestérol sur les parois des artères (les récepteurs à LDL du foie et des tissus sont en effet très sensibles : au moindre changement biochimique d'une LDL, du fait d'une oxydation, d'une glycation ou d'une dégradation liée à la fumée de cigarette ou à d'autres facteurs comme le sucre, les lipoprotéines transportant le cholestérol ne seraient plus reconnues, et seraient donc phagocytées, puis formeraient un dépôt) sous forme de plaque d'athérome, ce qui pourrait accroître le risque de maladies cardiovasculaires et leur vaut le nom de « mauvais » cholestérol.
Cette hypothèse est une simplification de la réalité complexe des lipoprotéines. Ces différents transporteurs ne sont ni « bons », ni « mauvais » et s'échangent entre eux du cholestérol, ce qui fait qu'il n'y a pas de frontière réelle entre ces particules dans la réalité. Seul l'esprit humain essaie de classer ce qui forme un continuum de transporteurs de tailles diverses en des ensembles figés. Il existe d'ailleurs, selon la classification, différentes lipoprotéines de basse densité (LDL1, 2 et 3) et les plus dangereuses, selon le modèle actuel, sont les plus petites et les plus denses (LDL3). Ce serait les plus athérogènes.
Les lipoprotéines de haute densité (ou HDL : high-density lipoprotein) déchargent les artères et les tissus extrahépatiques du cholestérol oxydé, et le ramènent vers le foie où il est dégradé ; on parle alors de « bon » cholestérol, même si cela désigne un cholestérol usé et qui va être recyclé.
Les chylomicrons, ces lipoprotéines assurent le transport des lipides (cholestérol inclus) de l'intestin vers les autres tissus.
Les lipoprotéines de très basse densité (ou VLDL : very low-density lipoprotein).
La classification tient également compte des apolipoprotéines : Apo A en relation avec les HDL, Apo B en relation avec les LDL. Apo E. On dose également la lipoprotéine(a) pour évaluer le risque vasculaire. Son rôle athérogène découle de sa capacité à se lier fortement à la paroi artérielle. L'augmentation du risque d'athérosclérose est proportionnelle à la concentration circulante de lipoprotéine(a).
Teneur en cholestérol dans l'alimentation
Aliment Teneur en cholestérol (mg/100 g) Aliment Teneur en cholestérol (mg/100 g) cervelle de veau 2 200 ris de veau 225 jaune d'œuf 300 crème 124 rognons de mouton ou de veau 380 poulet 90 à 100 rognons de porc 365 fromage 50 à 100 foie de porc 340 veau 84 foie de veau 314 merlan 77 foie de bœuf 265 bœuf 67 beurre 260 poisson 60 à 70
Ces teneurs en cholestérol alimentaire sont à compléter et relativiser par :
les teneurs en acides gras saturés (pouvant augmenter les taux en LDL) et insaturés trans (pouvant augmenter les taux en LDL et baisser les taux en HDL) ;
les teneurs en acides gras mono-insaturés et poly-insaturés ;
l'apport alimentaire d'antioxydants (par exemple vitamine E, vitamine C, β-carotène) pouvant limiter l'accumulation des LDL dans la paroi artérielle.
Le tableau montre que toutes les viandes, mêmes maigres (abats, poulet, etc.) sont sources de cholestérol, en particulier les abats.
Le cholestérol présent dans les VLDL et LDL provient en effet des tissus (où il est excédentaire) qui l'ont synthétisé, et nullement des chylomicrons (structure de transport des lipides provenant de l'intestin). Limiter les apports alimentaires de cholestérol, ou son absorption au niveau de l'intestin (au travers de l'absorption intensive de phytostérols, par exemple), pour un individu ne souffrant pas d'hypercholestérolémie familiale, n'a par conséquent que peu d'effet prévention-santé.
Anomalies du dosage sanguin chez l'être humain
Le dosage du cholestérol sanguin se fait de manière traditionnelle chez un patient à jeun mais son taux global ainsi que sa fraction HDL ne sont pas modifiés de manière importante par le jeûne. En médecine préventive, la Fédération française de cardiologie recommande de surveiller son taux de cholestérol à partir de dix-huit ans et tous les cinq ans.
Hypercholestérolémie et athérosclérose
Dès le début du XX siècle, les travaux d’Anitschkow et Chalatow avaient permis de mettre en évidence un rôle du cholestérol dans l’athérosclérose expérimentale chez le lapin, en le nourrissant de graisses animales. Aujourd'hui, plusieurs études proposent que l’athérosclérose soit une maladie inflammatoire et qu'un marqueur de cette maladie soit probablement le cholestérol associé aux LDL après oxydation. Parallèlement, plusieurs études ont mis en évidence un lien entre hypercholestérolémie et présence d’une réaction inflammatoire dans le tissu vasculaire.
L'épidémiologie a montré une corrélation entre taux de cholestérol sanguin et risque de survenue de maladies cardio-vasculaires. Ce taux est inclus dans plusieurs méthodes de calcul de ce risque (« échelle de risque ») mais pas dans toutes.
Le troisième argument en faisant un facteur de risque cardio-vasculaire est l'existence d'essais cliniques de prévention primaire et secondaire chez les sujets hypercholestérolémiques qui ont démontré qu’il était possible de réduire la fréquence des cardiopathies ischémiques en diminuant le cholestérol associé au LDL à l’aide de statines. Cependant d'autres études qui ont diminué le taux de cholestérol n'ont cependant pas montré de réduction de la mortalité globale (étude Helsinki avec le gemfibrozil, étude indépendante ALLHAT, étude LRC-CPPT, étude AFCAPS/TexCAPS) ou ont augmenté la mortalité globale (étude OMS-WHO avec le clofibrate, étude ILLUMINATE avec le torcetrapib). De plus, les statines sont efficaces, quel que soit le niveau de cholestérol initial, et le niveau du cholestérol n'entre pas dans les critères d'entrée de la plupart des études. Les statines jouant manifestement sur d'autres facteurs, se pose la question de savoir si le bénéfice est uniquement dû à la baisse du cholestérol. Quelques chercheurs, comme Michel de Lorgeril et Uffe Ravnskov, ont ainsi remis en question « l'hypothèse lipidique » d'Ancel Keys, selon laquelle l'excès de consommation de graisses saturées et le cholestérol seraient les principaux responsables des maladies cardio-vasculaires.
D'autres facteurs influencent cependant le risque vasculaire, et jouent sur le taux de cholestérol. Ils rendent les données difficiles à interpréter : ainsi, l'activité physique régulière, l'alcool (à faible dose) et les œstrogènes pourraient contribuer à augmenter le taux de HDL, limitant le taux de cholestérol sanguin et améliorant la protection vasculaire.
Inversement, le tabac, l'obésité et l'inactivité diminuent le taux de HDL sanguin, augmentant le risque cardio-vasculaire.
Du point de vue diététique, les éléments a priori importants de ce point de vue, sur lesquels le régime peut jouer, sont les lipides et les glucides.
Dans les années 1950-1960, l'Américain Ancel Keys développe « l'hypothèse lipidique » faisant un lien statistique (de corrélation) entre le taux de cholestérol sanguin et le risque de maladie cardio-vasculaire.
Une diminution des graisses animales est souhaitable : parmi les régimes testés, le régime méditerranéen abaisse effectivement le cholestérol et diminue le risque cardiaque, mais ces régimes jouent aussi sur d'autres facteurs (obésité, diabète, etc.).
Le régime Low-carb est contre-productif : les régimes uniquement pauvres en sucres (dits « low-carb ») semblent inefficaces à moyen et long terme, et dangereux ; ils augmentent le cholestérol et le risque cardiovasculaire selon une étude suédoise longue (vingt-cinq ans), lancée en 1986 au nord de la Suède dans une région au risque cardiovasculaire élevé (comté de Västerbotten). Cette étude est associée à un programme anti-obésité qui a permis dans un premier temps de diminuer les apports lipidiques moyens. Mais cette diminution a été suivie d'une stagnation (1992 à 2002) et d'une réaugmentation (jusqu'à un dépassement du niveau de 1986). Par contre la consommation de sucres a fortement baissé (après une hausse observée jusqu'en 1992), ce qui traduit selon les auteurs une appropriation par la population des régimes très médiatisés « low-carb » qui promeuvent de manger autant de lipides et protéines qu'on le souhaite mais en réduisant drastiquement l'apport en sucres. Ces régimes « low-carb » ont en fait augmenté la cholestérolémie moyenne (qui avait chuté au début du programme quand la consommation de lipides diminuait). Le poids moyen des habitants a en outre continué à augmenter de 1986 à 2012, malgré une perte effective mais provisoire de poids en début de régime. Et la consommation de vin qui a (dans le panel suivi) augmenté de 1986 à 2010 (au détriment des alcools forts, avec augmentation parallèle mais moindre de la consommation de bière, uniquement chez les hommes) ne semble avoir eu aucun effet (chez l'homme ou la femme) sur la cholestérolémie ni sur le risque cardiovasculaire. En outre la cholestérolémie augmente depuis les années 2000 malgré une augmentation significative de médicaments visant à la faire diminuer.
Défaut de synthèse
La chondrodystrophie calcifiante congénitale est une maladie génétique provoquant une altération du fonctionnement de la 3-β-hydroxystéroïde-δ(8), δ(7)-isomérase, une enzyme impliquée dans la synthèse du cholestérol.
Le syndrome de Smith-Lemli-Opitz est une maladie génétique provoquant un déficit en 7-déhydrocholestérol réductase, l'enzyme responsable de la dernière étape de la synthèse du cholestérol.
Prix Nobel concernant le cholestérol
L'étude de cette molécule a souvent été récompensée par des prix Nobel :
en 19**, Konrad Bloch et Feodor Lynen reçurent le prix Nobel de médecine pour « leur découverte concernant le mécanisme de régulation des métabolismes du cholestérol et des acides gras » ;
en 1965, Robert Burns Woodward reçut le prix Nobel de chimie pour « ses exceptionnelles réalisations dans l'art de la synthèse organique ». Il a été le premier à réaliser la synthèse chimique du cholestérol et de la cortisone en 1951 ;
en 1985, Michael S. Brown et Joseph L. Goldstein reçurent le prix Nobel de médecine pour « leur découverte portant sur la régulation du métabolisme du cholestérol ».

 词典释义:
词典释义:
 酶
酶
 酰酶
酰酶