La tomodensitométrie (TDM), dite aussi scanographie, tomographie axiale calculée par ordinateur (TACO), CT-scan (CT : computerized tomography), CAT-scan (CAT : computer-assisted tomography), ou simplement scanner pour l'appareil, est une technique d'imagerie médicale qui consiste à mesurer l'absorption des rayons X par les tissus puis, par traitement informatique, à numériser et enfin reconstruire des images 2D ou 3D des structures anatomiques. Pour acquérir les données, on emploie la technique d'analyse tomographique ou « par coupes », en soumettant le patient au balayage d'un faisceau de rayons X.
Bien que la possibilité théorique de créer de tels appareils ait été connue depuis le début du XX siècle, ce n'est qu'au début des années 1970 qu'apparaissent les premiers imageurs couplés à ou « assistés » par des ordinateurs suffisamment puissants pour être capables de réaliser rapidement les calculs nécessaires à la reconstruction des images. Pour la mise au point de cette technique, Godfrey Newbold Hounsfield et Allan MacLeod Cormack ont été récompensés par le Prix Nobel de physiologie ou médecine en 1979.
Dans les appareils modernes, l'émetteur de rayons X (tube à rayons X) effectue une rotation autour du patient en même temps que les récepteurs situés en face, et qui ont pour fonction de mesurer l'intensité des rayons après qu'ils ont été partiellement absorbés durant leur passage à travers le corps. Les données obtenues sont ensuite traitées par ordinateur, ce qui permet de recomposer des vues en coupes bidimensionnelles puis des vues en trois dimensions des organes. On peut faire ressortir le contraste de certains tissus, en particulier des vaisseaux sanguins, en injectant un produit dit « de contraste » (un complexe de l'iode) qui a la propriété de fortement absorber les rayons X et donc de rendre très visibles les tissus où ce produit est présent (qui apparaissent alors hyperdenses, c'est-à-dire plus « blancs » sur l'image). Grâce aux tomodensitomètres multidétecteurs (ou multi-barrettes) à acquisition spiralée (déplacement lent de la table d'examen durant l'acquisition), on obtient depuis les années 1990 une exploration très précise d'un large volume du corps humain pour un temps d'acquisition de quelques secondes.
Comme pour toute radiographie, l'exposition répétée aux rayons X peut être nocive pour l'organisme, mais le rapport bénéfice/risque lié à l'irradiation penche largement en faveur de la tomodensitométrie, lorsque la demande d'examen est justifiée, ce qui en fait une technique d'imagerie médicale de plus en plus pratiquée. L'imagerie par résonance magnétique (IRM), technique non irradiante utilisant les champs magnétiques, représente une solution de remplacement ou un complément pour certaines applications mais ne peut pas remplacer l'imagerie scanographique dans toutes les indications.
Historique
Le principe de la tomodensitométrie repose sur le théorème de Radon (1917) qui décrit comment il est possible de reconstruire la géométrie bidimensionnelle d'un objet à partir d'une série de projections mesurées tout autour de celui-ci. Cette méthode peut être étendue à la reconstruction de la tomographie interne d'un objet à partir de la façon dont les rayons le traversant sont absorbés suivant leurs angles de pénétration. Toutefois, les calculs nécessaires à cette technique la rendaient impraticable avant l'avènement des ordinateurs. L'ordinateur attribue à chaque pixel d'image une valeur d'échelle de gris proportionnelle à l'absorption des rayons X par le volume corporel correspondant. La densité mesurée en unités Hounsfield (UH) va de -1000 pour l'air à +1000 pour l'os dense cortical, en passant par -50 pour la graisse et 0 pour l'eau.

Le premier scanner à rayons X a été mis au point au début des années 1970 par un ingénieur britannique travaillant dans un laboratoire financé par EMI, Godfrey Newbold Hounsfield, d'après les travaux publiés quelques années auparavant par un physicien américain, Allan MacLeod Cormack. Ces deux savants ont ainsi obtenu le Prix Nobel de physiologie ou médecine en 1979 pour le « développement de la tomographie axiale calculée ».
Les premiers prototypes de tomodensitomètre ne permettaient d'« imager » que le cerveau au moyen d'une série de capteurs ou détecteurs disposés en arc de cercle autour de la tête. Pour réaliser une seule image sur ces appareils, il fallait acquérir le signal pendant plusieurs minutes. L'ordinateur auquel ils étaient couplés nécessitait deux heures et demie pour traiter chaque coupe ou tomographie. Ces images tomodensitométriques du cerveau permirent de visualiser, pour la première fois en imagerie, le tissu cérébral et les ventricules remplis de liquide céphalo-rachidien. Les appareils suivants permirent ensuite de produire des images de toutes les parties du corps humain. D'une matrice grossière de 80×80, on est passé rapidement à des pixels plus petits, jusqu'à une résolution d'images de 512×512.
Les différents types d'appareils
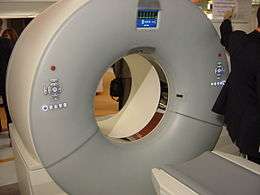
Les anciennes générations de scanners à acquisition séquentielle ne permettaient d'acquérir que des coupes successives isolées : la table mobile sur laquelle le patient est étendu était déplacée de quelques millimètres dans la structure circulaire ou anneau (gantry) puis immobilisée pendant la mesure, et ainsi de suite pour chaque niveau d'acquisition assimilé à une coupe transversale. Les anciennes générations de tubes à rayons X avaient en outre une capacité d'évacuation de la chaleur trop faible pour être compatible avec une cadence d'acquisition élevée.
Dans les scanners spiralés ou hélicoïdaux disponibles depuis les années 1990, l'émission des rayons X est continue durant toute la séquence, la table d'examen progressant à vitesse constante et fixée (pas ou pitch en anglais) dans l'anneau. La réalisation de l'examen est beaucoup plus rapide (de quelques centaines de millisecondes à quelques secondes), et plus confortable dans beaucoup de cas (apnée de quelques secondes pour les examens thoraciques, au lieu de plusieurs apnées correspondant à chaque coupe) et fournit une meilleure qualité d'images. La durée de révolution du tube émetteur est passée de 2 secondes à 0,275 seconde sur les appareils de dernière génération. Les acquisitions rapides ont permis le développement de l’angioscanner, technique non invasive d'exploration des vaisseaux sanguins durant le court temps de transit vasculaire du produit de contraste après son injection intraveineuse, supplantant l'angiographie invasive dans maintes indications à visée diagnostique.
Le Scanner multi-barrettes associe, à la technique hélicoïdale, un nombre de capteurs plus importants (de deux barrettes ou rangées de détecteurs sur le premier modèle de 1993, jusqu'à 320 barrettes actuellement, permettant des coupes plus fines et l'accession à la reconstruction tridimensionnelle de structures de taille réduite (artères coronaires ou osselets de l'oreille moyenne, par exemple). La dose d'irradiation qui en résulte est néanmoins nettement supérieure aux premières générations.
Le Scanner double tube (ou Scanner spectral) (Somatom Definition (2005) et Somatom Definition Flash (2009) de Siemens) est le premier scanner à double source mettant en œuvre une technologie dans laquelle deux sources de rayons X disposées à angle droit l’une par rapport à l’autre offre une vitesse d’acquisition (pitch 3,4, c'est-à-dire 458 mm/s) et une résolution temporelle (75 ms) deux fois plus élevée. Il est également possible d'utiliser les deux tubes simultanément à des énergies différentes (double énergie DE), ce qui ouvre de nouveaux domaines d'utilisation, comme l’évaluation de la composition des calculs rénaux, la réduction des artefacts métalliques, l'évaluation de la perfusion pulmonaire et myocardique ou bien encore la soustraction automatique des os et du produit de contraste.
Réalisation de l'examen tomodensitométrique
L'examen standard peut être fait dans toute circonstance, à condition que le patient puisse être immobile sur la table une dizaine de secondes. Il n'y a pas de nécessité d'être à jeun sauf rares explorations particulières. En cas de grossesse, la justification (indication) de l'examen et son rapport bénéfice sur risque doivent être soigneusement évalués, du fait de la sensibilité particulière du fœtus à l'irradiation, particulièrement en tout début de grossesse.
L'examen peut nécessiter une injection intraveineuse d'un produit de contraste iodé. On s'assure que le patient a une fonction rénale correcte (taux sanguin de créatinine, et débit de filtration glomérulaire ou clairance de la créatinine normaux) et qu'il n'existe pas d'antécédent personnel d'allergie à un produit de contraste iodé. Dans le cas contraire, soit l'examen est réalisé sans produit de contraste, soit l'examen est remplacé par une autre technique, soit il est reporté le temps que le patient se soit soumis aux tests d'allergologie, soit un traitement à visée préventive anti-allergique est administré au préalable par voie intraveineuse en cas d'examen urgent et sous haute surveillance. De plus, pour éviter une possible insuffisance rénale, le patient diabétique traité par des médicaments à base de metformine ou biguanides doit interrompre ce traitement anti-diabétique oral durant les 48 heures suivant l'administration de produit de contraste iodé, et le reprendre après vérification de l'absence d'apparition d'une insuffisance rénale. Il est recommandé pour tout patient, sauf contre-indication particulière, de bien s'hydrater par voie orale les heures précédant et la journée suivant l'examen.
Une voie d'abord veineuse (cathéter court) est mise en place avant l'examen et le produit de contraste est injecté peu de temps avant l'acquisition. Au moment de l'injection du produit de contraste iodé (environ 70 % des examens), la majorité des patients ressentent une sensation de chaleur au niveau de la gorge et du pelvis, qui dure environ 10 à 30 secondes et qui est liée à la vasodilatation provoquée par l'hyper-osmolarité du produit.
Durant l'acquisition, les images sont visualisées sur une console informatique par le manipulateur en électroradiologie médicale et par le médecin radiologue.
Simultanément, le radiologue reçoit sur sa console de visualisation et de traitement l'ensemble des données acquises (de 150 à plus de 2 000 images).
Celles-ci se présentent sous la forme de « coupes » ou tranches d'épaisseur millimétrique (de 0,4 mm à 10 mm) que le radiologue peut étudier dans tous les plans de l'espace (sagittal, axial, coronal et obliques), et qu'il s'agit de post-traiter (augmentation de l'épaisseur des coupes visualisées, mise en valeur de certaines densités, reconstructions volumiques en 3D, extraction des vaisseaux ou des structures osseuses, navigation virtuelle endoscopique, etc.).
Les images sont transmises au correspondant soit sous forme de films radiologiques ou imprimées sur papier (dans ce cas il s'agit d'une sélection d'images dites pertinentes), soit sous format numérique, c'est-à-dire sous forme de fichiers informatiques gravés sur un support CD-ROM ; le format d'image couramment utilisé est le format « médical » DICOM nécessitant un logiciel de visualisation simple gravé avec le CD, mais parfois les images sont converties au format JPEG pour permettre la visualisation sommaire sur tout ordinateur.
Complications et précautions
La tomodensitométrie est un examen en théorie anodin. Il existe néanmoins quelques rares contre-indications liées à l'injection éventuelle de produit de contraste iodé : insuffisance rénale, contre-indication médicamenteuse (notamment les médicaments anti-diabétiques de type II comme la metformine), allergie avérée à un ou plusieurs produits de contraste iodés, l'allaitement et bien évidemment en cas de grossesse (sauf cas particulier comme la pelvimétrie prénatale ou s'il existe une urgence vitale) .
Les jeunes enfants, avant quatre ans, ont souvent du mal à conserver l'immobilité et nécessitent une prémédication sédative ou une contention dans un matelas adapté.
Chez les patients anxieux ou très agités non coopératifs, une prémédication anxiolytique ou sédative (on administre des médicaments pour réduire l'anxiété ou provoquer un sommeil court et léger) voire une brève anesthésie, permettent la réalisation de l'examen.
Durant la grossesse, il faut éviter de principe l'exploration du pelvis ou l'utilisation de produit de contraste iodé mais le rapport bénéfice/risque doit être apprécié au cas par cas.
Lors d'utilisation de produits de contraste iodés
Le risque est celui d'une allergie au produit de contraste allant de la simple réaction cutanée (urticaire) au choc anaphylactique engageant le pronostic vital. Pour cette raison, on privilégie les produits de contraste iodés dits « non-ioniques », et le patient ayant bénéficié d'une injection de produit de contraste iodé est gardé en surveillance quelque temps après l'administration du produit. La seule prévention raisonnablement sécurisée est de proscrire définitivement l'administration du produit de contraste particulier qui a provoqué chez un patient une réaction adverse de type allergique. En pratique, on recommande de faire pratiquer des tests d'allergie par un allergologue, qui testera tous les produits de contrastes disponibles sur le marché et indiquera dans ses conclusions s'il apparaît que le patient réagit anormalement ou non à telle ou telle préparation. Le médecin radiologue évaluera le rapport bénéfice/risque vis-à-vis des produits auxquels le patient n'aura pas réagi anormalement, sachant qu'une allergie peut apparaître ultérieurement à un produit jusqu'alors jugé sans risque.
Les produits de contraste iodés étant néphro-toxiques, il existe également une possible aggravation d'une insuffisance rénale préexistante. Les risques sont majorés en cas de diabète et de défaut d'hydratation.
Irradiation
Le risque est celui de développer un cancer à distance de l'examen.
L'irradiation de la population par les rayons X utilisés en imagerie médicale a été multipliée par six aux États-Unis en un peu moins de 25 ans, la moitié des doses administrées étant imputée aux tomodensitomètres. En France, elle a augmenté de 50 % entre 2002 et 2007. L'augmentation de ces doses s'explique principalement par trois raisons : changement de nature des actes (augmentation du nombre de scanners thoraciques qui sont les plus irradiants), augmentation des doses pour obtenir une image plus contrastée, banalisation de l'acte de radiodiagnostic.
Certains types d'examens, par la multiplicité des coupes requises, sont particulièrement irradiants comme le scanner des artères coronaires dont la dose peut atteindre, dans certains cas, 600 fois celle d'une simple radiographie pulmonaire. Un examen complet du corps expose l'individu concerné à 20 mSv en une seule fois, soit l’équivalent de la dose de rayonnements maximum recommandée annuellement pour les salariés du nucléaire.
Le risque individuel d'une telle exposition n'est pas nul et chaque indication d'examen doit donc être soigneusement pesée suivant le bénéfice attendu (directives de radioprotection). Ce risque peut être néanmoins estimé par des modélisations ; la presse rapportait en 2010 qu'au moins 400 patients aux États-Unis avaient été exposés à une sur-irradiation lors d'examens CT de perfusion du cerveau. Il peut être également quantifié statistiquement : il est d'autant plus élevé que le scanner a été réalisé chez un sujet jeune (enfant ou adolescent), avec un nombre de cancer augmenté de près d'un quart sur dix ans. Ces chiffres devraient cependant diminuer, l'irradiation étant moindre qu'il y a quelques années.
Autres usages
La tomographie peut être utilisée pour examiner des objets anciens, le contenu à risque de contenants fermés (tableaux d'art, cercueils à momies etc.). Ou encore l'intérieur de morceaux d'arbres pour y observer les structures internes et épicormiques. Des recherches suisses cherchent à engager la tomodensitométrie dans les scieries, afin d'optimiser les découpes. En passant une grume au travers d'un CT, il est possible de visualiser les nœuds internes du bois, et ainsi de procéder au sciage de manière à réduire les faiblesses des planches par un ajustement de leur position par rapport aux branches. Cette méthode n'est de loin pas encore généralisée, car très onéreuse.
计算机断层成像(Computed Tomography,又称为“电脑断层扫描”,简称CT),是一种影像诊断学的检查。这一技术曾被称为计算机轴向断层成像(Computed Axial Tomography)。
X射线计算机断层成像(X-Ray Computed Tomography,简称X-CT)是一种利用数字几何处理后重建的三维放射线医学影像。该技术主要通过单一轴面的X射线旋转照射人体,由于不同的组织对X射线的吸收能力(或称阻射率)不同,可以用电脑的三维技术重建出断层面影像。经由窗宽、窗位处理,可以得到相应组织的断层影像。将断层影像层层堆叠,即可形成立体影像。
诊断应用
自从20世纪70年代被发明后,X射线计算机断层成像在医学影像上已经变成一个重要的工具,虽然价格昂贵,它至今依然是诊断多种疾病的黄金准则。X射线计算机断层成像技术的优点之一是它可以提供很高的空间分辨率(0.5 毫米)。它的一个弱点是软组织对比度较差。当诊断对软组织对比度要求较高时,核磁共振影像技术要优于X射线计算机断层成像技术。 头部断层检查 主要用来诊断脑部血管病变以及颅内出血,检查不一定要用到显影剂。在病人有急性中风的情形下,它虽然没办法排除血管阻塞的可能性,但是可以排除出血的可能性。如此一来,抗凝血剂就可以大胆地应用。在诊断肿瘤的应用上,电脑断层配合静脉显影的检查并不常用,而且效果也比核磁共振影像(MRI)差。它也可以用来诊断颅内压是否有增加,例如要做腰椎穿刺或是评估脑室腹腔分流术时。 X射线计算机断层成像在诊断有外伤的颅骨及颜面骨的骨折也有很大的用处。在头颈口的部位,对于头骨和颜面骨或是牙齿的畸形,它有术前评估的作用;下颚、副鼻窦、鼻腔,眼框等部位所生囊肿或是肿瘤的评估;慢性鼻窦炎成因的诊断;还有植牙重建的评估。 胸腔断层检查 在肺部组织的诊断上,X射线计算机断层成像对于急性或是慢性的变化都有很高的诊断价值,在观察一些人体内空气的变化,例如肺炎或是肿瘤,一般不需显影剂就有很好的效果。而一些间质组织的变化(肺实质,肺纤维等等),可以用薄切面的高解析设置来重建;而要评估纵隔腔和肺门部分的淋巴腺肿大,则需要静脉显影。 胸腔断层血管摄影(CTPA)是一个需要用精确快速的时间来作对比剂注射再加上高速的螺旋式描扫器才能完成的检查,近来也用在作肺栓塞和动脉剥离的评估。当胸腔x光检查出现异常或是怀疑异常等,只要是非急性的,电脑断层都是首推的进一步检查。 心脏断层检查 随着较先进的X射线计算机断层成像仪旋转时间的减少,再加上多断层(高达128切)切面的技术,要同时达到高速度和高分辨率不再是梦想。目前已经可以清楚地看见冠状动脉的影像。在扫描的同时,电脑就可以将一连串的数据重建,如此一来,每单一个心脏断层影像的数据都可以在x光管回转完成前重建完成。但未来是否能取代侵入性检查「冠状动脉导入检查」还是未知数。 心脏的多断层切面检查(Multi-slice Computed tomography,简称MSCT)有相当性的潜在危险,因为它的剂量相当于500张的胸腔x光,对于乳癌的潜在诱发性目前还有待商榷。诊断为阳性的正确率大约82%,诊断为阴性的正确率大约93%;敏感度大约81%,特异性为94%。 双射源X射线计算机断层成像机有相当高的时间分辨率(Temporal Resolution),可以减少高速心跳造成的移动假影,闭气的时间也不用长,对于不方便闭气的病人或是不适合打降低心率药的病人是很有帮助的。 腹部和骨盆的断层检查 对于腹部的疾病,X射线计算机断层成像的诊断价值极高,常用来定位肿瘤期数也用来做后续的追踪,对急性腹痛的检查也很有用。泌尿结石,阑尾炎,胰脏炎,憩室,腹部动脉瘤还有肠阻塞等都是可以由电脑断层做快速诊断的疾病,它也是第一线用来诊断内部脏器外伤的利器。 口服或是直肠对比剂可视需要使用,稀释的硫酸钡(2% w/v)是最常用的,一般用来作大肠透视检查的钡剂浓度太高,在断层影像上反而是假影,如果钡剂有禁忌上的考量的话(例如怀疑病人是肠受伤),碘对比剂也是选择之一,其他种类的就看目标是要对哪一个器官显影,例如直肠的空气对比剂(空气或二氧化碳)用在大肠检查,或是口服纯水用在胃部检查。 电脑断层在诊断骨盆的应用上有限制,特别是女性的骨盆,超音波是一个替代方案。除此之外,它也可以部分应用在腹部扫描(例如看肿瘤),在评估骨折上也有用处,它也可以用在研究骨质疏松症,和骨质密度侦量仪一样,此两样都能侦测骨矿物质的密度(BMD),也就是骨强度的指标,然而电脑断层的结果不一定和骨密仪一样(BMD测量黄金准则),不但贵,病人接受的剂量又高,所以不常使用。 四肢的检查 前臂X射线计算机断层扫描(CT) 图像的立体渲染(肌肉、脂肪、骨骼和血液分别采用了不同的配色方案) X射线计算机断层成像常用来显示复杂的骨折,特别是节关附近的骨折,主要是因为它可以将想要看的地方重建出来。
优点和危险性
优于X光影像的部分 首先,X射线计算机断层成像为医生提供器官的完整3D消息,而X光影像只能提供多断面的重叠投影;第二,由于电脑断层的高分辨率,不同组织阻射过所得的放射强度(Radiodensity)即使是小于1%的差异也可以区分出来;第三,由于断层成像技术提供三维图像,依诊断需要不同,可以看到轴切面,冠状面,矢切面的影像,我们称它为多平面数字重建(Multi-planar reformatted imaging)。除此之外,任意切面的图像均可通过插值技术产生。这给诊断和科研带来了极大的便利。 辐射剂量 X射线计算机断层成像被视为中度至高度辐射的诊断技术,虽然技术的进步已经增加了辐射的效率,但是同时为了增加影像品质或为了更复杂的技术,还是有增加剂量的考量,进化过的分辨率使电脑断层可以进行新的研究,可以有更多的优点:例如和传统血管摄影比,电脑断层血管摄影可以避免插入静脉管和静脉导管;电脑断层大肠摄影也和大肠钡剂摄影一样用来诊断肿瘤,但是剂量更低。其方便性以及可适用的情形不断增加,使它日渐普及,最近在英国的综合评估中,电脑断层占了所有放射性检查的7%,但是在2000/2001年间,它占了总合医疗放射剂量的47%(Hart & Wall, European Journal of Radiology 2004;50:285-291),过度地使用电脑断层检查,不管其他地方怎么灭,还是会导致总体医疗剂量的上升,在一些特别研究放射剂量的论文还有考量很多因子:扫描的体积,PATIENT BUILD,扫描的数量和型式,还有需要的分辨率和影像品质。 对比剂的负面反应 由于X射线计算机断层成像相当依赖静脉注射的对比剂来显影,所以有潜在的危险,危险虽低,却无法完全避免,这可能会使某些病人的肾脏受伤,有肾功能衰竭或糖尿病等病史的病人(另外还有REDUCED INTRAVASCULAR VOLUME)危险性可能更高。
扫描剂量
检查 对全身的典型有效剂量 (毫西弗) 对器官的典型吸收剂量 (毫戈雷) 全年背景辐射值 2.4 2.4 胸部X光 0.02 0.01–0.15 头部CT 1–2 56 有隔离的乳腺X光检查 0.4 3 腹部CT 8 14 胸部CT 5–7 13 CT结肠镜检查 6–11 胸,腹和骨盆CT 9.9 12 心血管CT 9–12 40–100 钡剂灌肠摄影 15 15 新生儿腹部CT 20 20 辐射剂量单位 从事
影像处理
X光断层面的数据是由X光射源绕物体一圈得来,感应器是放置于射源的对角位置,随着物体慢慢地被推入内侧端,数据也不断地处理,经由一系列的数字运算,也就是所谓的断层面重建来得到影像。 窗宽 所谓的窗宽(windowing)就是指用韩森费尔德(发明者)单位(Hounsfield Unit,简称HU)所得的数据来计算出影像的过程,不同的的放射强度(Raiodensity)对应到256种不同程度的灰阶值,这些不同的灰阶值可以依CT值的不同范围来重新定义衰减值,假设CT范围的中心值不变,定义的范围一变窄后,我们称为窄窗位(Narrow Window),比较细部的小变化就可以分辨出来了,在影像处理的观念上,我们称为对比压缩。例如我们为了要在腹内找出肝肿瘤的细微变化,就要用肝窗位,假设70HU是肝脏的平均值(称为肝窗位),我们就可以在更窄的窗宽内重新定义范围,窗位(Window)定为70HU,85HU为上,85HU为下,如此一来范围就是-15HU到+155HU,低于-15HU的指就显示全黑,高于+115HU的指就显示为全白,同理,骨的窗位就要用宽窗位(Wide Window),主要是考虑到含有脂肪的髓腔内的髓质还有外层致密骨,当然HU的中心值就大约要用百位的数字了。
三维重建
三维重建指用数学的方法从断层成像仪测量到的信号(X射线通过人体后的衰减)恢复(重建)出器官的三维影像。最简单的,也是最早的,重建方法是反投影法(backprojection)。反投影法虽然直观上很容易理解,但它在数学上是不正确的。目前常用的重建方法主要有两种:滤波反投影法(filtered backprojection)和卷积反投影法(convolution backprojection)。
图像显示
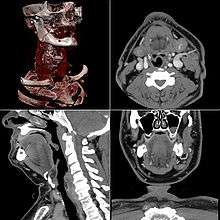
由于目前的X射线计算机断层成像都是等方性(x,y,z轴的分辨率都一样)或是接近等方性的分辨率,显示的方式不一定只限于横切面,所以,借着软件的帮忙,只要把所有的小体素堆叠起来,就可以用不同的视点来看影像。 多层面重建MPR(Multi-Planar Reconstruction) 这是重建最简单的方式,是把所有的横切面数据堆叠起来,软件可以用不同的平面来切割物体(大部分是垂直面),或是特别的一些影像例如最大强度投射成像MIP(Maximum-Intensity Projection)或是最低强度投射成像mIP(Mininum-Intensity Projection)。 多层面重建最常用来检查脊椎,因为轴切面的影像只限于有时才能显出椎体,也无法完全秀出椎间盘,经由重组影像,我们可以更容易观察出脊椎的位置以及其和其他器官的关系。 现代的软件可以重建斜位的影像,所以经由自由的选择平面,我们可以看到想看的解剖构造,比如支气管不是垂直的,我们可以借由这个技术达到我们要的目的。 在血管的影像上,弯曲的平面也有办法重建。这使得弯曲的血管可以被「拉直」,如此整条血管可以用一张影像或是少数影像就可以完全显现,一旦血管被拉直后,量化的长度和宽度就测量出来,对于手术和侵入性治疗的帮忙不小。 MIP重建加强了高射束的区域,用在血管摄影很有用,mIP重建趋向于加强空气的显示,用来评估肺部结构很有用。 三维呈像技术(3D rendering techniques) 表面呈像(surface rendering) 放射强度(Radiodensity)的阈值是可以调整的(例如对应于骨头的值),当阈值一定,便可使用「边缘侦察(edge detection)」影像处理法,如此一来,一个三维的物体就可以呈像了,不同的物体可以用不同的阈值呈像,使用不同的颜色来代表不同的解剖构造,例如骨,肌肉和软骨,然而,在这个基础下,再深一层的构造可能就无法显像了。 体素呈像(volume rendering) 表面呈像只限于在一定的阈值下,表现物体的表面像,也止于呈现接近我们想像的表面,而在体素呈像中,利用透明度和颜色可以在单一影像中的特色,就可以呈现更多的东西,例如:骨盆就可以用半透明的方式显现,那么即使是斜位角,小部分其他的解剖呈像并不会挡住其他重要的部分。 影像分割(Segmentation) 有一些部位虽然结构不同,但是有相似的阻射性,只是单纯地改变体素呈像的参数可能不是这么简单就可以区分它们,解决的方式我们称为影像分割(segmentaion),就是用手动或是自动的方式去除我们不想要的部分。 例子 下面是一些脑部X射线计算机断层成像的影像,骨头的部分比周围的地方白(白代表高阻射率),血管处(箭头)比较亮是因为使用了碘对比剂的关系。
历史
第一个商业化的X射线计算机断层成像系统是由Godfrey Newbold Hounsfiled发明的,地点在英国Hayes的THORN EMI Central Research Laboratories,Hounsfield在1967年开始了他的想法,于1972正式发表,声称电脑断层是披头四乐团最大的遗产,庞大的利益使得EMI投资了研究计划。另一头,TUFTS大学的Allen Mcleod Cormack独立研发了类似的处理进程,地点是University of Cape Town/Groote Schuur Hospital,他们于1979年一起获得诺贝尔奖。 1971所产的原型是行经180度角取160个平行读数,每个是一度,每次扫描大约费时五分钟,整个影像要产生要花2.5小时并用大型电脑来进行运算。 第一个生产的X射线计算机断层成像扫描仪称为EMI描扫器,只能用来做头部的扫描,但是要花四分钟取数据,七分钟重组完成一个影像,另外它还要用一个装满水的perspex容器,型为头套状,可以包覆整个头,主要是为了减少头部的对比阻射强度相差太大(头骨和头骨外的差异),当时的分辨率不高,只有80*80的画质,第一个EMI扫描仪是安装在英国的wimbledon的atkinson morley's hospital,第一次进行病人头部检查的时间是1972年。 在美国,此机器的售价是390000,第一个是安装在lahey clinic,再来是massachusetts general hospital,还有1973在george washington大学。 第一个任何部位都能检查且不用水头套的电脑断层仪是在goergetown university由robert s.ladley. dds设计。 电脑断层机器的演进 第一代 用如笔头般细的射束打向一个或两侦检器,影像是用translate rotate的方法,将射源和侦检器放置于对侧的位置,两者相对位置不变,再加以旋转。在EMI扫描仪时代,一对影像须要旋转180度,耗时四分钟,使用三个侦检器(其中一个是射源位置的参考),每个侦检器都是由碘化钠闪砾器和光电倍增管组成,部分的病人很不能适应这些早期的机器,因为机器的振动和声音都太大了。 第二代 这项设计增加了侦检器的数目,并且改变了射束的形状,把原本的笔头型改为扇型,旋转方式仍为translate rotate,但是扫描时间有明显的减少,旋转量也由每次一度增为每次三十度。 第三代 第三代X射线计算机断层成像在获得影像的时间上有长足的进步,扇形的射束配上一列和射源相对的侦检器,省略了费时的translation stage,最初让扫描时间减少至大约一张十秒钟,这个进行让CT的实用性大大增加,时间短到可以做肺部和腹部的扫描,之前的几代只限于用在头部和四肢,到了第三、四代,病人也明显觉得噪音和振动都少了不少,舒适多了。 第四代 它的设计方法几乎和第三代是同时发明的,表现度也差不多,不用一列的探测器,取而代之的是360度整圈的探测器,用扇型射束旋转打在固定而非旋转的探测器上。 bulky是一项昂贵且脆弱的光电倍增管,所以渐渐地被较好的探测器取代,氙游离腔探测器列曾经用在第三代机器中,也增加了较多的分辨率和敏感度,但最终这两项技术都被固态探测器取代:一个矩形、固态的发光二极管,并镀上萤光的稀土元素磷,它更小,更敏感,更稳定,也更适合第三、四代机器的设计。 早期的四代机器有600个光电倍增管,每个直径1/2吋,可以套在探测环内,以三个发光二极管为单位可以替代一个光电倍增管,这项改变同时增加了取像速度和影像品质,但是扫描的速度仍然不能改善,因为x光管的控制还是用缆线启动,限制了旋转的速度。 一开始,第四代机器有一个重大的进步,就是每转一圈,探测器就会自动校正一次;而三代的几何方式固定,对于没有校正的情形很敏感,也就是有环形伪影产生的可能,另外,四代由于探测器不会移动和振动,校正的运行也较容易。 所有现代的医疗用电脑断层都是以第三代的设计为蓝本,现代的固态探测器相当地稳定,可以不须要每扫一个影像都校正一次,第四代由于探测器经济效益的问题,使得它比第三代贵多了,甚至对假影的敏感度也高,因为没有固定和射源相对的探测器,要去除散射几乎是不可能的事。 第五代 一般指的是所谓的摄影CT(cine-CT);Cine-CT与第四代CT相似,但X光源被置于侦办器的外环;而且为了加快扫瞄的速度,采用多管X光源,依序以不同位置之X光对剖面曝光,以取代旋转功能。系统扫瞄速度因而大大提升,足以扫瞄心跳等动态的剖面图。而真正所谓第五代CT,乃是以大角度阳极X光管,环绕扫瞄剖面与侦测器;利用电子方式控制撞击阳极的电子束,使其发出不同角度的X光束,以达到如同多管X光源的效果。由于电子扫瞄速度极快,每一剖面的扫瞄时间可降至33ms-100ms左右。适用于心导管,做心脏、血管摄影,主要缺点剂量高,价格昂贵。 功能再进化 和取象时间有关要克服的另一问题是X光管。要提供一个长时间和高强度的曝露,需要将非常稳定的输出加到X光管和发电器中。高速回转的阳极也要跟上处像处理的速度,这就需要固定的150kV的SMPS才能趋动它们。目前的动力强度可到100kW。 环刷回转(slip-ring)技术取代了原本缆线的设计,使得X光管和侦检器能连续动作,再加上连续地推移病人进入扫描仪的设计,就是所谓的螺旋式电脑断层。 多层螺旋X射线计算机断层成像(Multi-Detector-Row Computed Tomography,简称MDCT)系统更加快了扫描的速度,它可以同时获取数个影像。目前机器的列数可以达到128列,几秒内就有可能获得完整的胸腔影像。MDCT也使用等方分辨率,可用任意角度重建需要的影像,与核磁共振影像的能力一样,很短时间就可以扫描很大体积的影像是MDCT最大的特色;更重要的是空间分辨率也高了。最新一代的MDCT内在Z轴方向的球管内有浮动的焦板,可以让分辨率更好。 另一个不同的研究方向是用在心脏的断层检查,称为电子光束断层描扫(Electron-Beam Computed Tomography,简称EBCT)。它的时间分辨率高达50微秒。它可以暂停心脏和肺部的动态来形成高品质的影像。开始时只有Imatron公司制造,后来GE公司跟进,鲜有人做,主要是因为它的成本太高,而用途仅只有一项。同期的MDCT的时间分辨率很接近EBCT,但是成本却低得多,因此MDCT就成了市场的趋向。 进化过的电脑技术和组像技术可以运行更快更准确的重组。早期的机器可能需要几分钟才可以做出一张影像;现在30秒钟可以做出1000张影像,精心设计的软件也可以灭少假影。双射源电脑断层(Dual source)使用两个X光管和两排侦检器,使得每张影像只需0.1秒就可以完成。这样就可以得到高品质的心脏影像而不需要使用降低心率的药,例如beta blockers。 双射源的复列侦检器电脑断层可以在10秒的闭气时间内就完成整个心脏的检查。 Volumetric电脑断层是复列侦检断层机的一项延申,仍在研究阶段,目前的MDCT每转一次采样4cm宽的体积,volumetric电脑断层的目标是以256的复列侦检断层仪的原型为基础,增加宽度到10-20cm,未来的应用包括了心脏成像(在两次连续的心跳间就可以取得欲重建完整三维影像所需要的数据)。 微断层摄影(Microtomography) 近几年来,断层摄影也到了微米的等级,名为微断层摄影,但是这些机器目前只适合小物体或是动物,还不能用在人体。

 词典释义:
词典释义:
 】X
】X
 描设备, X
描设备, X
 描器, CT机
描器, CT机
 相术;
相术; 描器;
描器; 描;
描; ,放射
,放射 ;
; 描;
描;