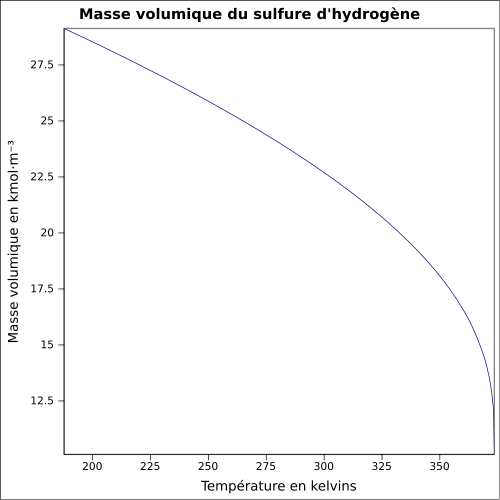
Le sulfure d'hydrogène, ou hydrogène sulfuré, est un composé chimique de formule H2S, constitué de soufre et d'hydrogène. C'est un gaz inflammable, incolore, à l'odeur nauséabonde d'œuf pourri, très toxique, faiblement soluble dans l'eau en donnant un acide faible, l'acide sulfhydrique. Il réagit avec les solutions aqueuses basiques et les métaux tels que l'argent ou l'acier, même inoxydable.
Le sulfure d'hydrogène joue un rôle important en biologie. Il est produit par la dégradation des protéines contenant du soufre et est responsable d'une grande partie de l'odeur fétide des excréments et des gaz, humains et animaux. Il peut résulter de décomposition bactérienne de la matière organique dans des environnements pauvres en oxygène (méthanisation).
Le sulfure d'hydrogène est naturellement présent dans le pétrole, le gaz naturel, les gaz volcaniques et les sources chaudes. Le sulfure d'hydrogène peut également provenir de nombreuses activités industrielles et de boules puantes.
Synthèse
La synthèse du sulfure d'hydrogène peut se réaliser en deux étapes :
en mélangeant du soufre et de la limaille de fer, on réalise un brûlât dans un têt (production d'une fumerolle blanche et âcre), ce qui donne une sorte de caillou orangé (le sulfure de fer FeS) avec des traces grises (la limaille qui n'a pas réagi) ;
en versant n'importe quel acide (de préférence de l'acide sulfurique, mais c'est l'ion hydronium qu'on fait réagir) sur le sulfure de fer obtenu à la première étape, il se produit immédiatement un dégagement intense de sulfure d'hydrogène bien reconnaissable à son odeur qualifiée dans les manuels scolaires de « nauséabonde », qui est celle de l'œuf pourri.
On peut également faire réagir du sulfure d'aluminium, Al2S3 avec de l'eau, ce qui produit, en plus du H2S, de l'hydroxyde d'aluminium.
Utilisations et industrie
Le sulfure d'hydrogène est produit par de nombreuses industries, par exemple dans la transformation des produits alimentaires, le traitement des eaux usées, les hauts fourneaux, la papeterie, la tannerie, le raffinage du pétrole. Il est également présent dans le gaz naturel et le pétrole, desquels il est généralement retiré industriellement avant leur traitement.
En chimie organique, le sulfure d'hydrogène peut être utilisé pour produire des composés organosulfurés tels que le méthanethiol, l'éthanethiol ou encore l'acide thioglycolique.
Il réagit avec les métaux alcalins pour donner des hydrosulfures et des sulfures alcalins, tels que l'hydrosulfure de sodium NaHS et le sulfure de sodium Na2S, qui sont utilisés dans la dégradation des biopolymères. D'une manière générale, le sulfure d'hydrogène réagit avec les métaux pour donner le sulfure métallique correspondant. Cette propriété est mise à profit dans le traitement de gaz ou d'eau contaminés par le sulfure d'hydrogène. La purification de minerais métalliques par flottation, les poudres minérales sont souvent traitées au sulfure d'hydrogène pour accroître la séparation. Les pièces métalliques peuvent également être passivées au sulfure d'hydrogène.
Les catalyseurs utilisés en hydrodésulfuration sont couramment activés par le sulfure d'hydrogène, et ce dernier modifie également le comportement des catalyseurs métalliques utilisés dans d'autres équipements d'une raffinerie.
En chimie analytique, il a joué un rôle important pendant plus d'un siècle pour caractériser les ions métalliques en analyse qualitative non-organique. Dans ce type d'analyses, les ions de métaux lourds (et de non-métaux), tels que Pb, Cu, Hg, ou As, en solution précipitent en présence d'H. Les composants des précipités qui en résultent se dissolvent à nouveau sélectivement.
À l'échelle du laboratoire, le thioacétamide a supplanté le sulfure d'hydrogène comme source d'ions sulfure.
Le sulfure d'hydrogène est utilisés pour séparer l'eau lourde D2O de l'eau normale par le procédé de Girdler.
Corrosion des métaux
Ce gaz peut s'accumuler dans les réseaux d'assainissement et corroder les tuyaux qu'ils soient en béton ou en métal. Il peut faire suffoquer les égoutiers. Lorsqu'il est présent dans le gaz naturel, il corrode les matériels traditionnels tels que les tuyaux, les vannes, etc. Il faut alors remplacer les matériaux usuels par de l'Inconel (en milieu anhydre), ce qui n'est pas sans conséquences sur le prix des installations.
Il attaque également l'argent ; c'est la raison pour laquelle les bijoux argentés noircissent lorsqu'ils sont longuement exposés à l'atmosphère polluée. Le sulfure d'argent résultant de la réaction est de couleur noire.
Effets sur la santé
Le sulfure d'hydrogène est considéré comme un poison à large spectre. Il peut donc empoisonner différents organes. L'inhalation prolongée de sulfure d'hydrogène peut causer la dégénérescence du nerf olfactif (rendant la détection du gaz impossible) et provoquer la mort juste après quelques mouvements respiratoires. L'inhalation du gaz, même en quantité relativement faible, peut entraîner une perte de connaissance.
L'exposition à des concentrations inférieures peut avoir comme conséquence des irritations des yeux, de la gorge, une toux douloureuse, un souffle court et un épanchement de fluide dans les poumons. Ces symptômes disparaissent habituellement en quelques semaines. L'exposition à long terme à de faibles concentrations peut avoir pour conséquence : fatigue, perte d'appétit, maux de tête, irritabilité, pertes de mémoire et vertiges.
Dans certaines conditions, une production endogène de H2S est possible dans l'intestin (ainsi que d'amines, phénols, indoles, thiols, CO2, H2) par les bactéries intestinales ; ces métabolites sont tous toxiques et pourraient jouer un rôle dans certaines maladies intestinales.
Les études sur des animaux ont prouvé que les porcs ayant mangé de la nourriture contenant du sulfure d'hydrogène ont eu des diarrhées après quelques jours et une perte de poids après environ 105 jours.
Mark Roth, biochimiste de l'Université de Washington à Seattle, a montré que des souris inhalant durant quelques minutes une faible dose de sulfure d'hydrogène (80 ppm) perdent connaissance et sont plongées dans un état de vie suspendue, leur température chute de 37 °C à 25 °C environ et leur respiration est ralentie (de 120 à moins de 10 respirations par minute). Leur métabolisme est ralenti et leurs cellules consomment alors moins d'oxygène. Après 6 heures, les souris ont été ré-exposées à un air normal et se sont réveillées en bonne santé. Dans ce cas, les chercheurs n'ont noté aucun effet secondaire évident. Cela laisse penser« qu'il est possible de baisser le niveau métabolique à la demande » selon Roth, qui ajoute que bien que ces découvertes puissent avoir des implications dans le domaine de l'exploration spatiale, son équipe travaille d'abord sur des débouchés médicaux.
Ce pourrait aussi être un moyen de limiter les effets de stress oxydant induit par les radiations lors de vols spatiaux longs. Les blindages anti-rayonnement cosmique sont lourds et couteux, aussi recherche-t-on des alternatives chimiques et biologiques. Des gaz médicaux radioprotecteurs pouvant piéger les radicaux libres sont une piste (le CO, H2, NO, et le gaz H2S sont étudiés dans cet espoir, visant aussi à limiter des maladies impliquant le stress oxydatif (maladies cardiovasculaires ou inflammatoire chronique, hypertension, ischémie, cancer, maladie de Parkinson, maladie d'Alzheimer, cataractes, et vieillissement). Le traitement pourrait passer par l'inhalation de mélanges gazeux ou par l'ingestion d'eau avec des gaz dissous.
Relation odeur-santé
Le seuil de toxicité du sulfure d'hydrogène est de 14 mg⋅m, tandis que son seuil de pe****tion olfactive chez l'homme est de 0,00066 mg·m soit (0.00 4ppm), c'est-à-dire que notre système olfactif est capable de détecter cette substance en très faible quantité. Ceci nous permet d'être alerté avant une absorption pouvant être toxique, à condition que l'accroissement de la concentration de gaz ne soit pas instantanée (cas des poches de gaz dans les réseaux d'assainissement).
Cependant, à partir d'un certain seuil, facile à atteindre (100 à 150 ppm), le nerf olfactif est paralysé et le sujet ne sent plus rien.
Effets du sulfure d’hydrogène sur les humains, selon la concentration
4 ppm : Odeur modérée, facilement détectable
10 ppm : Irritation des yeux
27 ppm : Odeur désagréable
100 ppm : Toux, irritation des yeux, perte de l’odorat au bout de 2-15 minutes
200-300 ppm : Inflammation des yeux et irritation de l’appareil respiratoire au bout d’une heure
500-700 ppm : Perte de conscience et mort éventuelle au bout de 30-60 minutes
800-1 000 ppm : Perte de conscience rapide, arrêt de la respiration et mort
> 1 000 ppm : Paralysie du diaphragme dès la première inhalation, asphyxie rapide
Suicides au Japon
Début 2008, le sulfure d'hydrogène est mentionné dans beaucoup de cas de suicides au Japon.
De janvier à fin mai 2008, 517 personnes se sont donné la mort grâce à une recette trouvée sur internet, mélangeant détergents et produits pour le bain, ce qui produirait du sulfure d'hydrogène en forte quantité. Plusieurs bâtiments ont dû être évacués pour ne pas blesser plus de monde.
Émanations dues aux marées vertes en Bretagne
En juillet 2009, un cheval est mort des suites d'inhalation de sulfure d'hydrogène sur les plages bretonnes. En effet, l'amoncellement important d'algues vertes en décomposition a créé une forte concentration d'hydrogène sulfuré (1 000 ppm) qui s'est révélée mortelle pour l'animal. Le cavalier a été sauvé de justesse. On considère qu'un être humain peut survivre seulement une minute dans un air à 1 400 ppm d'hydrogène sulfuré.
Au mois de juillet 2011, on compte plusieurs dizaines de sangliers morts sur ces mêmes plages bretonnes. Une enquête est en cours, mais l'hydrogène sulfuré a été retrouvé dans les poumons d'au moins cinq d'entre eux.
La formation du gaz H2S à partir des algues vertes ne s'explique pas directement par la présence de nitrates, car ils ne contiennent pas de soufre. Les nitrates sont par contre vraisemblablement la cause de la prolifération des algues, et c'est l'accumulation des algues en forte épaisseur qui est la cause d'une fermentation anaérobique, c'est-à-dire sans air : cette fermentation provoque alors la réduction des sulfates contenus naturellement dans l'eau de mer (environ 2,7 g⋅l) et la combinaison du soufre avec l'hydrogène de l'eau pour former du sulfure d'hydrogène. La Bretagne n'est pas la seule région touchée par la prolifération des algues vertes : on en trouve également en bordure de l'étang de Berre.
Rôle hypothétique dans l'extinction permo-triasique
Peuplée de créatures essentiellement reptiliennes, la Terre connait un bouleversement majeur dû à un réchauffement climatique il y a 250 Ma. Ce réchauffement de l'atmosphère provoque le ralentissement, voire l'arrêt total des courants océaniques qui sont alimentés par la descente en profondeur de l'eau froide aux pôles. L'arrêt des courants océaniques a pour conséquence essentielle la stagnation des océans. Puisque ces courants apportent de l'oxygène et des nutriments nécessaires à la vie marine, la plupart des créatures marines meurent et tombent au fond des océans. La décomposition de ces animaux morts dégage d'énormes quantités de sulfure d'hydrogène qui remontent à la surface et viennent empoisonner l'atmosphère. Les animaux terrestres sont donc affectés et sont aussi décimés. Cette période de la vie terrestre est nommée extinction du Permien. Malgré tout, les causes menant à l'extinction permo-triasique restent mal définies. L'explication du sulfure d'hydrogène reste une hypothèse à corréler à d'autres.
Incident majeur
Lundi 10 novembre 2014, à Moscou, le dysfonctionnement d'un filtre dans une raffinerie voisine a provoqué une forte concentration de gaz dans l'atmosphère, six fois supérieure à la norme. Un épais nuage a enveloppé la ville. Les autorités ont demandé aux habitants de fermer leurs portes et leurs fenêtres pour se prémunir des odeurs désagréables.
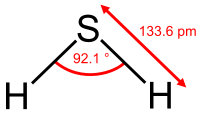
硫化氢是无机化合物,化学式为H2S。正常是无色、易燃的酸性气体,浓度低时带恶臭,气味如臭蛋;浓度高时反而没有气味(因为高浓度的硫化氢可以麻痹嗅觉神经)。能溶于水,0 °C时1摩尔水能溶解2.6摩尔左右的硫化氢。硫化氢的水溶液叫氢硫酸,是一种弱酸;当受热时,硫化氢又从水里逸出。硫化氢是急性剧毒,吸入少量高浓度硫化氢可于短时间内致命。低浓度的硫化氢对眼、呼吸系统及中枢神经都有影响。
分布
硫化氢自然存在于原油、天然气、火山气体和温泉之中。少量的硫化氢在原油中、但天然气可以包含高达90%硫化氢;也可以在细菌分解有机物的过程中产生,或者是一部分的腐败海藻中常见。人体释放出的屁含有极小量(少于屁成分的1%)的硫化氢。
制备
实验室一般使用 来制取硫化氢。 也可以用 但还有一个更加简单的方法,硫化铝(白色)的水解: 此方法是利用了活泼金属(碱金属除外)硫化物的水解。硒化铝(灰色)和碲化铝(暗灰色)也能和水迅速反应,生成硒化氢和碲化氢。
性质
物理性质 2015年,物理学者发现,硫化氢在温度203K (-70 °C)、极度高压的环境下(至少150GPa,也就是约150万标准大气压)会发生超导相变,是目前已知最高温度的超导体。 化学性质 硫化氢比同族的水不稳定,加热高于700K时即发生分解。 硫化氢比空气稍重,硫化氢和空气的混合物极易爆炸。硫化氢和氧气燃烧会产生蓝色火焰,形成二氧化硫和水。在一般化学反应里,硫化氢是一种还原剂,如硫化氢可与二氧化硫反应形成单质硫和水。 工业上可以用此反应制造高纯度硫磺。 硫化氢可微溶于水,形成弱酸,称为“氢硫酸”。其水溶液包含了氢硫酸根HS(在摄氏18度、浓度为0.01-0.1摩/公升的溶液里,pKa = 6.9)和离子硫S(pKa = 11.96)。一开始清澈的氢硫酸置放一段时间后会变得混浊,这是因为氢硫酸会和溶解在水中的氧起缓慢的反应,产生不溶于水的单质硫。 硫化氢和金属离子接触会形成硫化金属,硫化金属往往是深暗色的。用于检测硫化氢的醋酸铅纸和硫化氢的气体接触时会产生灰色的硫化铅(II)。硫化金属与强酸反应时则会释放出硫化氢。 此外,气态硫化氢和浓硝酸接触时会发生爆炸。与醇反应则形成硫醇。 硫化氢是酸性的,它与碱及一些金属(如银)有化学反应。例如:硫化氢和银接触后,会产生黑褐色的硫化银,如果氧气存在反应趋势更大: 该反应能够进行的原因是硫化银的生成自由能负值很大,增大了正方向反应的趋势。 含有硫化氢的温泉对皮肤病有一定疗效。
安全
硫化氢是剧毒及易爆气体。 相对浓度危险度 浓度(单位:ppm) 反应 1,000 - 2,000(0.1 - 0.2%) 短时间内死亡 600 一小时内死亡 200 - 300 一小时内急性中毒 100 - 200 嗅觉麻痹 50 - 100 气管刺激、结膜炎 0.41 嗅到难闻的气味 0.00041 人开始嗅到臭味

 词典释义:
词典释义:
 酸
酸
 词:
词: