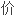La valence d'un élément chimique est le nombre maximal de liaisons qu'il peut former avec d'autres éléments en fonction de leurs configurations électroniques. Dans une molécule ou un ion, la valence d'un atome est le nombre de liaisons covalentes que cet atome a formées ; dans un ion monoatomique en solution, sa valence est sa charge, on parle alors d'électrovalence. Un élément univalent est ainsi un élément qui formera des molécules ou ions en se liant une seule fois ; a contrario, les éléments bivalents, trivalents ou tétravalents s'associeront avec respectivement deux, trois ou quatre atomes d'un élément univalent, comme dans le méthane (CH4) où le carbone, à valence quadruple, est lié à quatre atomes d'hydrogène.
La couche de valence est la dernière couche électronique ou couche extérieure d'un atome et la (ou les) sous-couche(s) en cours de remplissage.
Nomenclature et répartition des valences des éléments
valence 0 : He, Ne, Ar, Kr, Xe, Rn ;
valence I (élément univalent ou monovalent) : H, Li, Na, K, Rb, Cs, Fr, Cu, Ag, Au, F, Cl, Br, I ;
valence II (élément bivalent ou divalent) : Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd, Pt, Hg, Sn, Pb, O, Se, Te, C ;
valence III (élément trivalent) : B, Al, Au, Fe, Co, Ni, Cr, Mn, Cl, Br, I, Ga, In, Tl, N, P, As, Sb, Bi, Cr, Po ;
valence IV (élément tétravalent) : C, Si, Ge, Sn, Pb, S, Se, Te, Pt, Ir, Mn ;
valence V (élément pentavalent) : Bi, Sb, As, I, Br, Cl, P ;
valence VI (élément hexavalent) : Te, Se, S, Mn, Cr ;
valence VII (élément heptavalent) : Mn, Cl, Br, I.
Principe
Un atome augmente sa stabilité lorsque sa couche d'électrons extérieure (couche de valence) est complète, c'est-à-dire qu'elle contient le nombre maximum d'électrons qu'elle peut contenir. Pour cela, il peut s'associer dans des liaisons avec d'autres atomes, soit en cédant soit en acquérant des électrons ; s'il en cède c'est pour que la couche externe soit la couche inférieure toujours complète. (Voir aussi la règle de l'octet.)
Exemples élémentaires :
les gaz nobles (He, Ne, Ar, Kr, Xe, Rn), ont une couche de valence naturellement complète, et ne s'unissent donc pas à d'autres atomes : leur valence est 0. Pour cette raison, on les trouve dans la nature sous la forme de gaz monoatomiques ;
un atome d'hydrogène H ne peut former qu'une seule liaison avec un autre atome quel qu'il soit. Sa valence est donc 1, c'est un élément univalent ou monovalent. Ainsi, dans la molécule de dihydrogène H2, deux atomes H sont liés par une liaison covalente ;
l'atome d'oxygène O a la capacité de s'associer à deux atomes, sa valence est donc 2 : c'est un élément bivalent ou divalent. Dans la molécule d'eau, H2O, l'atome d'oxygène forme deux liaisons covalentes, une avec chaque atome d'hydrogène. Chacun de ces derniers, conformément à leur monovalence, ne forme qu'une liaison ;
un atome de carbone C est tétravalent, et peut former jusqu'à quatre liaisons. Ainsi dans la molécule de méthane CH4, le carbone porte quatre atomes d'hydrogène.
Valence des atomes dans les molécules
Dans le cadre d'une molécule, la valence d'un atome est par définition le nombre de liaisons que cet atome a formé. Par exemple, bien que la valence du carbone, en tant qu'élément, soit 4, dans le cas d'un carbène (R2C:), la valence du carbone est de 2.
Plusieurs éléments existent dans des degrés d'oxydation différents. Dans le cas des éléments non-métalliques, les états d'oxydation sont liés à la valence. Ainsi, le phosphore possède les états d'oxydation +III et +V (il peut mettre en jeu trois ou cinq électrons dans des liaisons covalentes polarisées). D'une façon analogue, on parle de phosphore pentavalent (cinq liaisons) et de phosphore trivalent (trois liaisons).
Cas des liaisons multiples
Une liaison peut être double, triple ou quadruple. Par exemple dans le cas du dioxyde de carbone, CO2, chacun des deux atomes d'oxygène forme une double liaison covalente avec le carbone central. La formule de la molécule est : O=C=O. Dans cette dernière, le carbone est tétravalent (deux liaisons doubles) et l'oxygène divalent (une liaison double).
化合价(英语:Valence)是由一定元素的原子构成的化学键的数量。一个原子是由原子核和外围的电子组成的,电子在原子核外围是分层运动的,化合物的各个原子是以和化合价同样多的化合键互相连接在一起的。 元素周围的价电子形成价键,单价原子可以形成一个共价键,双价原子可形成两个σ键或一个σ键加一个π键。
共价,在1919年,Irving Langmuir利用这个词解释Gilbert N. Lewis的立方体原子模型,任一原子和周围原子之间成对电子的分享叫做原子的共价,例如,如果有+1价,代表需要获得一个电子才能变成完整的价电子数;反之,如果是-1价时,则需要丢到一个电子才会变成完整的价电子数,因此在这两个原子之间的键结电子能互相的补充或分享他们的电子以至形成稳定的价电子数。在这之后,"共价"的词比"价"更能被叙述、讨论。
化合键
离子键,如钠原子和氯原子互相结合成氯化钠(食盐),就是钠原子失去一个电子,使最外层电子数达到8,但也因此带一个正电荷,氯原子夺取一个电子,使最外层电子数达到8,但也因此带一个负电荷,两个带电荷的原子依靠电荷力联系在一起,形成新物质。所以氯是负1价,钠是正1价。这种键的结合力较弱,在电解质中,如水中,两种原子就会分离成离子,在水中溶解。
共价键,有机化合物中碳原子和氢原子就是依靠这种方式连接的,碳原子分出一个电子和一个氢原子最外层的电子组成两个电子的稳定结构,围绕两个原子核运动,也就是它们分享这两个电子。氢原子最外层达到2个电子。和四个氢原子分享,碳原子的最外层也达到了8个电子,所以氢是1价,碳是4价。这种键的结合力较强,不容易分离成离子。共价键中还包括一种特例,即配位键,它是由一个原子单方面提供电子对而跟另一个原子共用的化学键。铵根、硫酸根等酸根离子都有配位键。
常见的价态
在元素周期表中的主族,一到七族之间,价是多变的,但是通常只从一到四价。键数的形成通常被认为是固定的,但是事实上,是不正确的,例如,磷通常是三价,但是通常可以有其他的价数。 尽管如此,许多元素的价数跟他们在周期表中的位置有关,根据八隅体规则,1族的金属(碱金属)和17族(卤素)通常具有的化合价为1,2族和16族常见合价是2,13族(硼基团)和15族(氮基)常见化合价为3,14族(碳)常见化合价为4。 惰性气体最外层电子数已经达到了2个或8个,所以惰性气体(又称稀有气体、高贵气体)一般不能和其他物质化合。
价与氧化态比较
由此表可看出同一元素的化合价并不是固定的。如二氧化碳(CO2)中碳为+4价,可在一氧化碳(CO)中碳仅为+2价。
此外某一元素化合价往往存在着这样的规律:该元素的负价态的最高价的绝对值加上该元素的正价态的最高价的和为8。如碳,负价态的最高价为-4,正价态的最高价为+4,。
金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
化合价有正价和负价。
元素化合价应写在元素符号上方且应该先写+、-号再写数字,数字为1时不可省略掉1如:Na(+1)2O(-2)
在单质中元素的化合价为0。
部分离子、原子团的化合价
表示方法
一般写在化学式元素正上方,如: 一氧化碳: 硫酸根离子: 高锰酸钾制氧气:

 词典释义:
词典释义:
 〕
〕
 ,
,