L'ammoniac est un composé chimique, de formule NH3 (groupe générique des nitrures d'hydrogène). Dans les conditions normales de température et de pression, c'est un gaz noté NH3 gaz. Celui-ci est produit industriellement en quantité gigantesque par le procédé Haber-Bosch à partir de diazote et de dihydrogène. Ce gaz industriel est un des composés les plus synthétisés au monde. Outre ses propriétés usuelles de réfrigérant, il sert à la synthèse de nombreux autres composés dont ceux de fort tonnage utilisés comme engrais. Ce gaz incolore est irritant, il possède une odeur piquante, il brûle les yeux et les poumons.
L'ammoniac est aussi un solvant liquide en usage pur, à 20 °C et 8 bars, soit NH3 liquide. Ce solvant ionisant permet de développer une chimie acido-basique, avec une constante d'ionisation :
-
Ki = [NH4] [NH2]
Dans le solvant protique NH3 liquide, le cation ammonium NH4 est l'acide le plus fort alors que l'anion amide NH2 est la base la plus forte.
Sur le plan chimique, par la présence de son doublet électronique, c'est à la fois une base, un nucléophile, un ligand et un réducteur. Sa propriété basique est mise à profit pour produire quantité de sels d'ammonium. Ses propriétés de nucléophile en font un réactif de base en chimie organique pour la préparation des amides, des imides, etc. Ses propriétés de ligand sont connues depuis le début de la chimie de coordination et le fameux débat scientifique entre Sophus Mads Jørgensen et Alfred Werner, qui attira l'attention du jury du prix Nobel, décerné de ce dernier. Enfin, sa propriété de réducteur lui permet d'être industriellement oxydé en acide nitrique et en hydrazine notamment, deux produits industriels de fort tonnage.
En génie chimique, le système air - NH3 - eau constitue un modèle très étudié de phases liquide-gaz, puisque l'ammoniac est un gaz très soluble dans l'eau, avec une solubilité 89,9 g pour 100 g d'eau à 0 °C et seulement 7,4 g à 96 °C. Le gaz est soluble dans l'eau, sous forme de NH3 aqueux faiblement dissocié en cations ammonium et anions hydroxyles, cette solution aqueuse est nommée ammoniaque.
Sur un plan biologique, l'ammoniac joue un rôle physiologique majeur tant à long terme, puisque c'est par son intermédiaire que l'azote est artificiellement incorporé par les plantes, qu'à court terme puisqu'il est impliqué dans l'élimination de l'azote du corps et la régulation du pH sanguin.
L'ammoniac est rarement présent dans l'atmosphère en quantité importante, mis à part en cas de présence de fermentation de micro-organismes en milieu confiné ou de processus de putréfaction en milieu anaérobie. Il est indéniablement un alcali connu depuis l'Antiquité. Le chauffage des excréments frais ou le mélange de sel et d'urines permettaient, outre de le sentir, d'obtenir son action alcaline sur d'autres matières, au moins dès la XII dynastie égyptienne soit 2000 ans av. J.-C. Mais toute matière gazeuse reste mystérieuse et mal comprise, comme en témoigne le culte d'Amon, le dieu caché du clergé de l'antique Hermopolis, avant la XI dynastie, puis à Thèbes, où il finit par être identifié à Rê. Au Moyen Âge, les forgerons obtenaient cet alcali d'Amôn par distillation de cornes et sabots de bœufs. Le britannique Robert Boyle est le premier chimiste à avoir proposé des test de détection de ce gaz. La teinture de tournesol ou sirop de violette virant au bleu indiquait la présence de cet alcali gazeux.
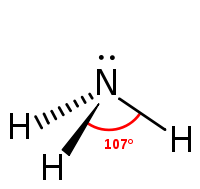
Il faut attendre l'essor de la pneumochimie à cuve à mercure pour faciliter sa préparation et son isolement par Joseph Priestley en 1774, par simple chauffage de sels d'ammonium avec de la chaux CaO et/ou du calcaire comme pierre à chaux. En 1785, le chimiste Berthollet confère à ce corps chimique une formule équivalent de 1 azote pour 3 hydrogènes. Le mouvement d'oscillation de la molécule NH3 gaz, où l'azote passe entre la base triangulaire formée par les trois H pour atteindre sa double position en sommet de l'agencement pyramidal, a été découvert par le physicien alsacien Alfred Kastler. Ce mouvement oscillant régulier, de la molécule d'ammoniac, est à l'origine de la première horloge atomique, du bureau of stantards aux États-Unis en 1948.
Sens ancien et moderne
Le terme d'origine adjectivale ammoniac qualifiait autrefois une substance médicinale (gomme) utilisée par les apothicaires, présentée comme suit en 1752 par le Dictionnaire français-Latin de Trévoux :
« Ammoniac ; une gomme dont on se sert en Pharmacie. Gummi ammoniacum. On nous l'apporte des Indes Orientales, & on croit qu'elle découle d'une plante umbellifére. Elle doit être en larmes séches, blanchâtres en dedans, un peu roussâtres en dehors, faciles à se fondre, gommeuses & résineuses, un peu amères, d'une odeur & d'un goût acre, tenant de l'ail. On en apporte aussi en masses remplies de petites larmes bien nettes & bien blanches. Cette gomme roussit en vieillissant ; Dioscoride & Pline en font mention. Dioscoride dit que l'ammoniac est le jus d'une espèce de férule qui croît en Afrique auprès de Cirène de Barbarie. La plante qui le porte, & sa racine, s'appellent Agafillis. Le bon ammoniac est haut en couleur, & n'est brouillé ni de raclure de bois, ni de sable, ni de pierres. Il a force petits grains comme l'encens, retire à l'odeur du castoreum, & est amer au goût (…) Pline appelle l'arbre dont il découle Métopion (…) L'ammoniac des Apoticaires est réduit en masse comme poix résine, au lieu d'être fraisé & menu comme de l'encens. On prétend qu'il servoit d'encens aux Anciens dans leurs sacrifices. Cette gomme entre dans plusieurs compositions ; elle est purgative, fondante, & résolutive, étant appliquée extérieurement. Gafer en tire un esprit & une huile, qui ont, à ce qu'il dit, de grandes vertus, lesquelles ne procèdent que du sel volatile qu'elle contient. Mais comme il est mêlé d'un acide qui empêche son activité, il donne le moyen de séparer ces deux esprits, lesquels sont capables, selon lui, de produire des effets tout différens (…) Il y a un sel qu'on appelle aussi armoniac, ou ammoniac ».
L'adjectif ammoniacque, attesté en 1575 dans les écrits français d'André Thevet, qualifie une gomme ou un sel ammoniac recueillis près du temple Ammon en Lybie. Le sal ammoniac est simplement le salmiac purifié, facilement sublimable. La gomme est probablement un mélange de substance végétale molle ou pâteuse contenant du salmiac.
Guyton de Morveau forme, officiellement dans la nomenclature chimique française, en 1787 le substantif ammoniac, définissant le corps chimique. Le terme ammoniacal, caractérisant les solutions aqueuses d'ammoniac ou ammoniaque, est attesté toutefois vers 1748. Le mot ammonisation, désignant la transformation d'azote organique en azote ammoniacal, est attesté dans le vocabulaire commun par le Grand Larousse de 1933.
Nomenclature
D'après la nomenclature IUPAC, l'ammoniac est le plus simple des azanes, ou hydrures d'azote acycliques.
Production industrielle
Réacteur chimique à haute pression et à parois d'acier utilisé pour la synthèse de l'ammoniac selon le procédé Haber-Bosch. Il a été construit en 1921 par BASF. En 2009, il est érigé à l'entrée de l'université de Karlsruhe en Allemagne.
La production industrielle de l'ammoniac se fait essentiellement par synthèse directe à partir de dihydrogène et de diazote. La mise au point est l'œuvre de la chimie allemande, encore secrète lorsqu'elle aboutit en 1913 avec le procédé Haber-Bosch, portant le nom de ses chimistes développeurs du catalyseur à base de Fe et Ni et du procédé en réacteur-tube à une température de 550 °C.
-
-
La synthèse de l'ammoniac est exothermique, dégageant 12,9 calories par mole à la pression atmosphérique. Elle implique deux gaz, l'azote et l'hydrogène. Dans les conditions « ambiantes », le produit final se présente sous la forme d'un gaz incolore (produisant une fumée de condensation à haute concentration) et dégageant une très désagréable odeur putride.
La production industrielle d'ammoniac, appelée banalement pour les besoins en engrais, était alors stratégique, car elle était capitale pour l'industrie d'armement et celle conjointe des explosifs, et dépendant alors essentiellement des exportations de nitrates du chili, de facto contrôlées par l'empire maritime britannique. En 1901, la réaction avait été étudié par le chimiste français Le Chatelier, avec un catalyseur à base de Fe, K sur support d'alumine.
Le procédé Haber-Bosch, déjà amélioré au niveau cinétique par une pression modulée jusqu'à plus de 200 atmosphères pendant les années du conflit mondial, est récupéré par les nations alliées victorieuse, en particulier le groupe ONIA à Toulouse. Les groupes chimiques français et italien peuvent investir afin de le modifier et perfectionner sur le continent. Ainsi apparaissent au moins quatre procédés dans l'entre-deux-guerres, attestant la vitalité du secteur des gaz industriels en France :
le procédé ONIA, fondé sur le procédé Haber-Bosch récupéré mais modifié en un process avec tube à catalyse à 500 °C et 300 atmosphères, en matière réfractaire et avec échangeur-récupérateur de chaleur. Il est à l'origine du procédé NEC des usines Kulhmann, au cours des années 1960 à La Madeleine-lès-Lille.
le procédé Georges Claude, ainsi nommé en l'honneur de grand spécialiste français des gaz. Georges Claude perfectionne en 1918 la rentabilité du procédé allemand d'un facteur 15 et comprime le mélange gazeux de 800 à 1000 bars. De l'usine pionnière de Montereau le procédé sera adapté sur les sites de Saint-Étienne, Béthune, Grand-Quevilly, Mazingarbe. Le mélange est comprimé à 1000 atmosphères ou 1000 bar à une température entre 500 °C et 600 °C. Si la rentabilité est excellente, la dépense d'énergie est jugée importante.
le procédé Casale, à partir d'une température de mélange réactif abaissée à 460 °C et d'une pression de 400-450 atmosphères, promu dans les années 1960. Il était en vigueur en 1990 à Lens, Hénin-Liétard, Anzin ou Saint-Auban, et son évolution moins gourmande en énergie influence les installations récentes.
le procédé Fauser, mis au point en Italie, adopté tardivement par ONIA dans son usine de Soulon, qui se fonde à partir d'un mélange à 250 atmosphères et 550 °C.
Le procédé basse pression du Mont-Cenis se caractérise par une pression plus faible de 100 à 150 bars à une température avoisinant 430 °C.
La production industrielle d’ammoniac de 1946 à 2007
Dès les années 1960, le gaz industriel ammoniac est vendu dans des récipients en acier calibrés à une pression de 12 atmosphères. Par sa chaleur d'évaporation élevée à la température normale de 0 °C, il est nécessaire à l'industrie de la réfrigération.
Au cours des années 1990, un essor mondial des unités de productions des dérivés d'ammoniac et d'urée a chamboulé la géographie de la synthèse industrielle d'ammoniac, en corrélation avec la production et la demande d'engrais chimiques. En 2000, Trinité-et-Tobago possédait la plus grosse unité du monde, mais la concurrence est active : dès 1998, la région industriel du golfe persique surgit avec des unités à Abu Dhabi de 400 000 tonnes par an, au Qatar de 300 000 tonnes par an, à Oman... cette dernière région étant bien placée pour livrer le marché asiatique en croissance, absorbant plus du tiers de la productions mondiale de ces dérivés en 1999.
En effet, les pays, anciens ou actifs producteurs pétroliers, récupèrent leurs gaz naturels et le recyclent localement dans ses unités de productions d'ammoniac. Dans la pratique, par exemple, le diazote est fourni par l'air et le dihydrogène par vaporeformage du méthane (gaz naturel).
-
Qui peut se décomposer en :
production de dihydrogène par vaporeformage (voir l'article Dihydrogène) : C H 4 + H 2 O ⟶ C O + 3 H 2 {\displaystyle \mathrm {CH_{4}+H_{2}O\longrightarrow CO+3\,H_{2}} } C O + H 2 O ⟶ C O 2 + H 2 {\displaystyle \mathrm {CO+H_{2}O\longrightarrow CO_{2}+H_{2}} }
La production mondiale d'ammoniac, à partir de H2 et N2 a été estimée à 122 millions de tonnes en 2006. Exprimée le plus souvent en millions de tonnes d'azote N, elle approcherait de 136,5 en 2012.
Anciennes méthodes de fabrication modernes
Anciennement, il était fabriqué par des synthèses indirectes, à partir d'eaux ammoniacales. Ainsi l'ammoniac pouvait être obtenu par distillation du purin et du fumier, mais il l'était le plus communément à partir de minerai, lors de carbonisation de la houille, voire du coke après 1880. Il s'agit d'un sous-produit du traitement des gaz de fours à coke.
Au début du XX siècle, différents procédés de synthèse ont été imaginés. L'un d'entre eux se base sur l'hydrolyse de la cyanamide calcique, elle-même obtenue à partir du carbure de calcium.
-
-
-
L'autre utilise l'hydrolyse du nitrure d'aluminium, lui-même produit par nitruration à haute température de l'alumine.
-
-
Il faudra attendre 1913 pour voir apparaitre le procédé Haber-Bosch encore employé au XXI siècle.
Notons que l'ammoniac est bien le gaz piquant qui caractérise les caves d'affinage de fromages, notamment les pâtes molles lavée à l'eau salée que sont le maroilles, le munster ou le géromé... soumises à l'action de fermentation bactérienne, via ses enzymes.
Méthode de fabrication pour l'avenir
Une voie biochimique d'avenir est l'usage d'enzymes nitrogénases, composants intimes de bactéries, qui catalysent la réduction de N2 en NH3.
Propriétés de la molécule d'ammoniac
L'ammoniac est une molécule pyramidale à base trigonale : l'atome d'azote (N) est au sommet et les trois atomes d'hydrogène (H) occupent les trois coins (sommets) de la base triangulaire équilatérale. Plus précisément, l'atome d'azote « monte » et « descend » entre ce « sommet » de la pyramide et celui de la pyramide opposée, traversant ainsi la base triangulaire des atomes d'hydrogène. Cette « oscillation » s'effectue à une fréquence fondamentale de 24 GHz et a été mise à contribution dans les premières horloges atomiques.
Propriétés physicochimiques
Odeur : très âcre et facilement reconnaissable, nocif par inhalation (mortel à hautes doses).
Inflammabilité et explosibilité : sous forte pression, l'ammoniac peut former un mélange explosif avec les huiles de lubrification, le mélange air-ammoniac s'enflamme et explose violemment.
Surchauffe de compression : la valeur élevée du rapport α=Cp/Cv = 1,335 à 0 °C limite rapidement le taux de compression admissible du fait des hautes températures des vapeurs de refoulement, températures qui risqueraient au-delà d'une température de 120 °C une altération des huiles de lubrification et la formation d'un mélange détonant.
Corrosion des métaux, joints et lubrifiants : attaque le cuivre et tous ses alliages. C'est la raison pour laquelle les installations frigorifiques fonctionnant à l'ammoniac sont réalisées avec des tuyauteries en acier.
Miscibilité et solubilité : très soluble dans l'eau et non miscible avec les huiles naphténiques et les huiles de synthèse. Lorsqu'il est dissous dans l'eau, le gaz ammoniac forme une solution aqueuse de ce gaz, nommée l’ammoniaque, et donne lieu à un équilibre peu dissocié. L'ion ammonium NH4 en solution comporte alors un atome d'hydrogène aux quatre sommets du tétraèdre. En milieu aqueux, l'acide conjugué de l'ammoniac est l'ion ammonium, ce qui peut s'expliquer par le fait qu'une molécule d'ammoniac ait bien fixé ou capté un proton, dans le cadre de la théorie acide-base de Thomas Lowry et Joannes Brønsted.
Ammoniac base de Lewis
En 1923, à peine trois années après l'exposition des théories Lowry-Brønsted, le cas particulier de l'ammoniac, muni de son doublet électronique si caractéristique, a motivé les travaux de Gilbert Lewis.
Ammoniac soluté donneur de proton
En absence d'espèces chimiques comportant des hydrogènes acides (l'eau et les alcools inclus), l'ammoniac peut également perdre un proton, H, et donner l'ion amidure, NH2, qui est une base forte.
Ammoniac liquide, un solvant protique
La gamme de pH mesurable dans l'ammoniac liquide oscille entre 0 et 29. Dans ce solvant spécifique où l'ion amidure est la base la plus forte et l'ion ammonium l'acide le plus fort, l'acide acétique est dissocié totalement, et se comporte comme un acide fort.
Biochimie, Ammoniac dans l'environnement
L'ammoniac dans le cycle de l'azote
L'azote est nécessaire à la synthèse des acides aminés, qui sont les éléments constitutifs des protéines. Il est très abondant (75 % du volume de l'atmosphère), mais très peu d'êtres vivants savent l'utiliser directement. Dans l'écosystème, l'ammoniac est essentiellement présent sous sa forme acide, l'ion ammonium (NH4). Il constitue la principale source d'azote assimilable, via les plantes et il est source de dystrophisation s'il est excessivement présent. En temps normal, dans l'environnement, il est transformé en nitrites puis en nitrates dans le cycle de l'azote. Notez que l'ammoniac peut être produit dans la nature à partir d'urée, produit ultime de déjection azotée du métabolisme cellulaire, par exemple des mammifères, par des bactéries et levures, ainsi que certaines plantes, activant l'enzyme uréase.
Dans l'atmosphère, après l'air, la forme la plus présente de l'azote est le gaz NH3 (ammoniac). Il y est d'abord issu des engrais chimiques et des parcs d'engraissement de l'élevage industriel, suivis de la combustion de la biomasse fossile (charbon, pétrole, gaz naturel) ou renouvelable (dont via les incendies de forêt). Il est rabattu au sol par les pluies qu'il acidifie et rend eutrophisantes. Il acidifie secondairement le sol et contribue ainsi également à l'eutrophisation des milieux. Alors que la pollutions soufrée des années 1970-1980 a diminué, il est devenu la cause principale des pluies acides et de l'acidification des eaux douces.
En Europe, avec l'EMEP (European Monitoring and Evaluation Programme) et en application de la convention de Genève dite convention sur la pollution atmosphérique transfrontière à longue distance et de son « protocole » sur l'acidification, l'eutrophisation et l'ozone, l'acidité des pluies fait l'objet d'un suivi, centralisé pour la partie française par EcoLab (Laboratoire écologie fonctionnelle et environnement) , accueille le point focal national chargé de la modélisation des charges critiques atmosphériques).
En France, l'acidité des pluies a diminué globalement grâce à une forte diminution des émissions de SO2, mais leur teneur en ammoniac n'a pas diminué alertait le ministère de l'environnement en 2011, alors que le protocole de la convention demande aux États signataires d'appliquer « les meilleures techniques disponibles pour prévenir et réduire les émissions d'ammoniac énumérées dans le document d'orientation V adopté par l'Organe exécutif à sa dix-septième session (décision 1999/1) et tous amendements y relatifs » notamment par de « bonnes pratiques agricoles respectueuses de l'environnement ». Son article 8 stipule que les parties doivent élaborer des « stratégies visant à réduire davantage les émissions de soufre, d'oxydes d'azote, d'ammoniac et de composés organiques volatils en se fondant sur les charges critiques et les niveaux critiques ainsi que sur les progrès techniques, et amélioration de la modélisation de l'évaluation intégrée pour calculer la répartition optimisée au niveau international des réductions des émissions compte tenu de la nécessité d'éviter des coûts excessifs pour quelque Partie que ce soit. Une importance particulière devrait être accordée aux émissions imputables à l'agriculture et aux transports ». Pour la France, second pays européen le plus émetteur d’ammoniac derrière la fédération de Russie, le niveau de 1990 avait été évalué à 814 000 tonnes de gaz NH3 par an, et la convention de Genève imposait de descendre sous un « plafond » de 780 000 t/an, soit un effort de -4 % alors qu'on demandait à la Slovaquie qui émettait 62 000t/an de réduire ses émissions de 37%.
Au-delà de seuils qui diffèrent selon les espèces et leur environnement, l'excès d'ammoniac dans l'air ou dans un milieu est toxique et écotoxique.
Le gaz ammoniac (NH3) est source d'ammonium dans les précipitations (pluies, neiges, mais aussi rosée, brumes). De 1980 à 2008, les émissions de NH3 française n'ont diminué que de 4 % (source Citepa). Le dépôts d’ammonium est indirectement acidifiant quand dans le sol il libère des ions H + par transformation en nitrites (NO2) ou nitrates (NO3), tout en eutrophisant le milieu où il s'est déposé ; L'ammoniac n'étant pas la seule forme de l'azote en cause, l'étude de la pollution ammoniacale doit être faite dans le cadre d'une approche plus globale faisant le bilan des effets environnementaux en termes d'azote total.
Chez les plantes
Les plantes terrestres, pour la plupart, exploitent l'ammoniac et d'autres déchets azotés incorporés dans le sol par les matières en décomposition. Quelques-unes sont parasites ou hémiparasites d'autres plantes. D'autres, comme les légumineuses fixatrices d'azote, bénéficient de relations symbiotiques avec les rhizobiums qui créent ammoniac à partir de l'azote atmosphérique, mais un excès d'ammoniac dans le sol ou même dans l'air peut en revanche avoir des effets négatifs sur de nombreuses espèces végétales, dès que les effets toxiques du NH3 dépassent la vitesse et capacité de désintoxication in vivo des plantes qui y sont exposées.
À partir des sources agricoles ou industrielles, l'ammoniac se dépose en moyenne assez rapidement (dans les premiers 4 à 5 km après avoir été émis par sa source). En contact avec les feuilles, le NH3 peut entraîner
des dommages foliaires visibles sur la végétation ;
un ralentissement de la croissance ;
une moindre productivité végétale ;
l'apparition de composés toxiques dans les tissus ;
une moindre tolérance et résilience face à la sécheresse et au gel ;
une moindre résistance aux parasites et insectes nuisibles ainsi qu'aux maladies causées par des micro-organismes (pathogènes) ;
une dégradation des associations symbiotiques ou mycorhizienne ;
une concurrence faussée entre espèces au détriment de la biodiversité et en faveur de quelques espèces ubiquistes ou résistantes.
Avant de retomber au sol, une partie du NH3 anthropique ou naturel aura déjà été convertie dans l'atmosphère en nanoparticules et en aérosols de NH4+ (ammonium) qui eux posent un problème à des échelles au moins régionales. En effet, selon les données scientifiques disponibles, la charge critique à ne pas dépasser pour les milieux les plus vulnérables (landes, tourbières, zones humides oligotrophes, et certains milieux abritant des cryptogames) serait de 5 à 10 kg d'azote total par hectare (charge par an en dépôt sec et/ou humide combinée de toutes les formes de l'azote atmosphérique). Les plantes autochtones sont les plus vulnérables ; les forêts semblent pouvoir supporter des charges plus élevées (de 10-20 kg/ha/an), plus ou moins selon les conditions édaphiques, mais la plupart des cryptogames (lichens, bryophytes, hépatiques) qu'elles hébergent y sont néanmoins très vulnérables au NH3 ainsi qu'à d'autres eutrophisants azotés. Sans doute parce que sélectionnées depuis des milliers d'années pour supporter les apports de fumiers et lisiers, les plantes cultivées sont celles qui supportent le mieux les retombées de NH3 .
Ces seuils critiques sont très fréquemment dépassés dans les régions industrielles et d'agriculture intensive (un hectare cultivé peut perdre jusqu'à 40 kg/an d'azote sous forme d'ammoniac).
Des synergies ou effets additionnels conjoints avec d'autres polluants (ozone et CO2 notamment qui semblent en augmentation presque partout) sont fortement suspectés mais avec des mécanismes toxicologiques et écotoxicologiques encore mal compris.
Chez l'animal
Chez l'animal, l'ammoniac joue un rôle à la fois dans la physiologie normale et anormale. Il est biosynthétisé travers le métabolisme des acides aminés normaux, mais est toxique (plus ou moins selon les espèces et la durée d'exposition) à des taux élevés.
Chez les animaux aquatiques, l'ammoniac est directement évacué dans le milieu (ammoniotélisme). Chez les animaux terrestres, le foie transforme l'ammoniac en urée par une série de réactions faisant partie du cycle de l'urée. Certains, comme les oiseaux et les reptiles, l'évacuent sous forme d'acide urique.
Un dysfonctionnement hépatique, tels que celui observé chez l'homme avec la cirrhose, peut conduire à des quantités élevées d'ammoniac dans le sang (hyperammoniémie). De même, le fonctionnement défectueux des enzymes responsables de cycle de l'urée, tels que l'ornithine transcarbamylase, conduit à une hyperammoniémie. Cette hyperammoniémie contribue à la confusion mentale et peut conduire au coma de l'encéphalopathie hépatique, ainsi qu'à des maladies neurologiques (fréquentes chez les personnes présentant des anomalies du cycle de l'urée et des aciduries organiques).
L'ammoniac participe chez les animaux aux équilibres acide-base normaux. Après la formation d'ammonium à partir de glutamine, l'α-cétoglutarate peut être décomposé en produisant deux molécules de bicarbonate qui deviennent disponibles comme « tampon » pour les acides alimentaires. L'ammonium est excrété dans les urines, entraînant une perte nette d'acide.
L'ammoniac peut se diffuser à travers les tubules rénaux, s'y combiner avec un ion hydrogène, et permettre ainsi l'excrétion supplémentaire d'acide .
Chez l'Homme
L'ammoniac inhalé est toxique au-delà d'un certain seuil.
Dans les régions cultivées, sa première source est l'engrais azoté (« de 0 à 90 % de la quantité totale d’azote ammoniacal apportée peut s'évaporer » sous forme d'ammoniac). En Europe, l'ammoniac volatilisé perdu par les engrais agricole (minéraux et organiques) est après la lixiviation le second poste de pertes d’azote. Jusqu'à 20 % des apports d’engrais minéraux (selon les formes, le sol et conditions d'apport) et jusqu'à 70% de la fraction ammoniacale des lisiers peuvent être perdus dans l'atmosphère, en quelques jours à quelques semaines après épandage, avec jusqu'à 40 kg/an/hectare.
Une directive européenne a fixé des seuils d'émission à ne pas dépasser (plafonds) pour réduire les émissions européennes de NH3 à horizon 2010 puis 2020. Le NH3 est l'un des principaux précurseurs de particules fines dont les effets sanitaires négatifs sont largement démontrés.
Par ailleurs, en pathologie humaine, une augmentation de l'ammoniac sanguin est signe de dysfonctionnement du foie. En effet l'ammoniac issu de la dégradation des acides aminés est transformé en urée dans le foie, afin d'être éliminé de l'organisme (détoxication) ; toute dégradation de fonctionnement du foie entraîne donc une augmentation du taux d'ammoniac dans le sang.
Utilisations
Sous forme gazeuse, l'ammoniac est utilisé par l'industrie pour la fabrication d'engrais, d'explosifs et de polymères. L'ammoniac, qui comporte 82 % d'azote, sert aussi d'engrais azoté ; il est injecté directement dans le sol sous forme d'ammoniac liquéfié sous pression.
On le trouve aussi dans la cigarette. Les fabricants l'ajoutent à la préparation du tabac en raison de sa faculté à faciliter et augmenter l'absorption de la nicotine, composé addictif du tabac.
Réfrigération
L'ammoniac est utilisé comme fluide frigorigène et est désigné par la référence R717.
La lettre R signifie réfrigérant.
7 : les fluides frigorigènes d'origine inorganique sont répertoriés dans la série des 700. Le chiffre des centaines est donc un 7.
17 : le chiffre des dizaines et celui des unités ici représentent la masse molaire de la molécule à savoir M(NH3)=17,0 g.mol.
L'ammoniac est très utilisé dans le secteur du froid industriel dans les installations à puissance importante (plusieurs centaines de kW). En raison de sa toxicité, il doit être confiné en salle des machines.
Il reste néanmoins un fluide frigorigène ayant des capacités thermodynamiques et thermiques excellentes malgré les contraintes qui lui sont liées.
Carburant
L'ammoniac est un vecteur énergétique car il permet de transporter de l'hydrogène sous une forme dont le stockage est relativement simple. Il brûle difficilement dans l'air mais la combustion est facilitée par une décomposition partielle par passage sur un catalyseur. Il peut être utilisé comme carburant dans des moteurs adaptés, mais avec toutefois des problèmes encore à résoudre de corrosion, de catalyseur, d'additif s, d'émissions d'imbrûlés et une contribution à l'émission de NOx polluants.
En 1872, le docteur Émile Lamm, dentiste français émigré aux États-Unis, dépose plusieurs brevets sur un moteur à l'ammoniac et met ce système en application sur une des lignes de tramways de La Nouvelle-Orléans.
Pendant la Seconde Guerre mondiale, des véhicules (notamment des autocars en Belgique) ont fonctionné avec de l'ammoniac. Dans les années 1960, l'armée américaine s'y est intéressée dans le cadre du concept MED (Mobile Energy Depot) qui visait à produire directement les carburants sur le champ de bataille à partir de réacteurs nucléaires transportables.
Au XXI siècle, l'ammoniac fait l'objet de nouvelles études pour des moteurs classiques sans émissions de CO2 et pour le fonctionnement de piles à combustible.
Détection des fuites
Du fait de son odeur particulière, une fuite d'ammoniac est facilement identifiable à l'odorat. Techniquement, on utilisait une baguette soufrée, qui enflammée au voisinage d'émanation d'ammoniac produit une fumée blanche dense permettant ainsi de localiser l'origine de la fuite. De nos jours, cette technique est interdite dû au danger qu'elle représente. La recherche de fuite se fait, le plus souvent, à l'aide de détecteurs électroniques ou de papiers imbibés de phénolphtaléine. La recherche de fuite sur une installation ammoniac ne peut se faire qu'à l'aide d'un appareil respiratoire isolant du fait de sa très forte toxicité.
Toxicologie
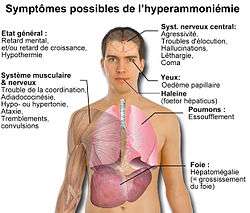
Principaux symptômes de l'ammoniémie
Au-delà d'une certaine dose, par inhalation, ou à la suite d'une production par l'organisme lui-même (intoxication endogène par fonctionnement anormal du rein, du foie, des muscles, ou de l'intestin), l'ammoniac est toxique, induisant :
un altération des astrocytes, en modifiant les protéines astrocytaires (Glial fibrillary acidic protein)
une altération des échanges ioniques cellulaires
une altération des sécrétions des NT
L'origine d'une hyperammoniémie peut être directe (éventuellement génétiquement acquise) :
une insuffisance hépatique sévère
une toxicose médicamenteuse (ex : valproate)
une prématurité, avec défaut de perfusion, liée à une immaturité hépatique (chez le bébé, dans les 24 à 72 heures suivant la naissance, se traduisant par des vomissements, une hypothermie, Hyperventilation et conduisant au coma).
L'origine peut aussi être indirecte, avec :
une acidurie organique
un déficit de la B oxydation des AG
un déficit de la chaîne respiratoire
Le taux sanguin normal d'ammoniac est 11 à 45 µmol·l. Au-delà de 50 µmol·l, on peut parler d'hyperammoniémie (quelques centaines à plus de 1 000 µmol·l) qui peut être déclenchée par un changement important dans l'alimentation, un stress important, une infection, et se traduit par des douleurs abdominales, une hépatomégalie, cytolyse, IHC avec troubles digestifs (anorexie, un dégoût pour les mets protéinés en particulier viande et poisson), troubles neuropsychologiques (asthénie, somnolence…), troubles de l'humeur du comportement et de la personnalité (irritabilité…), de l'élocution, hallucinations, crises ataxiques ou convulsives puis coma hyperammoniémique). Ces symptômes n'étant pas spécifiques, le diagnostic peut être difficile à poser. Chez l'adulte, il peut être suggéré par un retard mental et/ou psychomoteur, des troubles du comportement, une microcéphalie avec atrophie cérébrale, un régime végétarien avec aversion pour les protéines, un syndrome de Reye.
L’ammoniac étant labile, le prélèvement sanguin (au moins 1 ml de sérum en tube hépariné ou avec EDTA) doit être fait si possible lors d'une crise et rapidement transporté dans de la glace (en moins de 15 min) puis centrifugé et décanté le plus vite possible par un laboratoire prévenu de son arrivée. Il peut être conservé 2 heures à +4 °C ou 48 heures à −20 °C. Le sang veineux en contient naturellement près de 2 fois plus que le sang artériel ou capillaire, et le nouveau-né en produit naturellement plus (34–102 µmol·l pour le sang veineux, et 50 à 128 µmol·l pour le sang artériel pour un nouveau-né de 3 jours) que l'enfant ou l'adulte.
Le diagnostic différentiel doit faire éliminer :
d'autres formes d'encéphalite
l'épilepsie
une intoxication alimentaire
une porphyrie
la thrombose veineuse cérébrale
une tumeur cérébrale
etc.
Impact environnemental
Les impacts toxicologiques de l'ammoniac semblent assez bien connus, mais ses impacts écotoxicologiques, autres que liés à son caractère basique ou eutrophisant sont moins bien étudiés.
On sait que :
Les quantités d'ammoniac rejetées dans l'atmosphère en font l'un des principaux responsables de l'acidification de l'eau et des sols, ainsi qu'un facteur favorisant les pluies acides. En France et en Europe, le secteur de l'agriculture est à l'origine de 95 % des émissions d'ammoniac. 80 % des émissions proviennent de la volatilisation des déjections animales ; les 20 % restants sont principalement liés à la production des engrais azotés et à leur épandage, difficile à adapter aux aléas climatiques.
Il s'agit du principal responsable de l'eutrophisation des milieux aquatiques.
Avec un GWP (global warming potential) de 0, l’ammoniac est un fluide frigorigène sans effet sur le réchauffement climatique, contrairement aux fluides frigorigènes type HFC couramment utilisés dans les climatiseurs et pompes à chaleur dont le GWP peut varier de 1 430 (R134a) à 3 900 (R404A).
De même, avec un ODP (potentiel de déplétion ozonique) de 0, l'ammoniac est un fluide frigorigène sans effet sur la couche d'ozone, contrairement aux fluides frigorigènes type HCFC dont le plus connu est le R22 encore courant dans les systèmes de climatisations anciens.
La production d'ammoniac est une grande consommatrice d'électricité, représentant jusqu'à 2% de la production mondiale.
Dans l'eau, bien que considéré comme non-toxique aux doses où il est aujourd'hui présent, il semble discrètement affecter le métabolisme de tous téléostéens (l'infra-classe des Teleostei qui regroupe l'écrasante majorité des espèces de poissons actuels, soit environ 23 600 espèces actuellement connues), par exemple en diminuant les réflexes de ces poissons .
Une certaine toxicité est également constatée chez des animaux primitifs comme les amphipodes .
En France, les émissions d’ammoniac atmosphérique, estimées à 636 000 tonnes en 2012, baissent en moyenne de 0,5 % par an depuis 1980. Le protocole de Göteborg fixe un engagement de réduction des émissions d'ammoniac de 4 % en 2020 par rapport aux émissions de 2005, soit 636 000 tonnes par an.
Phrases de risque et conseils de prudence selon l'INRS
R10 – Inflammable (relativement peu).
R23 – Toxique par inhalation.
R34 – Provoque des brûlures.
R50 – Très toxique pour les organismes aquatiques.
S9 – Conserver le récipient dans un endroit bien ventilé.
S16 – Conserver à l’écart de toute flamme ou source d’étincelle. Ne pas fumer.
S26 – En cas de contact avec les yeux laver immédiatement et abondamment avec de l’eau et consulter un spécialiste.
S36/37/39 – Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage.
S45 – En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette).
S61 – Ne pas rejeter dans l’environnement. Consulter les instructions spéciales / la fiche de données de sécurité.
Référence ONU pour le transport des matières dangereuses
Classe 2 numéros : 1005 (ammoniac anhydride) 3318 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 50 % d'ammoniac) 2073 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 35 % mais au maximum 50 % d'ammoniac)
numéros : 1005 (ammoniac anhydride) 3318 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 50 % d'ammoniac) 2073 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 35 % mais au maximum 50 % d'ammoniac)
1005 (ammoniac anhydride)
3318 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 50 % d'ammoniac)
2073 (ammoniac en solution aqueuse de densité inférieure à 0,880 à 15 °C contenant plus de 35 % mais au maximum 50 % d'ammoniac)
Classe 8 numéro 2672 (ammoniac en solution aqueuse de densité comprise entre 0,880 et 0,957 à 15 °C contenant plus de 10 % mais au maximum 35 % d'ammoniac)
numéro 2672 (ammoniac en solution aqueuse de densité comprise entre 0,880 et 0,957 à 15 °C contenant plus de 10 % mais au maximum 35 % d'ammoniac)

 词典释义:
词典释义:
 ]氨的ammoniacm氨
]氨的ammoniacm氨