Un des peptides de la toxine de cet escargot bloque très efficacement la neurotransmission de la douleur et a été récemment introduit sur le marché sous la marque Prialt.
此螺毒素中含有一种肽,可以非常有效地阻止痛感神经传递,最近已进入市场,商品名为Prialt。
 词典释义:
词典释义:
n.f.神经传递
 词:
词: ;
;
Un des peptides de la toxine de cet escargot bloque très efficacement la neurotransmission de la douleur et a été récemment introduit sur le marché sous la marque Prialt.
此螺毒素中含有一种肽,可以非常有效地阻止痛感神经传递,最近已进入市场,商品名为Prialt。
La synapse (du grec σύναψις, syn = ensemble et haptein = toucher, saisir ; signifiant conne**on) désigne une zone de contact fonctionnelle qui s'établit entre deux neurones, ou entre un neurone et une autre cellule (cellules musculaires, récepteurs sensoriels…). Elle assure la conversion d'un potentiel d'action déclenché dans le neurone présynaptique en un signal dans la cellule postsynaptique. On estime, pour certains types cellulaires (par exemple cellule pyramidale, cellule de Purkinje…), qu'environ 40 % de la surface membranaire est couverte de synapses.
On distingue habituellement deux types de synapses :
Synapse entre deux neurones la synapse chimique, très majoritaire, qui utilise des neurotransmetteurs pour transmettre l'information ; la synapse électrique où le signal est transmis électriquement par l'intermédiaire d'une jonction communicante (en anglais gap-junction).
On les distingue au microscope électronique par la taille de la fente synaptique ; de l'ordre de 2 nanomètres pour les synapses électriques, entre 10 et 40 nm pour les synapses chimiques. On peut également, dans le cas des synapses électriques, observer les jonctions communicantes. Au niveau d'une synapse, il s'agit toujours d'un contact entre deux membranes plasmiques, il n'y a jamais fusion en un syncitium.
Le mot « neurone » fut utilisé pour la première fois par Waldeyer pour désigner les cellules nerveuses et un premier pas vers la compréhension de leur mode de fonctionnement eut lieu à la fin du **X siècle lorsque Camillo Golgi mit au point une technique de coloration par imprégnation, argentique permettant une visualisation optimale du neurone et de ses prolongements.
Par la suite, Santiago Ramón y Cajal utilisa la méthode de coloration de Golgi pour étayer la théorie du neurone. Le terme de « synapse », quant à lui, fut proposé en 1**7 par le physiologiste et Prix Nobel britannique Sir Charles Scott Sherrington pour désigner le point de contact entre deux neurones. Toutefois, Golgi était lui-même opposé à l'hypothèse selon laquelle le système nerveux pouvait être composé d'unités discontinues. En 1906 Golgi et Cajal reçurent conjointement le Prix Nobel de médecine et physiologie, pour deux théories de l'organisation du tissu neuronal (neuronisme et réticularisme). Il a été démontré par la suite que les synapses électriques sont très rares et l'on admet aujourd'hui que le système nerveux est constitué majoritairement d'unités contiguës (thèse neuroniste).
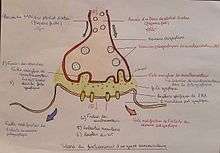
La synapse chimique est la plus fréquente des synapses du système nerveux. Ce type de synapse transmet le signal nerveux d'un neurone à un autre en utilisant un neurotransmetteur qui est émis par le neurone afférent, diffuse dans la fente synaptique et se lie aux récepteurs postsynaptiques.
Mitochondrie
Vésicule synaptique avec des neurotransmetteurs
Autorécepteur
Fente synaptique avec neurotransmetteur libéré (ex : sérotonine ou dopamine)
Récepteurs postsynaptiques activés par neurotransmetteur (induction d'un potentiel postsynaptique)
Canal calcium
Exocytose d'une vésicule
Neurotransmetteur recapturé
Dans certaines synapses les cellules gliales jouent un rôle particulièrement actif, notamment en effectuant la recapture du neurotransmetteur (ex : glutamate). Dans les synapses motrices, une enzyme, la cholinestérase, dégrade le neurotransmetteur dans la fente synaptique.
Il e**ste deux morphologies de synapses chimiques : la synapse en bouton et la synapse « en passant ». Elles fonctionnent toutes les deux de la même façon et l'on y retrouve les mêmes composants. La synapse en bouton se situe à l'extrémité de la fibre nerveuse alors que les synapses en passant sont réparties régulièrement le long de l'axone.
Il e**ste un grand « bestiaire » de synapses chimiques selon le type de neurone, la localisation, etc. Le calice de Held dans le tronc cérébral auditif, par exemple, est un cas de synapse géante qui entoure quasiment complètement la cellule postsynaptique.
La synapse est constituée de trois parties : l'élément présynaptique, l'élément postsynaptique et entre les deux l'espace intersynaptique.
L'élément présynaptique se présente sous la forme d'un renflement de l'axone, rempli de petites vésicules de formes variées (les vésicules synaptiques) contenant le neurotransmetteur. On y trouve aussi un appareil de Golgi très développé et de nombreuses mitochondries, signe d'une activité de synthèse intense. Les neurotransmetteurs sont en effet en partie synthétisés sur le lieu d'utilisation.
L'élément postsynaptique en revanche est totalement dépourvu de ce type de vésicule. Mais il contient quelques mitochondries, nécessaires pour assurer le fonctionnement de la synapse. Dans certains cas la membrane apparaît plus épaisse en microscopie électronique (densité postsynaptique), ce qui permet de caractériser des synapses asymétriques généralement glutamatergiques.
L'espace intersynaptique (ou fente synaptique) est la zone qui sépare les membranes des deux neurones. Elle est de petite dimension (quelques dizaines de nanomètres) et dépourvue de lame basale (contrairement à la plaque motrice).

L'influx nerveux est transmis le long d'un neurone sous la forme d'une séquence de potentiel d'action. Au niveau d'une synapse chimique, l'information change de nature : elle est transmise par une libération de neurotransmetteurs dans l'espace synaptique. Les trains d'onde de dépolarisation supportés par des courants électrochimiques (les potentiels d'action), sont convertis en codage par concentration de neurotransmetteur dans la fente synaptique.
Pendant longtemps, le credo a fait force de loi : un neurone, un neurotransmetteur. Aujourd'hui, on sait qu'un neurone peut libérer plusieurs neurotransmetteurs au niveau de la synapse, en général un transmetteur principal associé à un ou plusieurs neuropeptides. Le transmetteur principal peut même évoluer, par exemple certains neurones orthosympathiques (noradrénergiques), qui peuvent libérer de la sérotonine à la suite d'une lésion.
Événements présynaptiques : la libération des neurotransmetteurs
Il faut d'emblée différencier les neurotransmetteurs peptidiques et non peptidiques. Les neurotransmetteurs peptidiques sont produits par le neurone à partir d'acides aminés précurseurs présents dans le sang. Une grande partie de leur synthèse a lieu dans le péricaryon, en suivant le schéma classique de toute production protéique (Transcription de l'ADN en ARNm, lecture et traduction de l'ARNm par un ribosome sur le réticulum endoplasmique) puis transport antérograde rapide le long du cytosquelette de l'axone dans des vésicules provenant du bourgeonnement de l'appareil de Golgi. Une étape de maturation a lieu dans les vésicules golgiennes (clivages des extrémités N-ter et C-ter par des exopeptidases, clivage dans le peptide par des endopeptidases, amidation sur des acides aminés Glycine, acétylation…). Les vésicules sont ensuite accumulées près de l'extrémité présynaptique, dans l'attente d'une dépolarisation.
Les neurotransmetteurs non peptidiques sont produits à partir d'acides aminés (catécholamines comme l'adrénaline ou la noradrénaline à partir de la tyrosine, le GABA (Gamma AminoButyric Acid)…), de lipides (THC pour TetraHydroCannabinol), etc. Ils sont produits dans le cytoplasme du neurone ou de la cellule excitable et sont activement pompés (par des enzymes utilisant l'ATP ou ATPases) dans des vésicules issues des endosomes ou d'une endocytose.
Le changement de polarité de membrane provoqué par l'arrivée d'un potentiel d'action (PA) au niveau d'une synapse déclenche l'ouverture de canaux calcium membranaires dépendants du voltage (VOC = Voltage Operated Channels). L'augmentation de la concentration en calcium intracellulaire qui en résulte provoque la fusion de la membrane vésiculaire avec la membrane plasmique et la libération des neuromédiateurs. Ce phénomène s'appelle l'exocytose. La biologie cellulaire a montré que cette exocytose était assurée par un complexe appelé SNARE composé principalement de 3 protéines :
VAMP (aussi appelée synaptobrévine), insérée dans la membrane plasmique de la vésicule,
la synta**ne arrimée à la membrane plasmique de la cellule,
SNAP 25 arrimée dans la membrane plasmique,
Lors d'une dépolarisation ouvrant des VOC au calcium (VOC Ca++), une brusque entrée de calcium précipite la fusion de VAMP avec SNAP 25 et la synta**ne, ce qui arrime la vésicule à la membrane plasmique. La modification tridimensionelle de ce complexe ternaire conduit à la fusion de la vésicule avec la membrane et à la libération du neurotransmetteur dans la fente synaptique. La fusion opérée par les SNAREs est considérablement accélérée par la présence dans la membranes des vésicules synaptiques de la synaptotagmine, qui est aujourd'hui considérée comme le détecteur de l'influx calcique grâce à ces deux domaines liant le calcium (C2A et C2B).
Trois mécanismes peuvent arrêter l'exocytose et donc faire cesser la libération de neurotransmetteur dans la fente synaptique :
l'ouverture de canaux potassium, qui ramènent le potentiel de membrane à sa valeur d'origine et inhibent ainsi les canaux dépendants du voltage ;
des pompes calciques, situées sur le réticulum et la mitochondrie, qui captent les ions calcium entrés dans la cellule, ce qui fait cesser le signal calcique ;
disparition des vésicules synaptiques chargées en neurotransmetteur capable de fusionner avec la membrane (fatigue synaptique).
Ces trois mécanismes expliquent en partie l'e**stence de la plasticités synaptiques à plus ou moins long terme.
Les neurotransmetteurs libérés dans la fente synaptique atteignent la membrane postsynaptique par simple diffusion. Avec le délai nécessaire pour provoquer l'exocytose, c'est l'étape qui nécessite le plus de temps dans la transmission synaptique. Dans le cas de la plaque motrice, la concentration en acétylcholine dans la fente atteint une concentration de 100 mmol/l 10 µs après sa libération. Elle mettra environ 100 µs pour revenir à une concentration proche de zéro. Cette disparition du neurotransmetteur de la fente synaptique peut impliquer un recaptage ou une hydrolyse par une enzyme spécialisée. Le codage de l'information étant fréquentiel, il est important de faire cesser l'excitation le plus vite possible.
Les neurotransmetteurs se fixent sur des récepteurs de la membrane postsynaptique. Il en e**ste deux sortes :
les récepteurs ionotropes qui sont des protéines-canal s'ouvrant pour générer un courant ionique ;
les récepteurs métabotropes sont couplés aux protéines G et sont des transducteurs de signal régulant des seconds messagers dans le cytoplasme. Les seconds messagers peuvent s'associer à une protéine-canal ou bien provoquer une cascade de réactions. Parmi les voies métaboliques activées par ces seconds messagers, des facteurs de traduction de l'ADN sont impliqués, ce qui influence le pool de gènes exprimé par la cellule, et donc pourraient être impliqués dans le phénomène de plasticité synaptique à long-terme (LTP) et la mémorisation. Cette voie est beaucoup plus lente que la première.
On assiste alors à une réponse physiologique locale appelée potentiel générateur, potentiel gradué (PG) ou potentiel postsynaptique. On caractérise deux types de potentiel postsynaptique :
le potentiel postsynaptique excitateur (ou PPSE) diminue la différence de potentiel entre les deux côtés de la membrane plasmique. Autrement dit le PPSE dépolarise localement la membrane ;
le potentiel postsynaptique inhibiteur (ou PPSI) augmente la différence de potentiel. Elle hyperpolarise la membrane.
Si la membrane dépasse le seuil critique de dépolarisation, un potentiel d'action est initié. Les PPSI empêchent le déclenchement d'un potentiel d'action alors que les PPSE le favorisent.
En général, un neurone est couvert de synapses excitatrices et de synapses inhibitrices. Il se produit alors une sommation à la fois temporelle et spatiale des entrées synaptiques pour « décider » du déclenchement ou non d'un potentiel d'action. En fait les dendrites ont peu de canaux sodiques dépendants du voltage, responsables du déclenchement du potentiel d'action. Il est donc rare qu'un potentiel d'action y soit déclenché. Les potentiels postsynaptiques se propagent le long des dendrites jusqu'au péricaryon. À la jonction du péricaryon et de l'axone se trouve une région particulièrement riche en canaux sodiques dépendants du voltage, il s'agit du cône d'initiation. C'est au niveau du cône d'initiation que sont générés le plus souvent les potentiels d'actions qui se propageront ensuite le long de l'axone vers d'autres synapses…
Le potentiel d'action, une fois initié, a toujours la même amplitude et le même décourt temporel. Sa valeur informative ne dépend pas de l'importance de la dépolarisation qui l'a initié. C'est cela qu'on appelle la loi du tout ou rien. Si la dépolarisation continue suffisamment longtemps après le déclenchement du potentiel d'action, un autre potentiel d'action peut être initié. Les potentiels d'action codent l'information en fréquence.
Plusieurs molécules étant libérées lors de la transmission synaptique et plusieurs types de récepteurs pour le même neurotransmetteur pouvant être présents sur la même membrane postsynaptique, plusieurs effets peuvent avoir lieu simultanément. C'est par exemple le cas de nombreuses synapses GABAergiques qui présentent un PPSI rapide dû aux récepteurs ionotropes GABAA et un PPSI lent dû aux récepteurs métabotropes GABAB.
Pour éviter que la stimulation du neurone postsynaptique ne se prolonge, deux systèmes éliminent la molécule de l'espace intersynaptique :
la dégradation, qui met en jeu des enzymes spécifiques qui vont métaboliser le neurotransmetteur, mettant fin à son effet sur le neurone postsynaptique exemple la MAO issue des synthèses mitochondriales ;
la recapture, pendant laquelle le neurotransmetteur ou ses précurseurs issus de la dégradation enzymatique est récupéré par le neurone présynaptique, ou par la cellule gliale avoisinante, pour être réutilisé ou détruit.
En général les deux sont associés. Dans le cas de l'acétylcholine, une dégradation limitée est suivie d'une recapture de la choline qui sera utilisée pour resynthétiser l'acétylcholine.
Les substances psychoactives sont des drogues, des médicaments, etc., qui modifient les pe****tions sensorielles, les sensations, l'humeur... Elles ont comme principal mode d'action de modifier le passage des neurotransmetteurs.
Comme pour les neurotransmetteurs, il e**ste plusieurs modes d'action possibles à ces drogues, dont :
se lier aux récepteurs sans entraîner d'effet (effet antagoniste). Les récepteurs ne sont alors plus disponibles pour lier l'agoniste (neurotransmetteur) ;
empêcher ou limiter la sortie ou la destruction de neurotransmetteurs, qui active davantage et plus longtemps le récepteur (exemple du Prozac).
Les conséquences à long terme sont de modifier la réceptivité de la synapse, par exemple en modifiant le nombre de récepteurs, en réaction de défense, ce qui entraîne l'accoutumance et la dépendance.
Lors du réflexe myotatique CF réflexe de fle**on, l'élément présynaptique rencontre la plaque motrice de la fibre musculaire qui est composée d'une membrane plasmique appelée sarcolemme faisant office d'élément postsynaptique et contenant plusieurs centaines de myofibrilles. La jonction neuromusculaire est historiquement très importante puisque ce sont les observations sur le muscle extenseur de la patte de grenouille qui ont donné naissance à l'électrobiologie qui eut un retentissement rapide auprès du grand public, comme en témoigne l'engouement de l'époque pour les phénomènes électriques.
Axone
Jonction
Fibre musculaire
Myofibrille
Élément pré-synaptique
Sarcoplasme
Vésicules synaptiques
Récepteur cholinergique nicotinique
Mitochondrie
L'acétylcholine intervient dans la contraction musculaire lors des réflexes de fle**on ou d'extension au niveau de la jonction neuromusculaire. Les neurones la produisant s'appellent neurones cholinergiques. Ses précurseurs sont la choline d'origine alimentaire qui est captée par la terminaison présynaptique dans le sang et l'acétylcoenzyme A d'origine mitochondriale. Ils sont synthétisés par l'enzyme choline-acétyltransférase (CAT) qui les transforment en acétylcholine. Ces neuromédiateurs sont alors enveloppés par des vésicules provenant du bourgeonnement de l'appareil de Golgi et sont transportés jusqu'au renflement (ou bouton) synaptique. Au niveau présynaptique il y a non pas un seul renflement mais des centaines afin d'assurer une surface de contact plus large, on parle d'arborisation terminale.
Sous l'effet du calcium, les vésicules chargés de neuromédiateurs fusionnent avec la membrane plasmique, déversant leur contenu dans la fente synaptique (exocytose). Les neuromédiateurs se fixent alors sur des récepteurs spécifiques de la plaque motrice du muscle squelettique ce qui a pour conséquence de provoquer sa contraction. L'excès de neuromédiateur est ensuite dégradé par une enzyme : acétylcholinestérase (ACHE) qui libère de l'acide acétique et de la choline qui pourra être ensuite recapturée par les récepteurs de l'axone présynaptique et recyclé.
Dans la synapse électrique, les membranes des deux neurones sont reliées par des jonctions communicantes, parfois appelées également nexus (GAP junctions). Les ions se transmettent donc d'une cellule à une autre, ainsi que la dépolarisation membranaire associée. L'influx nerveux se transmet sans intervention de neurotransmetteur. Ce type de synapse, qui joue un rôle important dans le système nerveux immature, est ensuite relativement rare au stade adulte et est majoritairement retrouvé chez les invertébrés. Ce type de communication est très fréquent dans les épithéliums.
Mitochondrie
**
Courant ionique
Les caractéristiques principales de ce type de synapse sont :
un délai de transmission quasi-ine**stant (pas de temps de latence dû au franchissement d'une synapse, souvent utile pour la synchronisation d'un réseau de neurone) ;
une conduction dans les 3 directions de l'espace ;
l'absence de période réfractaire (la synapse est re-stimulable immédiatement après la fin de la transmission) ;
Les synapses sont regroupées selon deux catégories selon les effets qu'elles engendrent : excitatrices ou inhibitrices. Le principal neuromédiateur inhibiteur du cerveau est le GABA qui se fixe sur les canaux récepteurs GABAA dont l'ouverture provoque un influx d'ions chlorure et donc une hyperpolarisation de la membrane. Il e**ste une plus grande diversité de récepteurs ionotropes excitateurs, par exemple les récepteurs au glutamate ou à l’acétylcholine. L'élément postsynaptique possède en général ces deux catégories de récepteurs ainsi que des canaux sodium ou calcium activés par dépolarisation. Il réalise une sommation temporelle des signaux excitateurs (PPSE, potentiel postsynaptique excitateur) et inhibiteurs (PPSI, potentiel postsynaptique inhibiteur). Il propagera le potentiel d'action à la condition que la somme des excitations soit supérieure à la somme des inhibitions et si un seuil de dépolarisation est atteint. Ce seuil correspond au voltage auquel un nombre suffisant de canaux sodiums sont activés.
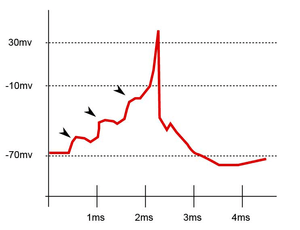
La sommation spatiale se réfère aux différentes synapses afférentes à l'élément postsynaptique. Un neurone peut en effet recevoir plus d'un millier d'afférences différentes mais il ne peut réagir que d'une seule manière : conduction ou absence de conduction. Si le résultat de la somme algébrique de tous les éléments afférents est supérieure à une valeur seuil, aux environs de -15 mV dans le schéma ci-contre, le neurone intégrateur sera le siège d’un potentiel d’action.
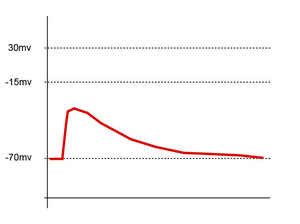
Une sommation dite temporelle a aussi lieu au niveau de l’élément postsynaptique. Elle est due à la vitesse d'entrée des ions à l'intérieur de la cellule. Si beaucoup de PPSE sont rapprochés dans le temps, ils s'ajoutent et peuvent également atteindre le seuil de dépolarisation et donner lieu à un potentiel d’action.
Un dernier élément d’intégration est dû à l’e**stence de la période réfractaire du neurone. Si deux signaux afférents excitateurs sont espacés de moins d'une milliseconde, le second ne donnera naissance à aucun PPSE et sera donc silencieux.
L'anomalie de fonctionnement de la synapse neuro-musculaire est responsable d'une maladie neuromusculaire nommée myasthénie.
La structure des organismes biologiques qui constituent la biosphère peut être décomposée en plusieurs niveaux d'organisation : atomique, moléculaire, cellulaire, tissulaire, organique, des systèmes, et enfin celui de l'organisme dans sa totalité fonctionnelle.
L'étude scientifique du vivant se fait par des recherches sur les éléments de chacun de ces niveaux, puis par la compréhension des interactions entre ces différents niveaux (voir l'article « Méthode scientifique »).
L'étude du niveau synaptique permet de comprendre les caractéristiques de la transmission des signaux bioélectriques et chimiques, entre les neurones eux-mêmes ou entre les neurones et certains éléments de l'organisme (cellule sensorielle, muscle lisse ou strié…). La compréhension de la transmission des signaux neuraux est une nécessité incontournable car ce mécanisme est fondamental dans le fonctionnement du système nerveux.
Cellule gliale
Plasticité synaptique
Potentiel postsynaptique
Réflexe d'extension
Réflexe de fle**on
Cerveau
Moelle épinière
Classement thématique des neurosciences
Histoire de l'électrophysiologie
Électrophysiologie
Potentiel de repos
Biophysique des canaux ioniques
Portail des neurosciences
突触(法语、英语、德语: Synapse)是神经元之间,或神经元与肌细胞、腺体之间通信的特异性接头。神经元与肌肉细胞之间的突触亦称为神经肌肉接头(neuromuscular junction)。
中枢神经系统中的神经元以突触的形式互联,形成神经元网络。这对于感觉和思维的形成极为重要。突触也是中枢神经系统和身体的其它部分,例如肌肉和各种感受器交换信息的渠道。
神经元之间的突触可以分为化学突触和电突触两大类(electrical synapse)。前者的工作机制是一种称为神经递质的信号分子的释放和接收,两个神经元之间没有直接的电气耦合。后者是两个神经元之间的直接电气耦合。化学突触较电突触更为常见,类型更为丰富,下文将着重介绍化学突触。
典型突触的结构 突触后致 密物质 电压依赖 性钙信道 突触小泡 再摄 取泵 受体 神经递质 轴突终末 突触间隙 树突 典型的化学突触是在两个神经元之间形成的单向通信机制。神经信息的流向是从突触前细胞到突触后细胞。突触通常形成在突触前细胞的轴突和突触后细胞的细胞体或树突之间。在常见的突触中,从突触后细胞的细胞膜上伸出一个称为突棘的突起物,与突触前细胞的轴突相对,形成一个宽约20 nm的空隙,成为突触间隙。 突触前膜内的突触小泡含有事先在细胞体内合成并且转运过来的神经递质分子。这些神经递质在突触前细胞发生冲动(动作电位)时,钙离子信道负责将去极化转化成神经递质的释放。这一过程称为兴奋-分泌耦合(Excitation-secretion coupling)。神经递质被通过胞吐作用释放到突触间隙后,扩散到突触后膜,并与其上的特异性神经递质受体结合,产生突触后细胞的局部电位、基因表达或其它结果。
化学突触内的通信依赖于神经递质释放和接受。突触前膜在突触前细胞发生动作电位时释放神经递质。动作电位产生在神经元的轴丘,以有限的速度传导到突触前膜,导致突触前膜上的电压门控钙离子信道的打开,形成钙的内向电流。进入突触前膜内钙离子通过一系列化学反应导致突触小泡与突触前膜的融合,以及神经递质的释放。一种称为SNARE的蛋白是这一融合过程的关键环节。 神经递质被释放以后,通过突触间隙扩散到突触后膜上,与突触后膜上的特异性受体相结合。所谓受体的特异性,一方面是指一种受体通常只能与一种神经递质相结合,另一方面是指一种受体只能在突触后细胞内产生一种作用。由于神经递质和受体的不同,突触可以在突触后细胞内产生多种不同的结果。常见的一种结果是突触后膜上的跨膜电流。该跨膜电流造成突触后膜的跨膜电位的改变,称为突触后电位。 去极化的跨膜电流造成兴奋性的突触后电位(EPSP),超极化的跨膜电流造成抑制性的突触后电位(IPSP)。 另一种常见的结果是影响突触后细胞的代谢或者基因表达。 释放出来的神经递质必须通过一些机制从突触间隙中除去,才能使一次突触事件正常结束。有多种此类机制,包括神经递质在酶解、神经递质被突触前膜的重吸收、以及神经递质被突触后膜吸收。
对于中枢神经系统内的大多数神经元来说,突触是其神经信号的唯一输入渠道。与某一神经元相连的所有前级细胞都通过突触向细胞传递关于自身兴奋状态的信息。 对于兴奋性突触后电位(EPSP)来说,如果其幅度足够大,距离动作电位产生的部位足够近,单独一个EPSP就可以造成突触后细胞的一次动作电位发放。但是在大多数情况下,突触后细胞的一次动作电位是其许多突触产生的突触后电位的空间和时间集成的结果。所谓空间集成是指不同部位的突触对突触后细胞产生的不同兴奋作用的综合,所谓时间集成是指同时或不同时发生的突触时间对突触后细胞的作用的综合,这两者密不可分。 抑制性突触后电位(IPSP)造成突触后细胞的局部超极化,其作用是降低突触后细胞发生动作电位的概率,所以是EPSP的拮抗者。中枢神经系统中的大多数神经元都同时收到EPSP和IPSP的影响,从而实现足够复杂的神经计算。 生物突触的这一工作机制,是许多神经网络的灵感来源。
突触前膜内神经递质的储备量
突触前膜兴奋-分泌耦合(Excitation-secretion coupling)的强度
突触后膜上的受体的多寡
神经递质释放后的重吸收快慢
对于动物体内的突触来说,突触的强度并非一成不变,而是时刻都由于突触自身的活动历史,以及其它一些作用因素而发生改变和调整。这一调整过程,被认为和神经系统的发育、学习和适应等过程密切相关,乃至是其关键环节之一。 一些突触的强度可以由于长期高频率活动而得以增加,这一效应称为长期增强作用。与之相对的另一种效应称为长期抑制作用。一种称为NMDA的谷氨酸受体信道被认为与长期增强作用密切相关。