Les métaux sont une classe de matériaux très utilisés dans de nombreux domaines : construction (charpentes métalliques, menuiserie en aluminium), plomberie (tuyaux, robinets), véhicules (du vélo à l'avion), machines industrielles, armement, etc.
Les métaux sont également de plus en plus employés dans la plupart des techniques de pointe : accumulateurs électriques, cartes électroniques, écrans plats LCD, capteurs solaires photovoltaïques, lampes fluo-compactes, diodes électroluminescentes, etc. La consommation des métaux s'est ainsi très fortement accrue depuis les années 1980, au point que certains métaux rares sont devenus des matières premières minérales critiques.

Métal chauffé par un forgeron.
Généralités
Les métaux ont en commun certaines propriétés comme notamment
la conduction électrique ;
la conduction thermique ;
la ductilité, ou malléabilité : on peut souvent les déformer par martelage ;
la réflexion de la lumière, l'éclat métallique ;
ils sont « lourds » : leur densité par rapport à l'eau est en général supérieure à 2 pour les métaux les plus utilisés, et est fréquemment supérieure à 7, avec quelques exceptions (sodium, potassium, lithium) ;
ils sont en général présent dans la nature sous forme de minerai, qu'il faut transformer en métal (métallurgie primaire), à quelques exceptions près (or, fer météorique, cuivre natif et autres éléments natifs) ; ils ont tendance à retourner à cet état naturel, ce qui forme un des processus de dégradation (corrosion), la rouille du fer pouvant être vue comme un « retour du fer à l'état minéral » ;
ils sont en général faciles à réparer : les métaux peuvent parfois être remis en forme (par exemple redressage de tôles) ou soudés ;
ils sont en général faciles à recycler : souvent faciles à trier, du fait de leurs propriétés magnétiques (cas en particulier du fer), électriques (permettant de créer un champ magnétique induit et donc de les attirer ou repousser par un aimant) ou de résistance mécanique (par exemple élimination de la gaine autour d'un câble électrique), ils peuvent en général être refondus.
souvent faciles à trier, du fait de leurs propriétés magnétiques (cas en particulier du fer), électriques (permettant de créer un champ magnétique induit et donc de les attirer ou repousser par un aimant) ou de résistance mécanique (par exemple élimination de la gaine autour d'un câble électrique),
ils peuvent en général être refondus.
Ils sont souvent utilisés sous forme d'alliages (« mélanges » de métaux) : d'une part, historiquement, il était très difficile d'obtenir des métaux purs, les minerais contenant plusieurs métaux ; d'autre part, le fait d'allier les métaux leur confère des propriétés particulières, qui sont souvent plus intéressantes que celles des métaux purs. On peut retenir de manière générale que :
un métal pur a une meilleure conductivité thermique et électrique ; on utilise par exemple du cuivre ou de l'aluminium pur pour réaliser des câbles électriques (parfois de l'or et de l'argent) ;
un métal pur est plus « mou », il se déforme plus facilement, ce qui permet de l'étirer et de lui donner des formes complexes ; par exemple, le cuivre pur peut être étiré pour former des fils électriques, des tuyaux (plomberie), être mis en plaque et martelé pour faire des casseroles, on peut former des feuilles très fines avec de l'or pur ;
à l'inverse, certains éléments d'alliage permettent de durcir le métal, de le rendre plus résistant ; c'est par exemple le cas du carbone qui durcit le fer pour donner de l'acier, de l'étain qui durcit le cuivre pour donner le bronze, de l'argent et du cuivre qui durcissent l'or ;
certains éléments d'alliage facilitent la fusion et donc la fabrication de pièces moulées (fonderie), par effet d'eutexie : l'alliage plomb-étain fond facilement et est utilisé pour la brasure, le bronze et le laiton sont des alliages de cuivre souvent utilisés en fonderie, certains éléments d'alliage permettent de réaliser de la fonderie d'aluminium, le carbone en quantité suffisante dans le fer permet d'obtenir de la fonte ;
certains éléments d'alliage améliorent la résistance à la corrosion, comme dans le cas des aciers inoxydables.
Dans la classification périodique, les métaux sont au centre et à gauche. Ils constituent 91 des 118 éléments chimiques connus.
Le fer est le plus utilisé des métaux, il est à la base de toutes les grandes constructions métalliques (poutre, rail, coque de navire), suivi de loin par l'aluminium qui est plus abondant dans la croûte terrestre, mais plus difficile à élaborer. D'autres métaux, moins abondants, comme le cuivre sont utilisés pour des applications spécifiques (fil électrique, ustensiles de cuisine). Les métaux encore moins abondants sont utilisés dans des alliages (chrome, manganèse, titane), et les plus rares sont utilisés pour la monnaie et les bijoux (argent, or) ou pour faire des catalyseurs (platine, rhodium). L'uranium est un métal qui, après séparation isotopique, permet d'obtenir de l'énergie nucléaire. D'autres métaux, trop réactifs à l'air et/ou à l'eau sont rarement utilisés à l'état métallique (sodium, potassium, calcium).
Dans un certain nombre de cas, les métaux tendent à être remplacés par d'autres matériaux, en général pour des raisons de légèreté (polymères, matériaux composites, céramiques), de résistance à la corrosion (idem) ou à l'usure (céramiques). Ces matériaux ont toutefois eux aussi leurs limites par rapport aux métaux, en particulier : les polymères et composites à matrice polymère ne sont pas utilisables à hautes températures et sont souvent plus souples, les céramiques résistent mal aux chocs.
Les métaux peuvent perdre un ou plusieurs électrons pour former des cations correspondant, par exemple le sodium Na → Na + e, le calcium Ca → Ca + 2e, le fer Fe → Fe + 3e. Les ions métalliques formés se retrouvent dans des sels, par exemple chlorure de lithium LiCl ou sulfure d'argent Ag2S, ou en solution.
Les métaux sont pour la plupart solides à température ambiante, le plus souvent jusqu'à des températures assez élevées : jusqu'à plus de 3 000 °C pour certains. Quelques métaux sont liquides aux températures courantes, c'est le cas du mercure, de moins en moins utilisé à cause de sa toxicité, qui est liquide dès -39 °C, ou du gallium liquide dès 30 °C. Les métaux peuvent être décrits à l'état solide comme des cations métalliques ayant mis en commun des électrons délocalisés dans tout le solide. À l'état de sels, les solides sont décrits par des interactions électrostatiques avec les autres ions du cristal.
Certains métaux existant à l'état natif sont connus depuis des millénaires : l'or, l'argent, le cuivre. L'homme sait élaborer certains métaux depuis longtemps, comme le fer (âge du fer), à partir de minerais de fer et de charbon de bois, ou le mercure, en chauffant une roche appelée cinabre. Des métaux d'usage courant comme l'aluminium n'ont été obtenus qu'au XIX siècle. Certains autres sont artificiels et sont préparés, atome après atome, dans les accélérateurs de particules : c'est le cas du technétium et des éléments transuraniens (c'est-à-dire de numéro atomique (Z) supérieur à celui de l'uranium pour lequel Z =92). D'autres, extraits de minerais, sont plus récents.
Définition

Séparation des métaux et non-métaux dans le tableau périodique des éléments.
Historiquement, un métal est un matériau obtenu à partir de minerai (du grec metallon, « mine, tranchée ») ; il est donc défini par sa méthode d'obtention. De manière moderne, un métal est défini comme un matériau dont la cohésion des atomes est assurée par la liaison métallique : tous les atomes de l'objet mettent un ou plusieurs électrons en commun. Ceci explique en particulier la bonne conductivité électrique, puisque des électrons circulent « librement », et leur facilité à céder un électron et donc former un cation ; ceci explique également qu'ils soient naturellement sous forme de minerai (les cations métalliques s'associant à d'autres éléments pour former des roches). Par ailleurs, les atomes s'agencent de manière régulière pour former des cristaux ; lorsque les atomes s'agencent de manière amorphe, on parle de verre métallique. Cette structure cristalline est très importante pour les propriétés du métal (en particulier formabilité, résistance mécanique, résistance à la corrosion).
Certains matériaux ont une liaison partiellement métallique et donc sont à la limite des céramiques, par exemple les intermétalliques.
Dans le tableau périodique des éléments, la diagonale partant du bore (B) et allant jusqu'au polonium (Po) sépare les éléments métalliques (en bas à gauche) des éléments non métalliques (en haut à droite). Les éléments placés de part et d'autre cette ligne ne possèdent pas un caractère métallique aussi prononcé que les autres métaux. À droite de cette ligne, les éléments sont des non-métaux, terme préféré au terme désuet « métalloïde ».
De plus, le caractère métallique des éléments d'une même colonne augmente avec le nombre d'électrons (c'est-à-dire lorsque l'on descend dans le tableau). Par exemple, le carbone-diamant (Z = 6) est un isolant, le silicium (Z = 14) est un semi-conducteur et l'étain (Z = 50) est un métal.
Propriétés
Propriétés physico-chimiques
Les métaux sont en général des solides cristallins dans les conditions normales de température et de pression (CNTP) ; le mercure est toutefois une exception notable puisqu'il est le seul métal à l'état liquide dans les conditions normales (25 °C sous pression atmosphérique) ;
L'hydrogène n'est pas considéré comme un métal, bien que sa position sur le tableau périodique des éléments, son aptitude à donner facilement des ions positifs pourrait le laisser penser. Des découvertes récentes montrent que, dans certaines condition, il existe une phase métallique de l'hydrogène.
Les métaux ont presque toujours un nombre d'oxydation positif : ils ne forment donc que des cations. Les cas de métaux avec un nombre d'oxydation négatifs se rencontrent avec certains complexes carbonyles comme Fe(CO)5 ou dans le cas de Na.
La plupart du temps, les métaux sont extraits sous forme minérale plus ou moins cristallisée (cristal) dans leurs minerais et presque toujours combinés à un ou plusieurs autres atomes. Les métaux sont présents à l'état naturel sous forme :
associée à des éléments non-métalliques, sous forme : d'oxyde (cas le plus fréquent), dans des minerais : bauxite pour l'aluminium, hématite pour le fer, ilménite ou rutile pour le titane... L'ilménite, par exemple, principal minerai du titane est un oxyde mixte de titane et de fer (pourcentage des deux métaux entre 30 et 70 %) ; de sulfures pyrite pour le fer ou de sulfates ; plus compliquée et même sous plusieurs formes différentes comme on l'a vu pour le fer.
d'oxyde (cas le plus fréquent), dans des minerais : bauxite pour l'aluminium, hématite pour le fer, ilménite ou rutile pour le titane... L'ilménite, par exemple, principal minerai du titane est un oxyde mixte de titane et de fer (pourcentage des deux métaux entre 30 et 70 %) ;
de sulfures pyrite pour le fer ou de sulfates ;
plus compliquée et même sous plusieurs formes différentes comme on l'a vu pour le fer.
pure ou associée à des éléments métalliques (alliages) : On parle alors de métaux natifs. Ils incluent : bismuth, cadmium, chrome, indium, fer, nickel (dans des roches d'origine météoritique (nickel-fer)), tellure, antimoine, titane, zinc, cuivre, plomb et mercure ainsi que les métaux nobles (métaux qui résistent à la corrosion et à l'oxydation...) englobant les métaux précieux. Les métaux nobles peuvent être présents dans la nature sous forme : pure : or, argent et platine ; associée au platine dans un minerai et appelé platinoïde (ruthénium, rhodium, palladium, osmium, iridium, platine).
pure : or, argent et platine ;
associée au platine dans un minerai et appelé platinoïde (ruthénium, rhodium, palladium, osmium, iridium, platine).
Seul l'argent, le cuivre, le platine, et surtout l'or, sont présents dans la nature en grande quantité à l'état natif.
Animation illustrant la théorie des bandes d'énergie appliquée aux métaux et isolants.
Propriétés électriques
Les métaux conduisent généralement bien l'électricité et la chaleur; en tête : l'argent, le cuivre et l'or.
La conduite électrique dans les métaux peut être analysée de manière microscopique ou macroscopique.
D'un point de vue microscopique, la principale raison vient de la liaison métallique. Les atomes métalliques forment des structures 2D ou 3D qui se répètent, appelées mailles. À l'intérieur, des électrons à peu près libres circulent entourés des atomes dont ils sont issus. C'est ce mouvement électronique qui est responsable de la bonne conduction; plus ces électrons sont libres, plus le métal est bon conducteur. Ces électrons plus ou moins libres sont appelés « électrons de conduction ».
D'un point de vue macroscopique, c'est la théorie des bandes d'énergie qui fournit la réponse. En effet, dans les métaux la bande d'énergie la plus haute occupée et la plus basse vacante se chevauchent, ou au moins se touchent. Il faut ainsi peu d'énergie pour exciter un métal et plus il est facile de l'exciter, plus un métal pourra céder un électron et meilleur conducteur il sera.
Propriétés magnétiques
Quelques métaux présentent des propriétés magnétiques remarquables comme le ferromagnétisme, essentiellement le fer, le cobalt et le nickel à température ambiante. Certaines terres rares (Lanthanides dans la classification périodique) sont également ferromagnétiques à basse température. Les propriétés de magnétisme varient lorsqu'on fait des alliages ce qui peut être mis à profit pour créer des aimants puissants ou annuler le magnétisme d'un métal (le fer typiquement).
Spécification chimique
Les différents états d'oxydation, conformations, complexes ou formes transitoires représentent des espèces chimiques distinctes d'un élément et jouent un rôle majeur dans l'élaboration, la corrosion, ainsi que sur leur biodisponibilité et leur toxicité ou écotoxicité. Certaines espèces d'éléments traces métalliques (ÉTM) sont plus facilement assimilables par les organismes que d'autres, ce qui engendre des effets bénéfiques ou néfastes selon la nature et la concentration du métal (élément essentiel ou non).
Il ne faut pas confondre la spéciation chimique d'un élément avec son fractionnement ou sa partition. La littérature scientifique confond quelquefois ces concepts ce qui complexifie les recherches dans ces domaines.
spéciation chimique : c'est la distribution d'un élément selon différentes catégories d'espèces chimiques dans un système ;
fractionnement : c'est la classification d'un élément ou d'un groupe analysé par rapport à ses propriétés physiques et/ou chimiques (grosseur de particules, solubilité, force de liaison, etc.) ;
partition : répartition d'un composé dans les différentes phases d'un système (solide, liquide, atmosphère, matière organique, etc.) selon des coefficients de partition spécifiques.
Cette section décrit donc les principales catégories d'espèces chimiques relatives aux ÉTM et présente des exemples d'espèces chimiques de niveau toxique varié.
Oxydation & réduction
Comme indiqué précédemment, les métaux se trouvent en général naturellement dans des minerais ; ils sont à l'état oxydé. Par exemple, le fer se trouve à l'état Fe(III) dans l'hématite, à l'état Fe(II) et Fe(III) dans la magnétite, l'aluminium dans l'état Al(III) dans la bauxite… La métallurgie primaire consiste essentiellement en la réduction du minerai pour obtenir un état d'oxydation (0).
À l'inverse, en réagissant avec l'environnement, le métal va s'oxyder et se dissoudre dans l'eau ou bien se lier à d'autres atomes ou ions, en particulier l'oxygène et l'ion hydroxyle. C'est un des mécanismes principaux de la corrosion.
L'état d'oxydation des métaux dans un système influence leurs effets sur les organismes. Par exemple, le chrome(III) est un élément essentiel (c'est-à-dire nécessaire pour le bon fonctionnement de l'organisme) et pénètre difficilement les membranes lipidiques des cellules. En revanche, le Cr(VI), qui s'avère toxique pour certains gènes, est cancérigène et pénètre facilement dans les cellules grâce à des transporteurs spécifiques. Dans d'autres cas, ce sont les formes moins oxydées qui sont toxiques, par exemple avec l'arsenic dont la toxicité est plus importante pour As(III) que pour As(V).
Composition isotopique
La composition isotopique de quelques éléments influence leur abondance ou leur toxicité dans l'environnement. Par exemple, le plomb comporte une vingtaine d'isotopes dont quatre sont stables : Pb, Pb, Pb et Pb. Les Pb et Pb proviennent de la dégradation de l'uranium et le Pb résulte de la dégradation du thorium, deux éléments radioactifs ; ainsi, l'abondance de ces isotopes s’accroit dans le temps, et la composition isotopique du plomb évolue donc selon les sources d'émission stimulées. Un autre exemple intéressant de variation de la toxicité est lié à la composition isotopique de l'eau (H2O) : remplacer 60 % de l'eau du corps de rongeurs par de l'H2O est sans effet alors qu'une substitution de 30-40 % de cette eau par du D2O engendre la mort de ces animaux.
On peut chercher à trier les isotopes, par exemple pour enrichir la matière en isotopes radioactifs, comme dans le cas de l'enrichissement de l'uranium pour produire du combustible nucléaire. On peut à l'inverse chercher à appauvrir le métal, comme dans le cas des munitions à uranium appauvri.
Les isotopes métalliques sont utilisés comme traceurs pour les phénomènes de diffusion : on élabore un métal contenant une quantité notable d'isotope radioactif, et le profil de radioactivité permet de suivre la progression de ces atomes.
Composé et complexe inorganique
Les métaux s'allient souvent à des ligands inorganiques pour former des composés ou complexes inorganiques possédant des propriétés physico-chimiques différentes. Par exemple, la charge, la solubilité, le coefficient de diffusion ou la force de liaison de ces composés influencent le transport et par conséquent la biodisponibilité et la toxicité des métaux dans les organismes. Par exemple, certains sels de nickel comme les chlorures (NiCl2) et les sulfates (NiSO4) sont solubles dans l'eau et de faible toxicité orale, alors que les sulfures de nickel (Ni3S2) sont pratiquement insolubles dans l'eau mais sont cancérigènes.
Composé organique
Les composés organiques tel les sucres, acides organiques, lipides ou autres composés organiques de faible poids moléculaire ont des affinités plus ou moins importantes avec les métaux. Certains d'entre eux, des acides organiques comme l'acide citrique et l'acide malique, contiennent un groupement fonctionnel (l'hydroxylcarboxyle) qui se lie facilement aux métaux et qui diminuent leur biodisponibilité; ces composés sont très étudiés en écotoxicologie terrestre car ils sont excrétés par les racines des plantes et les micro-organismes du sol, créant une synergie qui diminue la toxicité des métaux dans le sol.
Certains composés organiques particuliers que l'on nomme chélateurs, comme l'EDTA, forment des complexes très stables avec les métaux. Les chélateurs sont des ligands solubles polydentés faiblement acides qui forment des complexes chélateur-métal thermodynamiquement forts ; ils sont quelquefois utilisés pour la restauration des eaux et des sols contaminés aux métaux ou dans les méthodes analytiques chimiques pour extraire les métaux d'une matrice.
Composé organométallique
Les composés organométalliques contiennent une liaison entre le carbone et le métal. Cette liaison peut être de nature covalente ou ionique; par exemple, les liaisons carbone-sodium et carbone-potassium sont fortement ioniques, les liaisons carbone-étain, carbone-plomb et carbone-mercure sont fortement covalentes et les liens carbone-lithium et carbone magnésium se situent entre la liaison ionique et la liaison covalente.
Par exemple, la bioalkylation, c'est-à-dire la formation d'un alkyle (CHx) avec un métal par des micro-organismes spécifiques, est un processus fréquent dans les sols et les sédiments. Or, bien que la méthylation des métaux (lien CH3-métal) forme des composés plutôt toxiques, certains alkyles métalliques d'arsenic et de sélénium détoxifient le métabolisme de l'humain et d'autres organismes vivants. Néanmoins, la plupart des produits organométalliques résultant d'une bioalkylation sont d'origine anthropogénique, comme certains fongicides ou produits de combustion d'essence, et sont très toxiques pour le système nerveux central de certains organismes (comme les dérivés d'alkyles d'étain, de plomb ou de mercure et d'or).
Composé ou complexe macromoléculaire
Les composés ou complexes macromoléculaires sont à la limite de représentation des espèces chimiques. Ils forment malgré tout une catégorie distincte car ils jouent un rôle particulièrement important dans la biodisponibilité des métaux pour les organismes vivants. En effet, les acides humiques et fulviques résultant de la biodégradation de la matière organique sont des anions mobilisant les ÉTM contenus dans les sols et dans les eaux. Les acides humiques et fulviques ont des structures et une composition très variables et complexes mais joueraient un rôle significatif sur la spéciation des métaux.
D'autres particules organiques et inorganiques tels la biomasse et les colloïdes adsorbent les métaux et diminuent ainsi leur toxicité en réduisant leur biodisponibilité. Par contre, d'autres macromolécules anioniques des organismes vivants, comme certains acides nucléïques ou les glycosaminoglycanes, se lient involontairement aux ÉTM et provoquent des mutagenèses dommageables pour l'organisme.
Paramètres influençant la spéciation des métaux
La spéciation des métaux dans les phases aqueuses et solides est influencée par plusieurs paramètres (Voir aussi section Environnement de cette page) :
le pH : en général, un pH acide tend à solubiliser les métaux alors qu'un pH alcalin favorise leur adsorption ;
la matière organique : la matière organique adsorbe les métaux et est synonyme de stabilité (non biodisponibilité) ;
la concentration des ligands : plus la concentrations des ligants inorganiques et organiques est élevée, plus le métal se lie à ce ligand et forme une espèce chimique populeuse ;
la force du lien ionique ou covalent : plus le lien métal-composé est fort, plus l'espèce chimique associée à ce composé sera stable ;
la stœchiométrie : les principes stœchiométriques doivent évidemment être respectés pour engendrer la formation des composés.
Cette spéciation implique que l'équilibre chimique est atteint. Or, la complexation des métaux avec les ligands inorganiques est très rapide car ils sont nombreux dans la phase aqueuse, mais la complexation des métaux avec les ligands organiques nécessite plus de temps car les sites d'adsorption ou d'attachement sont moins accessibles. Par conséquent, il est préférable d'analyser la spéciation d'une contamination métallique sur une matrice contaminée stable depuis plusieurs années qu'une matrice fraîchement contaminée avec une dynamique chimique évolutive, sans quoi les analyses risquent d'être biaisées.
De plus, la constante d'équilibre relative à la notion d'équilibre chimique peut être illustrée par la réaction :
Métal + Ligand → Métal-Ligand
La constante d'équilibre Kéq associée à cette équation varie selon le type de lien :
Lien ionique: ~ 10 < Kéq < 10
Complexe: ~ 10 < Kéq < 10
Chélateur: ~ 10 < Kéq < 10
Ainsi, puisque Kéq est relativement faible pour les paires ioniques et plus élevée pour les complexes, les métaux préfèrent s'associer à long terme aux complexes stables qu'aux paires ioniques de plus faible énergie de liaison.
Économie et géopolitique
Raréfaction des ressources
Le développement de nombreuses industries telles que l'électronique, les technologies de l'information et de la communication, et l'aéronautique, et le pari du « tout technologique » dans la recherche du rendement et de l'efficacité, ont conduit à une augmentation sans précédent de la production et de la consommation de métaux. La période de croissance de 1990 à 2010 a conduit à un doublement de la production des principaux métaux. Alors que dans les années 1970, on utilisait moins de 20 métaux dans la table de Mendeleïev, on en consomme environ 60 depuis les années 2000.
Il y a une tendance à la baisse de concentration moyenne des minerais. Par exemple, la concentration moyenne des minerais de cuivre exploités est passée de 1,8 % dans les années 1930 à 0,8 % en 2010. Parallèlement, les réserves, exprimées au niveau de production 2008, se situent pour la plupart des métaux entre 20 et 100 ans de production annuelle.
Géopolitique
Depuis très longtemps les mines de certains métaux (précieux ou communs mais indispensables à l'industrie), les installations de raffinage, voire certains secrets de fabrication étaient considérés comme d'intérêt stratégique par les États. Les raisons militaires et l'avènement des armes et munitions métalliques puis de l'énergie et de l'arme nucléaire ont accru l'importance de certains métaux. Même pour des métaux géologiquement non rares comme le cuivre, mais faisant l'objet d'un marché fluctuant, de fortes hausses de cuivre se traduisent aussi par l'accroissement de vols de métaux (à titre d'exemple, en France, en 2010, RFF et la SNCF ont subi 2 100 vols de cuivre (quatre fois plus qu'en 2009) qui ont causé des dysfonctionnements et plusieurs dizaines de millions d'euros de préjudice par an pour la SNCF.
La consommation de certains métaux autrefois sans valeur s'est fortement accrue au XX siècle, avec par exemple l'uranium (fortement demandé pour des usages militaires et civils), les métaux du groupe du platine (principalement utilisés pour les pots d'échappements catalytiques, comme catalyseur industriel ou pour les chimiothérapies anticancéreuses) la surexploitation des ressources minières les plus accessibles ou les plus « pures » et malgré les économies permises par un recyclage d'une partie des métaux constituant les produits en fin de vie ou les chutes de production, la notion de métaux stratégiques est encore prégnante. Ainsi, la France a créé en 2011 un « Comité pour les métaux stratégiques », chargé d'aider le ministère à élaborer et mettre en œuvre une politique rénovée de gestion de ces métaux, via notamment des approvisionnements mieux sécurisés. Le ministre chargé des matières premières en préside les trois collèges (administrations, organismes techniques et fédérations professionnelles et industriels). La FEDEREC (fédération des entreprises du recyclage) et la FEDEM (fédération des minerais, minéraux industriels et métaux non ferreux) y participent.
Environnement
Contrairement aux composés organiques, les métaux ne sont pas biodégradables par les micro-organismes. Cette caractéristique engendre certains problèmes de gestion de la contamination métallique. En effet, le sort des métaux dans l’environnement pose de grands défis analytiques; les métaux se retrouvent sous plusieurs formes dans le sol et dans l'eau (complexe avec la matière organique du sol, avec les minéraux, précipitation, ions libres, etc.) complexifiant les prédictions de toxicité et d'écotoxicité.
Toxicité et écotoxicité terrestre
La toxicité et l'écotoxicité des métaux dans les sols sont étroitement liées à leur caractéristiques propres (radioactivité éventuelle et type de radioactivité, métal lourd, toxicité chimique, micro ou nanoparticules, etc.), spéciation chimique et biodisponibilité ; plus l'espèce métallique est libre et mobile, plus elle est biodisponible et plus il y a un risque de toxicité sur les organismes vivants. En général, les ions métalliques libres (en solution) constituent la forme chimique la plus disponible pour les organismes et donc la plus susceptible d'être toxique. Cependant, d'autres espèces ou fractions de métaux peuvent être instables et mobiles (fraction labile ou liée aux oxydes libres par exemple) et engendrer un risque pour les organismes.
Certains métaux (fer, cuivre et zinc notamment) sont des éléments essentiels. Ils sont toxiques au-delà d'une certaines dose, mais une carence entraine des troubles métaboliques graves.
Ainsi, plusieurs paramètres influencent la toxicité des métaux dans les sols:
le pH : généralement, un pH acide solubilise les métaux normalement immobiles et augmente donc le risque de toxicité ;
la composition du sol : les argiles et la matière organique du sol adsorbent les contaminants et les séquestrent sous forme de complexes stables faiblement mobiles, alors que les particules plus grosses comme le sable ou le gravier retiennent moins les métaux du sol ;
le temps passé après une contamination aiguë, ou le temps durant lequel une contamination chronique a eu lieu : un site fraîchement contaminé ne présente pas nécessairement plus de toxicité qu'un site ayant subi une contamination diffuse mais étalée sur plusieurs années ou décennies ;
le niveau de saturation des sites d'adsorption : plus les sites sont capables de fixer, les métaux approchent leur niveau de saturation, plus le métal aura tendance à se solubiliser ou se rendre biodisponible.
Empreinte énergétique
Pour aller de la mine à un objet façonné, il faut passer par de nombreuses étapes et utiliser beaucoup d'équipements qui consomment de l'énergie. Les métaux étant pratiquement tous sous forme d'oxydes ou de sulfures dans la nature, il faut, pour les obtenir sous forme métallique, fournir l'énergie nécessaire à casser les liaisons chimiques correspondantes.
L'empreinte énergétique d'un métal est la quantité d'énergie nécessaire pour obtenir du métal pur. Dans ce qui suit, la quantité d'énergie est mesurée en tep (tonne équivalent pétrole), pour une tonne de métal pur.
Pour obtenir l'énergie « contenue » dans un métal « neuf », issu de la première transformation du minerai, il faut prendre en compte :
l'énergie d'extraction du minerai ;
l'énergie des traitements pré-métallurgiques (minéralurgie) ;
l'énergie de la métallurgie d'élaboration ;
l'énergie de la première transformation (fonte et affinage) ;
l'énergie du transport éventuel entre les différentes étapes.
-
Énergie des métaux donnée par différentes sources
(en tep - tonne équivalent pétrole - par tonne de métal brut)
| Métal |
Norgate & Rankine
(2002) |
J.C. Prevot (*)
(2005) |
ADEME (**)
(2006) |
BRGM
(2007) |
R.U. Ayres (*)
(2002) |
| Titane |
|
10,5-13,6 |
|
9,9 |
|
| Magnésium |
|
10,0-10,2 |
|
8,6 |
|
| Aluminium |
5,0 |
6,4-7,4 |
3,8 |
5,8 |
2,5 (***) |
| Étain |
|
|
|
4,6 |
|
| Nickel |
2,7-4,6 |
|
3,3 |
|
|
| Cuivre |
0,8-1,5 |
2,4-3,6 |
1,0 |
1,9 |
1,1-1,5 (***) |
| Zinc |
0,9-1,1 |
1,7-1,9 |
1,0 |
1,6 |
1,5 (***) |
| Acier |
0,5 |
0,8-1,4 |
0,4 |
0,8 |
|
| Plomb |
0,5-0,8 |
0,8-1,1 |
0,8 |
0,5 |
0,7 (***) |
|
(*) Source en MJ / kg et 1 MJ = 2,38.10 tep.
(**) Source en tec (tonne équivalent carbone) ; conversion utilisée : 1 tec = 1,3 tep (valeur moyenne européenne).
(***) Énergie injectée dans les procédés uniquement : hors énergie d'extraction, des intrants (acides, solvants, etc), de transport.
La consommation énergétique totale pour la production de métaux bruts est alors de 730 à 1 070 Mtep, soit 7 à 10 % de l'énergie primaire mondiale. L'acier et l'aluminium en représentent la plus grande part, soit respectivement 544-680 Mtep et 147-288 Mtep.
-
Impact du recyclage
Heureusement, les grands métaux étant globalement recyclables, l'énergie nécessaire au recyclage est bien moindre que l'énergie nécessaire à la fabrication du métal neuf. Par exemple, pour l'acier, l'énergie nécessaire au recyclage représente 25 à 40 % de l'énergie nécessaire à la production du métal primaire. Pour l'aluminium, dont la production à l'état primaire nécessite beaucoup d'énergie, ce pourcentage n'est que 4 à 5 %.
Astronomie
Planétologie
En planétologie, les métaux sont les matériaux les plus « lourds », comme le fer ou le nickel, qui composent le cœur des planètes rocheuses. C'est la catégorie des matériaux les plus lourds à côté des « gaz » (hydrogène, hélium), des « glaces » (composés contenant du carbone, de l'azote et/ou de l'oxygène, comme l'eau, le méthane et l'ammoniac) et des « roches » (silicates).
Cosmologie
En cosmologie, on appelle métaux tous les éléments autres que l'hydrogène et l'hélium. La teneur en ces « métaux » s'appelle en conséquence la métallicité, notée Z (X et Y représentant respectivement la proportion d'hydrogène et d'hélium).
Liste
Métaux alcalins
Césium (Cs)
Francium (Fr)
Lithium (Li)
Potassium (K, du latin kalium)
Rubidium (Rb)
Sodium (Na, du latin natrium)
Métaux alcalino-terreux
Baryum (Ba)
Béryllium (Be)
Calcium (Ca)
Magnésium (Mg)
Radium (Ra)
Strontium (Sr)
Métaux de transition
Argent (Ag, métal précieux noble)
Bohrium (Bh)
Cadmium (Cd)
Chrome (Cr)
Cobalt (Co)
Copernicium (Cn)
Cuivre (Cu)
Darmstadtium (Ds)
Dubnium (Db)
Fer (Fe)
Hafnium (Hf)
Hassium (Hs)
Iridium (Ir, métal noble)
Manganèse (Mn)
Meitnerium (Mt)
Mercure (Hg)
Molybdène (Mo)
Nickel (Ni)
Niobium (Nb)
Or (Au, (du latin Aurum) métal précieux noble)
Osmium (Os, métal noble)
Palladium (Pd, métal précieux noble)
Platine (Pt, métal précieux noble)
Rhénium (Re)
Rhodium (Rh, métal précieux noble)
Roentgenium (Rg)
Ruthénium (Ru, métal noble)
Rutherfordium (Rf)
Scandium (Sc)
Seaborgium (Sg)
Tantale (Ta, métal semi-noble)
Technétium (Tc)
Titane (Ti, métal semi-noble)
Tungstène (W)
Vanadium (V)
Yttrium (Y)
Zinc (Zn)
Zirconium (Zr, métal semi-noble)
Métaux pauvres
Aluminium (Al)
Bismuth (Bi)
Étain (Sn)
Gallium (Ga)
Indium (In)
Plomb (Pb)
Polonium (Po)
Thallium (Tl)
Alliages
À base de fer : acier fonte
acier
fonte
à base de cuivre laiton bronze billon maillechort
laiton
bronze
billon
maillechort
à base d'aluminium alliage d'aluminium pour corroyage alliage d'aluminium pour fonderie
alliage d'aluminium pour corroyage
alliage d'aluminium pour fonderie
à base de zinc : zamak
zamak
à base de nickel : superalliage
superalliage
Les métaux dans l'histoire
L'histoire des métaux remonte à l'antiquité. Seuls sept d'entre eux sont alors connus, soient: l'or, le cuivre, l'argent, le plomb, l’étain, le fer et le mercure. Aujourd'hui les métaux sont largement utilisés dans des domaines divers et variés tels que la production d'énergie, le transport, le bâtiment ou encore la médecine et la communication.

 词典释义:
词典释义:









 [一种银白色的锡合
[一种银白色的锡合 ]
] [一种铅锡合
[一种铅锡合 ]
] 铅(轴承)合
铅(轴承)合


 镜架
镜架
 货币
货币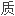 ;
;
 ;材料
;材料 银色
银色
 探测器
探测器






 氧化
氧化


 杆
杆
 膨胀
膨胀
 ;矿场)
;矿场)


 ;
; 制品,
制品, 器
器 ;青
;青 制品,青
制品,青 艺术品
艺术品
 的,
的,

 的;
的; ;
; ;
; ;
;








 , 黑色
, 黑色



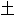








 , 锌白
, 锌白



 ; 母材; 基体
; 母材; 基体

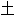








 银块
银块















 -绝缘体-半导体
-绝缘体-半导体 [
[ ]-氧[化物]-半导体
]-氧[化物]-半导体
 陶瓷阴极
陶瓷阴极
 陶[瓷]
陶[瓷]
 流动
流动






 钝化
钝化
 冷却
冷却
 冷却
冷却
 -氧化物-半导体晶体管
-氧化物-半导体晶体管

 直刻
直刻

