On peut définir la thermodynamique de deux façons simples : la science de la chaleur et des machines thermiques ou la science des grands systèmes en équilibre. La première définition est aussi la première dans l'histoire. La seconde est venue ensuite, grâce aux travaux pionniers de Ludwig Boltzmann.
Avec la physique statistique, dont elle est désormais une partie, la thermodynamique est l'une des grandes théories sur lesquelles se fonde la compréhension actuelle de la matière.
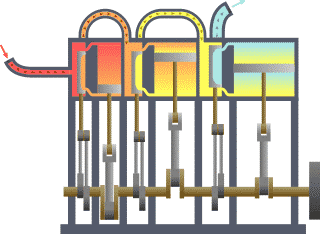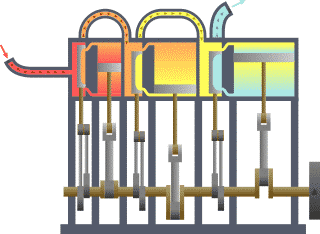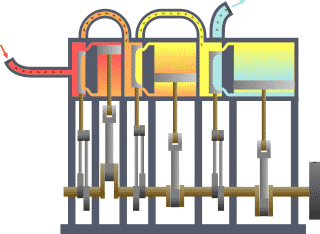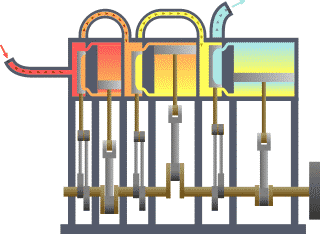
Système thermodynamique typique : la chaleur se déplace du chaud (évaporateur) vers le froid (condenseur) et le travail est extrait.
Étude des propriétés de la chaleur et des machines thermiques
Les notions de chaleur et de température sont les plus fondamentales de la thermodynamique. On peut définir la thermodynamique comme la science de tous les phénomènes qui dépendent de la température et de ses changements.
Chaleur et température
Chacun a une connaissance intuitive de la notion de température. Un corps est chaud ou froid, selon que sa température est plus ou moins élevée. Mais une définition précise est plus difficile. L’un des grands succès de la thermodynamique classique au XIX siècle, est d'avoir donné une définition de la température absolue d’un corps, qui a mené à la création de l'échelle kelvin. Celle-ci donne la température minimale pour tous les corps : zéro kelvin, soit -273,15 °C. Il s'agit du zéro absolu, dont le concept apparaît pour la première fois en 1702 avec le physicien français Guillaume Amontons.
La chaleur est plus difficile à définir. Une ancienne théorie, défendue notamment par Lavoisier, attribuait à un fluide spécial (invisible, impondérable ou presque) les propriétés de la chaleur, le calorique, qui circulerait d’un corps à un autre. Plus un corps est chaud, plus il contiendrait de calorique. Cette théorie est fausse au sens où le calorique ne peut pas être identifié à une quantité physique conservée. La thermodynamique définit la chaleur comme un transfert d'énergie désordonnée d'un système vers le milieu extérieur. En effet l'énergie thermique correspond à l'énergie cinétique de molécules se déplaçant et subissant des chocs de manière aléatoire (appelés mouvement brownien). L'énergie transférée est dite désordonnée au niveau microscopique, par opposition au transfert d'énergie ordonnée au niveau macroscopique réalisé par le biais d'un travail.
Machines thermiques
La thermodynamique classique a pris son essor comme science des machines thermiques ou science de la puissance motrice du feu.
Sadi Carnot a initié les études modernes des machines thermiques dans un mémoire fondateur, Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance (1824). Le cycle de Carnot, étudié dans ce mémoire, reste le principal exemple théorique d’étude des machines thermiques. Plutôt que « puissance motrice », on dit aujourd’hui que les machines thermiques fournissent un travail, et on s’interroge sur la façon d’utiliser la chaleur pour produire du travail continu.
La chaleur est produite par le mouvement des corps macroscopiques. Il suffit de frotter ses mains pour s’en rendre compte. Inversement, la chaleur peut mettre des corps macroscopiques en mouvement. On peut les appeler des machines à feu ou machines thermiques. Dans un système macroscopique, elles conservent leur mouvement tant qu’une différence de température entre une partie chaude et une partie froide est maintenue.
Exemples
Cette section présente quelques exemples où la puissance thermique joue un rôle.
Une bougie allumée met en mouvement l’air qui l’entoure. Un courant ascendant est créé au-dessus de la flamme. Il est perpétuellement renouvelé par un courant d’air froid arrivant par en dessous. On peut les observer dans une pièce calme avec une plume de duvet ou en approchant une autre flamme. Il s'agit d'un courant de convection.
L’eau dans une casserole sur le feu se met en mouvement comme l’air au-dessus de la bougie et comme tous les fluides au-dessus de surfaces suffisamment chaudes. Si on met un couvercle, un nouveau phénomène se produit. La vapeur soulève le couvercle, qui retombe ensuite pour être à nouveau soulevé, sans cesse jusqu’à épuisement du feu ou de l'eau, donc de la production de vapeur. On raconte que l’invention des machines à vapeur est liée à cette simple observation que l'on peut faire dans toutes les cuisines. Le mouvement du couvercle est trop petit pour être intéressant. Il s’arrête aussitôt commencé, car la vapeur qui le pousse s’échappe tout de suite. Mais si on remplace le couvercle par un piston dans un cylindre, on obtient un système avec piston qui peut être poussé par la vapeur ou tout autre gaz sur une longue course. Les machines à vapeur et les moteurs thermiques ne sont pas toujours construits sur le principe du piston et du cylindre. Les autres solutions ne sont pas très différentes. On peut considérer que l’expérience du couvercle de la casserole est à l’origine des inventions de tous les moteurs thermiques.
L'Éolipyle d'Héron d'Alexandrie
Avant les travaux de Sadi Carnot, les hommes connaissaient la turbine à vapeur. Elle se compose d'une boule de métal en rotation sur un axe. L’eau qu’elle contient est chauffée par en dessous. Deux jets de vapeur tangentiels et opposés mettent alors la boule en mouvement. Ce système n’a pas été amélioré avant les temps modernes. Les réacteurs des avions d’aujourd’hui (turbines à gaz) fonctionnent en grande partie sur le même principe que cet ancêtre de la turbine.
La puissance motrice du feu a été beaucoup plus développée pour faire des armes. La balle, l’obus, ou tout autre projectile, est poussé dans le canon par un gaz très chaud produit par la combustion de la poudre ou de tout autre explosif. Le canon forme un cylindre dans lequel circule un projectile qui joue le rôle du piston.
Les fluides de la surface terrestre, l’atmosphère et les océans, sont mis en mouvement par la chaleur du Soleil. Pour les océans, la gravitation joue aussi un rôle dans les marées. La puissance du vent est donc une forme de la puissance motrice du feu.
Science des grands systèmes en équilibre
Définir la thermodynamique comme la science de l’équilibre des grands systèmes est une approche à la fois très rigoureuse et très générale.
-
Équilibre statistique et loi des grands nombres
Si l’on jette un même dé, bien équilibré, un grand nombre de fois, on est sûr par avance que les fréquences d’apparition de chacune des faces seront proches d'un sixième. Plus le nombre de lancers est grand, plus les fréquences sont égales parce que le dé « explore » également toutes les possibilités qui lui sont offertes. La même chose se produit si on verse une goutte de colorant dans un verre d’eau. Si on attend assez longtemps, le verre est devenu uniformément coloré parce que toutes les molécules ajoutées « explorent » également toutes les possibilités, les régions à l’intérieur du verre, qui leur sont offertes.
Ces observations peuvent être généralisées. Lorsqu’un système est très grand, et lorsqu’il y a un sens à parler de l’équilibre du système, on peut prédire avec certitude la destinée de l’ensemble alors même que les destinées des nombreux individus sont imprévisibles.
-
Petitesse des atomes
On sait aujourd’hui que les atomes, très petits, existent. Dans chaque échantillon de matière, il y a un très grand nombre d’atomes, par exemple des milliards de milliards dans un minuscule grain de sable. La physique des corps macroscopiques est donc toujours une physique des grands systèmes.
-
Équilibres thermiques
L’étude des équilibres thermiques a une immense portée. Toutes les formes de la matière (gaz, liquides, solides, semi-fluides,...) et tous les phénomènes physiques (mécaniques, électriques et magnétiques, optiques,...) peuvent être étudiés en raisonnant sur l’équilibre des grands systèmes. La thermodynamique, que l’on identifie alors plutôt à la physique statistique, est une des bases les plus solides sur laquelle est édifiée notre compréhension de la matière.
Principes
Les deux principes les plus importants sont le premier et le second. On leur en ajoute parfois deux autres (principes zéro et troisième).
Le principe zéro de la thermodynamique concerne la notion d'équilibre thermique et est à la base de la thermométrie. Si deux systèmes sont en équilibre thermique avec un troisième, alors ils sont aussi ensemble en équilibre thermique.
Le premier principe de la thermodynamique ou principe de conservation de l'énergie affirme que l'énergie est toujours conservée. Autrement dit, l’énergie totale d’un système isolé reste constante. Les événements qui s’y produisent ne se traduisent que par des transformations de certaines formes d’énergie en d’autres formes d’énergie. L’énergie ne peut donc pas être produite ex nihilo ; elle est en quantité invariable dans la nature. Elle ne peut que se transmettre d’un système à un autre. On ne crée pas l’énergie, on la transforme. Ce principe est aussi une loi générale pour toutes les théories physiques (mécanique, électromagnétisme, physique nucléaire,...) On ne lui a jamais trouvé la moindre exception, bien qu'il y ait parfois eu des doutes, notamment à propos des désintégrations radioactives. On sait depuis le théorème de Noether que la conservation de l'énergie est étroitement reliée à une uniformité de structure de l'espace-temps. Elle rejoint un principe promu par Lavoisier : « Rien ne se perd, rien ne se crée, tout se transforme ».
Le deuxième principe de la thermodynamique ou principe d'évolution des systèmes affirme la dégradation de l'énergie : l'énergie d'un système passe nécessairement et spontanément de formes concentrées et potentielles à des formes diffuses et cinétiques (frottement, chaleur, etc.). Il introduit ainsi la notion d'irréversibilité d'une transformation et la notion d'entropie. Il affirme que l'entropie d'un système isolé augmente, ou reste constante. Ce principe est souvent interprété comme une « mesure du désordre » et comme l'impossibilité du passage du « désordre » à l'« ordre » sans intervention extérieure. Cette interprétation est fondée sur la théorie de l'information de Claude Shannon et la mesure de cette « information » ou entropie de Shannon. Ce principe a une origine statistique : à la différence du premier principe, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statistique. En revanche, il est assez indépendant des caractéristiques mêmes de ces lois, car il apparaît également si l'on suppose des lois simplistes à petite échelle.
Le troisième principe de la thermodynamique est plus controversé. Il est associé à la descente vers son état quantique fondamental d'un système dont la température s'approche d'une limite qui définit la notion de zéro absolu. Il n'est pas nécessaire en thermodynamique classique.
Grandeurs extensives et intensives
Parmi les grandeurs physiques qui déterminent l'état thermodynamique d'un système, on distingue les grandeurs extensives et intensives.
Un système peut toujours être divisé - par la pensée - en parties qui occupent des régions disjointes de l'espace.
Une grandeur est extensive lorsque sa valeur pour le système entier est la somme de ses valeurs pour chacune de ses parties. Exemples :
le volume
la masse
le nombre de particules d'une espèce déterminée
l'énergie et l'entropie - dans de nombreux cas
la charge électrique (il faut alors entendre somme au sens de somme algébrique)
Une grandeur est intensive lorsque dans un système homogène sa valeur est la même pour le système entier et pour chacune de ses parties. Exemples :
la pression
la température
la masse volumique, l'énergie par unité de volume, ou de masse dans de nombreux cas, et tout quotient de deux grandeurs extensives
Une grandeur peut n'être ni extensive ni intensive, le carré du volume par exemple. On définit ce genre de grandeur pour trouver des relations entre celle-ci qui auront des propriétés différentes selon qu'une grandeur soit extensive ou intensive d'où l'intérêt de les distinguer.
Les variables d'état sont des grandeurs (indépendantes) qui servent à définir le système et dont il suffit de fixer la valeur pour reconstituer un système exactement identique. Les grandeurs intensives sont indépendantes de la quantité de matière : pression, température, viscosité, etc. Les grandeurs extensives sont proportionnelles à la quantité de matière : volume, énergie interne, enthalpie, etc.

 词典释义:
词典释义:
 力学
力学
 力学的
力学的
 力学温度
力学温度 力学
力学 力学
力学 力平衡
力平衡 力当量
力当量 力[学]函数
力[学]函数 力学重[量]
力学重[量] 力势
力势 力势值
力势值 力效率
力效率 力面
力面