Le soufre est l'élément chimique de numéro atomique 16, de symbole S. C'est un membre du groupe des chalcogènes.
C'est un non-métal multivalent abondant, insipide, et insoluble dans l'eau. Le soufre est surtout connu sous la forme de cristaux jaunes et se trouve dans beaucoup de minéraux (sulfure et sulfate) et même sous forme native, particulièrement dans les régions volcaniques. L'essentiel du soufre exploité est cependant d'origine sédimentaire.
C'est un élément essentiel pour tous les êtres vivants ; il intervient dans la formule de deux acides aminés naturels, la cystéine et la méthionine et, par conséquent, dans de nombreuses protéines. Le soufre sert à 90 % à préparer l'acide sulfurique, produit de base de l'industrie chimique. Il est notamment employé comme engrais (sulfates) (60 % de la production) et phytosanitaire fongicide (contre l'oïdium de la vigne). Environ 34 % sert à des applications non agricoles comme la fabrication du caprolactame-monomère qui intervient dans la préparation du Nylon-6, dans les processus de lixiviation en exploitation minière, à l'élaboration du dioxyde de titane, des tripolyphosphates pour les détergents, à l'alimentation animale et humaine, à la fabrication de la pâte à papier, à la fabrication de l'acide fluorhydrique. Il est aussi utilisé pour fabriquer la poudre à canon, les laxatifs, était utilisé dans les allumettes, des insecticides, etc.
Caractéristiques notables
Généralités : le corps simple et l'élément chimique
Le corps simple soufre est un non-métal d'aspect jaune pâle. Il brûle avec une flamme bleue qui émet une odeur particulièrement suffocante (le dioxyde de soufre SO2). Il est insoluble dans l'eau et dans la plupart des solvants polaires, mais est soluble dans les solvants apolaires et fortement dans le (bi-)sulfure de carbone (CS2). Il se trouve natif dans la nature, éventuellement dans des gisements d'où il peut être extrait.
Le soufre dans la nature
Cristaux de soufre naturels
Cristal de soufre
Dépôt volcanique de soufre
L'élément chimique soufre existe combiné avec la totalité des autres éléments chimiques, hormis les gaz nobles. Les états d'oxydation les plus communs du soufre sont -2 (sulfures), 0 (corps simple), +4 (dioxyde et dérivés) et +6 (trioxyde et dérivés).
Sa combinaison la plus simple avec l'hydrogène est le sulfure d'hydrogène H2S, gaz toxique qui présente une odeur caractéristique d'œufs putréfiés.
Le soufre existe combiné avec l'oxygène dans plusieurs oxydes, dont le dioxyde de soufre SO2 et le trioxyde de soufre SO3, de nombreux oxoacides et dans les oxoanions correspondants.
Ses combinaisons avec le carbone se trouvent dans le pétrole, les gisements de gaz naturels et dans certains acides aminés.
Ses combinaisons avec les métaux sont essentiellement sous formes de sulfures et de sulfates.
Isotopes
Le soufre possède 25 isotopes et un isomère nucléaire connus, de nombre de masse allant de 26 à 49, dont quatre sont stables : S (95,02 %), S (0,75 %), S (4,21 %) et S (0,02 %), pour une masse atomique standard de 32,065(5) u. De ces isotopes, seul le noyau de S possède un spin nucléaire non nul, dont la valeur est 3/2. De la faible teneur en cet isotope et du fait que le spin ne soit pas 1/2, il résulte que la spectroscopie RMN du soufre est une technique peu développée.
Variétés allotropiques
Soufre S8
Le soufre possède des formes allotropiques aussi bien à l'état solide que liquide ou gazeux. La forme la plus stable à l'état solide, dans les conditions normales de température, est le soufre alpha Sα, de formule S8 et correspondant au cyclooctasoufre. Pour une écriture propre des équations chimiques impliquant le soufre, il est en conséquence d'usage d'introduire la notation /8 S8. L’existence de cette structure fut établie par rayons X en 1935 par B.E. Warren et J.T. Burwell. Elle avait été montrée par E. Beckmann par cryoscopie dans l'iode fondu.
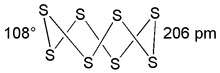
Le système de variétés allotropiques du soufre est parmi les plus complexes qui existent. La facilité de caténation du soufre n’est pas la seule raison et il faut compter également avec les variétés d’assemblage dans lesquelles chaque type de molécule peut cristalliser. Les liaisons S–S apparaissent d’une grande souplesse comme en témoigne l’amplitude des longueurs de liaison observées, entre 180 et 260 pm. De plus, des angles S–S–S existent entre 90° et 180°. Enfin, l’énergie des liaisons S–S, suivant les cas, est comprise entre 265 et 430 kJ·mol.
Il existe une grande variété de molécules de soufre. Fait unique, il semble que l’on puisse créer par synthèse n’importe quelle molécule de soufre de formule Sn. Par exemple, les molécules S18 et S20 ont été préparées et caractérisées en 1973 par M. Schmidt et A. Kotuglu. La stabilité des molécules Sn suit l'ordre suivant (sous forme liquide et solide): S8 > S12 > S18 > S20 > S9 > S6 > S10. La variété allotropique la plus stable, notée S8, est cristallisée dans le système orthorhombique. On la trouve dans la fleur de soufre obtenue par sublimation, dans le canon de soufre obtenu par fusion, ou dans le lait de soufre colloïdal. De plus, toutes les autres variétés semblent se transformer en Sα à température ambiante. La molécule cyclo-S8 est constituée d’une chaîne en zigzag avec quatre atomes dans un plan et quatre dans un autre plan parallèle (voir figure). Les angles sont de 108° et les longueurs de liaison de 206 pm. À 95,3 °C, un changement de phase intervient et les mêmes molécules S8 cristallisent alors dans un réseau monoclinique. La densité du soufre passe alors de 2,07 à 2,01.
Du soufre amorphe ou plastique de soufre peut être produit par refroidissement rapide du soufre fondu. Les études par rayons X prouvent que la forme amorphe est formée d'une structure hélicoïdale avec huit atomes de soufre par spire.
Du soufre peut être obtenu sous deux formes cristallines : des octaèdres orthorhombiques ou en prismes monocliniques ; la forme orthorhombique (de paramètres a = 1,046 nm, b = 1,2866 nm et c = 2,4486 nm) étant la plus stable aux températures ordinaires.
En phase vapeur, le soufre se trouve sous forme de molécules Sn (n = 2 – 10) en proportions dépendant de la température et de la pression. De 600 °C à 620 °C, la forme la plus stable est S8 et la vapeur est de couleur jaune. De 620 °C à 720 °C, la vapeur se compose d'un mélange de S6, S7, S8. Au-delà de 720 °C, la forme prédominante est S2, avec une double liaison, dans un état triplet de spin, analogue à O2. La vapeur est alors de couleur bleue.
Le comportement du soufre liquide est également particulier puisqu’une transition intervient à 159,4 °C. Toutes les propriétés du soufre présentent une discontinuité, certaines changeant spectaculairement d’un facteur 10 comme la viscosité (son maximum est atteint à 190 °C avant de rechuter avec la température). La raison en est la formation d’un polymère S∞ due à un phénomène de caténation.
Caténation du soufre
Le phénomène de caténation est la capacité d'un élément chimique à former de très longue chaîne par le biais de liaisons covalentes. L'élément le plus connu pouvant se caténer est le carbone, mais le soufre est un autre de ces éléments. En effet l'énergie de la liaison S-S est assez élevée (en moyenne 260 kJ.mol, mais pouvant atteindre 400 kJ.mol selon la forme du soufre), ce qui rend la suffisamment stable. À partir de 160 °C, des macromolécules de type Sn peuvent donc être obtenues par caténation (avec n pouvant atteindre le million). On parle alors de fibre de soufre formant des hélices dans une structure hexagonale. Cette forme de soufre est noté S∞ et a une couleur plutôt jaune foncé. Cette couleur peut varier avec la présence d'impuretés ou d'autres composés soufrés comme S3. Lors de la caténation du soufre, plusieurs conformations peuvent être adoptées selon l'orientation de la liaison S-S formée.
Les ions du soufre
On a observé depuis 1804 que le soufre se transforme dans les oléums en donnant des couleurs jaune, bleu ou rouge suivant les conditions. On sait maintenant qu’il s’agit d’une oxydation en différents cations Sn. Le sélénium et le tellure se comportent de la même façon. Cette réaction peut être réalisée plus proprement selon :
-
S8 + 2 AsF5 → (S8)(AsF6) + AsF3.
Le soufre donne également des anions : l’anion sulfure S, base conjuguée de H2S et les anions polysulfure Sn. Les anions disulfure S2 se trouvent à l’état naturel dans les pyrites FeS2. Ils correspondent à la forme basique de H–S–S–H, analogue du peroxyde d'hydrogène H2O2. Les autres ions polysulfure ne sont que des caténations plus longue de l’ion disulfure.
Composés du soufre
Les oxydes de soufre
Il existe plus de 30 oxydes de soufre (neutres) SnOm parmi lesquels deux ont une importance industrielle, le dioxyde de soufre SO2 et le trioxyde de soufre SO3. L’oxyde le plus simple, le monoxyde de soufre SO, homologue de O2 ou de S2, a été identifié par son spectre UV, mais il ne peut être isolé à cause de son instabilité ; sa longueur de liaison S–O est de 148 pm.
Le dioxyde de soufre
Le dioxyde de soufre est un gaz dans les conditions normales de température et de pression. Il s'obtient par combustion du soufre dans l'air. Ce gaz est très soluble dans l'eau (2 mol/L). Dans l'eau il donne l'acide sulfureux H2SO3 :
SO2 + H2O → H2SO3.
L'acide sulfureux est la forme acide de l'ion hydrogénosulfite HSO3 , lui-même forme acide de l'ion sulfite SO3.
Le dioxyde de soufre est un antioxydant et un acide utilisé pour stabiliser le vin. Les sulfites sont employés pour blanchir le papier et les fruits secs.
Acide sulfurique
Le soufre est industriellement transformé en acide sulfurique (H2SO4) en trois étapes. La première est une oxydation à l'air pour produire le dioxyde de soufre SO2. La deuxième est une oxydation ultérieure qui nécessite un catalyseur comme V2O5 et conduit au trioxyde de soufre SO3. La troisième est une étape d'hydratation conduisant à l'acide sulfurique H2SO4 :
S + O2 → SO2, SO2 + 1/2 O2 → SO3, SO3 + H2O → H2SO4.
Le trioxyde de soufre se dissolvant lentement dans l'eau, il est introduit dans l'acide sulfurique dilué. Cela conduit à de l'acide sulfurique concentré qui n'est autre qu'un mélange SO3 / H2O dans un rapport inférieur à 1, voire pur, rapport = 1, voire à un oléum, rapport SO3 / H2O supérieur à 1.
Les formes basiques de l'acide sulfurique sont l'ion hydrogénosulfate HSO4 et l'ion sulfate SO4.
Les sels d'Epsom, le sulfate de magnésium MgSO4, peuvent être employés comme laxatif, comme additif de bain, comme exfoliant ou comme source de magnésium pour la croissance des plantes.
L'acide sulfurique intervient dans la plupart des secteurs économiques d'un pays industrialisé.
Le sulfure d’hydrogène
Le sulfure d'hydrogène H2S est un gaz dont le nom officiel est sulfane (comme méthane). Il est produit dans la nature par l’activité volcanique et par les bactéries. Son odeur putride est détectable dès 0,02 ppm dans l’air et il provoque une anesthésie olfactive vers 150 ppm. À cette concentration, les effets sur la santé sont irréversibles en dix minutes. C’est une toxicité comparable à celle du cyanure d'hydrogène HCN.
Les polysulfanes H2Sn (n = 2 à 8) sont les formes acides des ions polysulfure Sn. Ils peuvent être préparés par chauffage du sulfure de sodium Na2S, 9H2O ou par réaction de SnCl2 avec H2S et purifiés par distillation. Ils se dismutent en H2S et S8 en milieu basique.
-
SnCl2 + 2 H2S → 2 HCl + H2Sn+2
L'ion thiosulfate
L'ion thiosulfate a pour formule S2O3. Il forme des cristaux verts déliquescents, décomposés par l'eau, solubles dans l'éthanol. On l'utilise comme réducteur dans la fabrication des colorants synthétiques. Son usage en chimie analytique est fréquent dans la réaction avec le diiode I2. Il se transforme en ion tétrathionate S4O6 suivant l'équation de base de l'iodométrie :
2 S2O3 + I2 → S4O6 + 2 I.
Le thiosulfate de sodium Na2S2O3 ou d'ammonium (NH4)2S2O3 était employé comme agent fixateur en photographie argentique. Après révélation de l'image latente, la photo était trempée dans une solution de thiosulfate de sodium qui dissout le bromure d'argent AgBr constituant la surface de la photo. Une fois dissous, le bromure d'argent ne pouvait plus noircir à la lumière, ce qui fixe la photo. Cette dissolution du bromure d'argent résulte de la complexation des ions argent Ag par les ions thiosulfate. Le complexe formé Ag(S2O8) est suffisamment stable pour déplacer l'équilibre de précipitation du bromure d'argent.
Nitrure de soufre
Le premier nitrure de soufre a été préparé en 1834 par W. Gregory. Sa stœchiométrie (un atome de soufre pour un atome d'azote) a été établie en 1851 et sa nature tétramérique (SN)4 l'a été en 1896. La structure du tétranitrure de tétrasoufre S4N4 est cyclique, avec une alternance de chaque élément, avec des angles NSN de 105°, des angles SNS de 113° et des liaisons de 162 pm. Il existe également un dinitrure de disoufre S2N2, de structure plane carrée, ainsi qu'un monosulfure de monoazote SN en phase gazeuse et dans le milieu interstellaire.
Les polythiazyles, de formule générique (SN)x, ont été découverts en 1975. Ils ont des propriétés métalliques bien qu'ils ne contiennent aucun atome de métal. Ainsi, leur conductivité augmente avec la température. Les polythiazyles sont notamment supraconducteurs à très basse température, en dessous de 0,26 K. Ces structures ont également des propriétés optiques remarquables.
Soufre comme ligand
S est un très bon ligand pontant et notamment S2. Les ligands dans lesquels S joue le rôle de donneur (de type R2S) sont de classe b (bases faibles de Lewis). S se distingue ici de O qui est un ligand de type a. S peut être vu comme un donneur de 2 e (dans S(AuPEt3)2 par exemple) formant 2 liaisons; on parle alors de ligand de type μ2. Il peut également être de type μ3 ou μ4 et donner respectivement 4 e (comme dans S(AuPPh3)3) et 6 e (comme dans SM4 avec un métal) formant respectivement 3 et 4 liaisons. Aucun complexe de soufre avec 6 ou 8 atomes métalliques n'est aujourd'hui connu. S2 forme avec des métaux de nombreux complexes: chaque S peut se lier à un atome M ou un atome M peut former une liaison avec chaque S (et former ainsi un pont). En moyenne dans ces complexes, la distance interatomique S-S est comprise entre 201 et 209 pm.
Oxohalogénures de soufre
On compte deux grandes familles d'oxohalogénures de soufre: les dihalogénures de thionyle (OSX2) et les dihalogénures de sulfuryle (O2SX2).
→ Dihalogénures de thionyle:
Ce sont des liquides très volatils ou des gaz. OSF2 et OSCl2 sont incolores tandis qu'OSBr2 est orange. La température de fusion des dihalogénures de thionyle diminue lorsque l'on descend la colonne des halogènes (110 °C pour OSF2 et 50 °C pour l'équivalent bromé). La distance interatomique O-S de ces composés est relativement constante alors que celle de S-X varie (158.5 pm pour OSF2 et 227 pm pour OSBr2) Le composé OSI2 est par contre très peu stable et se décompose au dessus de 30 °C en S et I2. Le plus important des halogénures de thionyle est le OSCl2. Il réagit très violemment avec l'eau et est principalement utilisé pour déshydrater certains composés inorganiques halogénés. Il est préparé selon les réactions suivantes:
SO2 + PCl5 → OSCl2 + OPCl3
SO3 + SCl2 → OSCl2 + SO2
→ Dihalogénures de sulfuryle:
Ce sont également des composés incolores très volatils ou gazeux. Ces composés sont tétrahédriques Le plus important est O2SCl2 et est très utile en chimie organique pour insérer un groupe Cl ou O2SCl à la place d'un OH par exemple. Il est formé à partir de SO2 catalysé par FeCl3.
Rôle biologique
Les acides aminés cystéine, méthionine, homocystéine et taurine contiennent du soufre, de même que quelques enzymes communes (par ex.: le coenzyme A) à toutes les cellules vivantes.
Les liaisons disulfure entre polypeptides jouent un rôle très important dans l'assemblage et la structure des protéines.
Quelques types de bactéries emploient le sulfure d'hydrogène (H2S) au lieu de l'eau comme donneur d'électron dans un processus semblable à une photosynthèse primitive.
Du soufre est absorbé du sol par les plantes sous forme d'ion sulfate.
Le soufre inorganique est présent dans les centres fer-soufre des métalloprotéines et le soufre est le ligand du site CuAi de l'oxydase du cytochrome c.
Histoire et utilisation

Soufre en attente de chargement, Freeport Sulphur Co., Hoskins Mound, Texas, États-Unis
Le soufre (çulbâri, signifiant ennemi du cuivre en sanskrit) ; sulphur, sulfur ou sulpur en latin) est connu depuis la haute Antiquité.
Vers 150 av. JC, Caton l'Ancien recommande le soufre contre la pyrale de la vigne avec une recette qui est l'une des premières recette d'insecticide connues en Occident. Homère le cite comme « éloignant la vermine ».
Au IX siècle av. J.-C. et en -424, une tribu détruisit les murs d'une ville en brûlant un mélange de charbon, de soufre et du goudron sous ses murs.
Dans le livre XXII de l’Odyssée, Ulysse revient chez lui, trouve les prétendants, les massacre puis pend douze jeunes filles qui avaient vécu avec eux. Il allume alors un grand feu où il brûle du soufre pour purifier sa maison.
« Nourrice, apporte-moi du feu, du soufre salutaire, Que je soufre la salle ; puis va dire à Pénélope De venir… »
Le soufre est mentionné dans la Bible à de nombreuses reprises :
Yahweh fit pleuvoir sur Sodome et sur Gomorrhe du soufre et du feu (Genèse, 19, 24) ;
en parlant du méchant :" du soufre sera répandu sur son lieu de résidence " (Job, 18, 15) ;
Le souffle de Yahvé comme un torrent de soufre va l'embraser (Isaïe, 30, 33) ;
etc.
Dioscoride le décrit comme un corps jaune facilement réduit en poudre, qui brûle avec une petite flamme bleue accompagnée d'une fumée irritante utilisée par les militaires pour faire fuir l'ennemi (ce qui en fait l'une des premières « armes chimiques »).
Aux environs du XI siècle, les Chinois inventèrent la poudre à canon en le mélangeant avec du salpêtre (nitrate de potassium, KNO3) et du charbon de bois. La première méthode de préparation semble dater de l'an 1044. En 1128 les militaires chinois aurait utilisé cette invention pour un bombardement. Quelques années après (1245), la poudre à canon est également découverte en Europe par Roger Bacon et Berthold Swartz.
Symboles alchimiques - en
n 4, le soufre
Alchimie : Les premiers alchimistes ont donné au soufre son propre symbole alchimique qui était un triangle au-dessus d'une croix (n 4 sur la figure). Par expérimentation, ils savaient que le mercure pouvait être combiné à lui. En 1777, Antoine Lavoisier proposa à la communauté scientifique de considérer que le soufre était un élément et non pas un composé. Cependant, en 1809, Humphry Davy continuait de penser le contraire, probablement à la suite d'expériences avec du soufre impur. Au même moment, Gay Lussac et Thenard confirmait la thèse de Lavoisier. Le « foie de soufre » utilisé pour solubiliser des métaux, dont l'or était la « combinaison de l'alkali fixe avec le soufre »
On l'utilise au XV siècle contre la peste noire (désinfection des locaux).
En 1781, l'élément chimique soufre fut détecté dans certaines plantes par N. Deyeux. En 1813, H.A. Vogel le détecte dans la bile et le sang d'animaux. Le soufre est effectivement présent dans deux des 20 amino-acides naturels. Puis ses propriétés fongicides sont signalées par William Forsyth en (1802) avant que les xanthates soient découverts (en 1822) par W.C. Zeise, qui prépare également le premier thiol, à l'époque appelé mercaptan, C2H5SH en 1831.
La même année, le procédé de contact pour la préparation de SO3, donc de l'acide sulfurique, est breveté, utilisant comme catalyseur l'oxyde de vanadium V2O5. Le cluster S4N4 est préparé pour la première fois par M. Gregory à partir de S2Cl2 et NH3.
En 1839, le procédé de vulcanisation du latex par le soufre est mis au point par Goodyear aux États-Unis.
En 1845 à partir de l'Angleterre, une maladie émergente, l’oïdium de la vigne colonise le vignoble français puis européen où les vendanges sont en 1852 5 fois inférieures à ce qu'elles étaient en 1847. Duchartre, Hardy et Grison montrent ou valident l'efficacité du soufre contre cette maladie. Gonthier invente un soufflet permettant de pulvériser de la fleur de soufre sur les feuilles de vignes mouillées puis en 1853 Rose Charmeux teste à Thomery le poudrage à sec qui se montre efficace. Il sera utilisé dans toute l'Europe permettant de redresser dès 1858 la production viticole. En 1880, on recommande 3 poudrages annuels, fastidieux et nécessitant 120 à 150 kg/ha/an de soufre trituré (ou 80 à 90 kg/ha/an de fleur de soufre). Cinq ans plus tard (1885), la bouillie bordelaise s'y ajoute pour traiter un nouvel envahisseur : le mildiou de la vigne.
Les isotopes 33 et 34 sont identifiés par spectrométrie de masse grâce à F. W. Aston en 1926. En 1920, ce dernier n'avait détecté que l'isotope le plus abondant S.
Depuis le XIX siècle, le blanchiment de la laine et de la soie, la chimie, la production d'acide sulfurique, de poudre à canon, d’allumettes, etc. ont généré une consommation croissante de soufre. À partir de la seconde moitié du XIX siècle, l'agriculture va également en absorber de grandes quantités, pour ses propriétés désinfectantes et fongicides (à la fin du XIX siècle, le vignoble en consomme à lui seul de 100 000 à 150 000 t/an) ou sous forme de sulfates (sulfate de potassium, d'ammonium et de magnésium) dans certains engrais. Il faut alors construire en urgence (à partir de 1856) des sublimeries et tritureries de soufre, usines où les incendies sont redoutés. On en trouvera des dizaines autour de villes comme Marseille, Montpellier, Frontignan, Sète, Narbonne, Bordeaux pour répondre aux besoins des vignerons. Cette industrie dope aussi le machinisme agricole, car l'application manuelle à grande échelle était source d'allergies et de brûlures des yeux pour les applicateurs.
Ces besoins ont été cause d'une demande croissante en soufre qui a nourri une industrie spécifique. Mais alors que les demandes industrielles et agricoles augmentaient, une très grande quantité de soufre était produite par la désacidification de certains gaz naturel (à Lacq en France par exemple) puis par la production de carburants désoufrés (imposés par un nombre croissant de législation visant à faire diminuer la pollution de l'air et les pluies acides.
Le soufre, en tant que produit naturel (Soufre trituré ventilé ou micronisé) est encore l'une des substances traditionnellement autorisées et utilisées en agriculture biologique et dans les jardins comme fongicide, acaricide et répulsif, bien que devant être utilisé modérément et prudemment sur certaines cultures ; Il est peu actif comme anticryptogame sous 18 °C, optimal à 23-25 °C, mais peut devenir phytotoxique au-delà de 35 °C selon la nature des formulations. De plus, il donne par exemple un goût soufré au vin ou au jus de raisin.
Après avoir épuisé les hydrocarbures facilement accessible, l'industrie d'extraction des ressources fossiles se tourne vers les hydrocarbures non conventionnels qui sont souvent encore plus riches en soufre (et en autres contaminants) que les hydrocarbures conventionnels. Dans le même temps, la réglementation évolue et devrait imposer à la marine marchande (actuellement responsable de 75 % des émissions d'oxyde de soufre (SOX) d'utiliser des carburants beaucoup moins soufrés. Le soufre ne semble donc pas faire partie des minéraux qui risquent de manquer.
Sources de soufre

Des dépôts de soufre.
Le soufre se trouve naturellement en grande quantité, composé à d'autres éléments sous forme de sulfures (par exemple : la pyrite, le cinabre, la galène, la sphalérite et la stibine) et de sulfates (par exemple : le gypse, la barytine, les vitriols). On le trouve sous forme libre au niveau des sources chaudes, les fumerolles et plus généralement dans les gaz volcaniques.
Cet élément se trouve aussi en petites quantités dans le charbon et le pétrole, qui produisent de l'anhydride sulfureux lorsqu'ils brûlent. Des normes sur les carburants exigent de plus en plus que le soufre soit extrait des combustibles fossiles, parce que l'anhydride sulfureux se combine avec l'eau présente dans l'atmosphère (gouttelettes de pluie) pour produire les pluies acides. Ce soufre extrait est alors raffiné et représente une grande partie de production de soufre.
Il est également extrait le long de la côte du golfe du Mexique, suivant le procédé Frasch : de l'eau liquide surchauffée à 160 °C est injectée dans le gisement de soufre, ce qui le fait fondre. De l'air comprimé est ensuite injecté dans le puits pour faire remonter le soufre fondu à la surface.
Pour les grandes quantités, le soufre est transporté par voie maritime sur des navires spécialisés appelés soufriers.

 词典释义:
词典释义:
 [第16号元素, 符号为S],
[第16号元素, 符号为S], 磺
磺 化染料
化染料 磺
磺 磺乳, 乳
磺乳, 乳
 磺色
磺色 作appos.]jaune soufre
作appos.]jaune soufre  ;
;  磺
磺



 ,
,  华
华

 ; 活
; 活





 磺石
磺石
 化氢
化氢
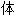
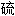 , 自由
, 自由
 斜
斜
 化锑
化锑

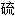 量
量

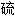 仪
仪 仪
仪
 菌
菌 化黑
化黑 原油
原油 棒
棒 含量测定
含量测定 原油, 酸
原油, 酸 原油
原油 磺华
磺华 [黄色]肝
[黄色]肝 值
值 化
化 黄乳, 乳[粒]
黄乳, 乳[粒]
 磺炉甘石洗剂
磺炉甘石洗剂 化反应
化反应 磺皂
磺皂
 含量
含量 量
量