Une base est un produit chimique qui, à l'inverse d'un acide, est capable de capturer un ou plusieurs protons ou, réciproquement, de fournir des électrons. Un milieu riche en bases est dit basique ou alcalin. Il existe différents modèles chimiques pour expliquer le comportement des bases. La réaction chimique d'un acide et d'une base donne un sel et de l'eau. C'est un produit caustique, qui peut provoquer des brûlures. Les bases les plus connues sont la chaux vive, l'ammoniaque et la soude.
Théorie successives
Premières théories
Le terme base a été introduit dans la chimie par le chimiste français Guillaume-François Rouelle en 1754. Il a remarqué que les acides connus à l'époque, qui étaient surtout des liquides volatils (tel que l'acide acétique), se transforment en sels solides lorsqu'ils sont combinés avec certaines substances particulières. Rouelle a considéré qu'une telle substance sert comme base du sel, en lui donnant une « forme concrète ou solide ». Auparavant, Robert Boyle (1627-1691) avait su différencier un acide d'une base en mettant à profit le changement de couleur du sirop de violette (passage du rouge au vert). Avant lui, seul le goût piquant des acides permettait de les reconnaître.
Les premières définitions modernes d'un acide et d'une base furent proposées par Svante August Arrhenius et Ostwald. Selon Arrhenius, un acide est un composé à hydrogène mobile qui relâche dans l'eau des protons H alors qu'une base est un composé qui relâche des ions hydroxyde OH dans l'eau. Cependant, plusieurs limites de ce modèle ont émergé assez rapidement. La principale limite est la restriction de la définition de la base et de l'acide au milieu aqueux. On a très vite observé des phénomènes acido-basiques dans des solvants non polaires, ce qui n'est pas décrit par ce modèle. On peut également observer une autoprotolyse d'autres solvants polaires :
autoprotolyse de l'ammoniac : 2 NH3 = NH4 + NH2
autolyse de anhydride acétique : (CH3CO)2O = CH3CO + CH3COO
Selon la théorie du système solvant, une base est une substance qui augmente la concentration des anions dans un milieu et un acide une substance qui augmente la concentration des cations dans un milieu. On peut remarquer ici que ce modèle ne fait pas intervenir la dualité constatée entre les bases et les acides qui sont une caractéristique intrinsèque au composé étudié. De plus, cette théorie ne se préoccupe pas du comportement des acides dans les solvants non polaires.
Ces deux derniers modèles, bien que partiellement valides, ont été remis en cause puis abandonnés en 1923, tout d'abord par le chimiste Joannes Brønsted puis par Gilbert Lewis, qui en a donné la définition la plus universelle.
Théories en vigueur
La théorie de Brønsted-Lowry a défini l'acide comme une substance capable de céder un proton dans le milieu et la base comme une substance capable de capter un proton. Brønsted a introduit ainsi la notion d'acidité et la basicité comme la proportion dans la solution d'acide par rapport à la base. Cette définition a mis fin à la plus grande partie des objections que l'on a fait aux deux théories précédemment développées. En effet, cette théorie est valide dans le cas des solvants non aqueux, ce qui a eu une grande importance pour l'analyse chimique. Cependant, à la même date, Gilbert Lewis a proposé une autre définition de l'acide et de la base mais celle-ci est passée inaperçue dans un premier temps.
Lewis définit une base comme un donneur de doublets d'électrons et l'acide (ou adduit de Lewis) comme accepteur de doublets d'électrons. Les acides sont ainsi des substances qui, combinées avec des bases, partagent des électrons afin de former des composés de coordination. La théorie de Brønsted-Lowry est en fait un cas particulier de la théorie de Lewis qui a une valeur théorique beaucoup plus élevée. Cependant dans l'industrie, le modèle de Brønsted est largement utilisé, on continue de raisonner en termes d'échange de protons. Dans le milieu scolaire, on définit d'ailleurs toujours au moins dans un premier temps un acide et une base selon le modèle de Brønsted.
Dans l'eau
En milieu aqueux, on utilise habituellement la définition de Brønsted-Lowry. Une base peut être représentée par la formule générique B.
Lorsque la base B est mise en présence d'eau, la réaction suivante a lieu :
- B + H2O ↔ BH + OH (1)
La constante de cette réaction est appelée constante de basicité et on la note Kb. On établit une distinction entre les bases faibles et les bases fortes. Une base forte est totalement dissociée dans l'eau, alors qu'une base faible n'est que partiellement dissociée dans l'eau.
BH est capable de céder un proton. On a en fait un couple base faible/acide faible conjugué B/BH. En conséquence, la constante d'acidité Ka est uniquement définie dans le cas des bases faibles et vaut alors :
- Ka = [B][H3O]/[BH] (4)
Ka est en fait la constante d'équilibre de la réaction de dissociation (3).
Parmi les plus fortes bases, on retrouve la soude NaOH, et la chaux (chaux vive CaO ou chaux éteinte Ca(OH)2).
Dans l'eau, la basicité est mesurée à l'aide de l'échelle des pH, comme l'acidité (les deux notions étant complémentaires). L'eau elle-même est un acide faible et une base faible en même temps.
En géologie, en chimie verrière ou chimie des sels fondus
En pétrologie et en chimie des sels fondus, on utilise de préférence la définition de Lux-Flood : une base est une espèce pouvant céder un ion oxyde O . Par exemple, l'oxyde de calcium CaO est une base, car dans la réaction :
- CaO + H2O → Ca(OH)2
le CaO cède son ion oxyde
- CaO → Ca + O
qui lui est capturé par l'eau O + H2O → 2OH.
Géologues et géochimistes, voire physico-chimistes de la matière condensée, décrivent plus communément l'évolution des formations et (micro)structures minérales en termes de potentiel oxygène.
D'une manière synthétique, on dit qu'une roche est basique si, par sa teneur globale ou composition brute, elle est pauvre en silice SiO2 : le minéral silice SiO2 est susceptible d'engendrer l'ion silicate tétraédrique SiO4, la silice est acide. Les basaltes, ne recelant environ que 30 % de silice, et d'une manière générale les roches basaltiques, sont basiques.
Cela a une grande importance dans le comportement des magmas (notamment dans les volcans), et aussi lorsqu'il faut dissoudre la roche pour l'analyser (dissolution dans de l'acide pour l'ICP, ou bien dans un verre pour l'analyse en spectrométrie de fluorescence X).
Les roches calcaires, c'est-à-dire la gamme très variée de roches à base de différents minéraux du type carbonates de calcium et/ou de magnésium, sont basiques parce qu'elles réagissent aux acides d'un point de vue trivial. Par exemple, la craie arrosée d'acide acétique ou de vinaigre fort fait effervescence. Sa structure ionique se décompose, en libérant les ions calcium Ca et surtout le gaz carbonique CO2, ce dernier à l'origine du bullage plus ou moins intense, cause de l'effervescence.
Propriétés
Les bases ont tendance à donner des électrons, ce qui est caractérisé par leur potentiel d'oxydoréduction. L'équilibre avec la forme acide est caractérisé au moyen d'une constante (Kb ou pKb), pH auquel la molécule est neutre. Un composé basique peut avoir plusieurs pKb, correspondants à chacun de ses groupes ionisables.
L'alcalinité (parfois aussi appelé basicité) d'une solution correspond à la concentration en composés basiques, exprimée en potentiel d'oxydoréduction (voir Potentiel hydrogène). C'est l'inverse de l'acidité.
Les bases produisent des réactions d'oxydoréduction, des réactions de substitution nucléophile…
在香港和台湾,盐基或碱基,有时也称做碱(尽管「碱」具有多种意义)。这是根据布朗斯特-劳里学说关于酸和盐基的部份,盐基可以简单想像成吸收质子的物质。额外的定义包括提供孤立电子对(由刘易斯提出),以及是氢氧根离子的来源(由阿伦尼乌斯提出)。
盐基也可想像为与酸化学相对。酸和盐基的反应称为中和作用。盐基可想像为与酸化学相对是因为酸增加了水合氢离子(H3O)在水中的浓度,反之盐基降低这种浓度。盐基与酸反应生成水和盐。盐基的一般性质包括:
味道:苦味(相对于酸的酸味以及醛和酮的甜味)
触感:具黏滑和像肥皂的感觉
活泼性:对有机物呈苛性,与酸性或可还原的物质剧烈反应
导电性:水溶液以及熔融盐基电离而导电
将红色石蕊试纸变为蓝色
盐基的定义
法国化学家侯艾尔于1754年制定了盐基这一概念。他注意到当时的酸大多是挥发性液体(例如乙酸),与特定物质化合便会转变为固态盐。这些特定物质便是盐的「根基」并因此得名。碱(Alkali)是盐基的一个特殊例子,会在水溶液中发布氢氧根离子。阿累尼乌斯盐基是指水溶而水溶液pH值经常大于7的盐基。还有其他更广义和深层的酸碱定义。 阿瑞尼士盐基(Arrhenius base) 氢氧根离子的来源: NaOH → Na + OH 布忍斯特盐基(Brönsted base) 吸收质子的物质,下式中B为盐基: B + H → BH B + H → BH 路易士盐基(Lewis base) 孤立电子对的提供者,下式中B为盐基:
盐基和pH值
量度(不纯的)水的pH值,便是测试它的酸性。纯水中,大约每千万个水分子便有一个根据以下方程序电离为水合氢离子和氢氧根离子: 2H2O(l) → H3O(aq) + OH(aq) 浓度即是以摩尔浓度计算(M或摩尔每立方分米(mol/ dm))水合氢离子和氢氧根离子的浓度;是为水的离解常数,数值为10 M。pH值定义为−log [H3O];因此,纯水的pH值是7。(这些数据均取于23 °C,并于不同温度时有所差别。) 盐基接收(或去除)溶液中的水合氢离子,或释放氢氧根离子到溶液中。两者均降低了水合氢离子在水中的浓度,从而提升pH值。相反,酸释放水合氢离子或接收氢氧根离子而降低pH值。 例如,1莫耳的氢氧化钠(40 克)溶于1公升的水中,氢氧根离子的浓度便是1摩尔每公升。所以氢离子浓度为每公升[H] = 10 莫耳,而pH值 = −log 10 = 14. 碱度系数(pKb)是碱性的测量,并和酸度系数(pKa)有以下关系pKa + pKb = 14. 碱浓度是量度溶液相对碳酸盐或碳酸氢盐中和酸的能力。
与酸的中和作用
当盐基溶解于水中,氢氧化钠离解为氢氧根离子和钠离子: NaOH → Na + OH 同样地,氯化氢于水中生成水合氢离子和氯离子: HCl + H2O → H3O + Cl 当两种溶液混合,水合氢离子(H3O)和氢氧根离子(OH)化合生成水分子: H3O + OH → 2 H2O 如果以相同份量的氢氧化钠溶液和氢氯酸混合,盐基和酸会恰好完全中和,于溶液中生成氯化钠,即食盐。 弱盐基,如苏打和蛋白,用于酸泄漏事件中的中和剂。以强盐基如氢氧化钠或氢氧化钾中和会引起剧烈的放热反应,同时盐基也制造了和酸泄漏同等的破坏。
非金属氧化物的碱性
碳酸钠和氨亦是盐基,但它们都没有氢氧根离子(OH)。这是因为两种都在溶解时接收氢离子(H): Na2CO3 + H2O → 2 Na + HCO3 + OH NH3 + H2O → NH4 + OH
盐基的强弱
氢氧化钾(KOH)
氢氧化钡(Ba(OH)2)
氢氧化铯(CsOH)
氢氧化钠(NaOH)
氢氧化锶(Sr(OH)2)
氢氧化钙(Ca(OH)2)
氢氧化锂(LiOH)
氢氧化铷(RbOH)}}
正丁基锂(n-BuLi)
二异丙基氨基锂(LDA)(C6H14LiN)
氨基钠(NaNH2)
氢化钠(NaH)
盐基作为异构催化剂
碱性物质可用作化学反应的异构不可溶催化剂。例如氧化镁,氧化钙以及氧化钡等金属氧化物以及氧化铝上的氟化钾和某几种沸石。大量过渡金属制造良好催化剂,其中不少是碱性的。碱性催化剂可用于氢化,双键的移动,米尔温–庞多夫–韦尔莱还原反应,Michael反应,以及许多反应。
盐基和碱的混淆
所有可溶的盐基,这应称作阿累尼乌斯碱。
盐基的水溶液 。
不可溶于水的例子
氧化铜等大部份金属氧化物
可溶于水的例子
氨
所有碱

 词典释义:
词典释义:
 ; (
; ( ph
ph 高于7的)媒介物的
高于7的)媒介物的

 词:
词: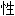 ;
;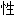 ,粘度;
,粘度;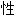 ,挥发度;
,挥发度;