Fibres de collagène de type I provenant d'un tissu pulmonaire de mammifère, observées au microscope électronique.
Le collagène est une famille de protéines, le plus souvent présente sous forme fibrillaire. Elle est présente dans la matrice extracellulaire des organismes animaux. Ces protéines ont pour fonction de conférer aux tissus une résistance mécanique à l'étirement.
Il s'agit de la protéine la plus abondante dans un organisme humain (également la protéine la plus abondante du règne animal), représentant le quart de la masse protéique . Il est sécrété par les cellules des tissus conjonctifs et a une masse moléculaire de 300 kDa.
Contrairement à l’élastine présente aussi dans les tissus conjonctifs, le collagène est inextensible et résiste bien à la traction. Il existe différents types de collagène selon l'organe considéré. Il est notamment indispensable aux processus de cicatrisation.
D'un point de vue industriel et économique, il faut noter que le collagène constitue la matière première permettant la production de gélatine.
Une protéine structurale
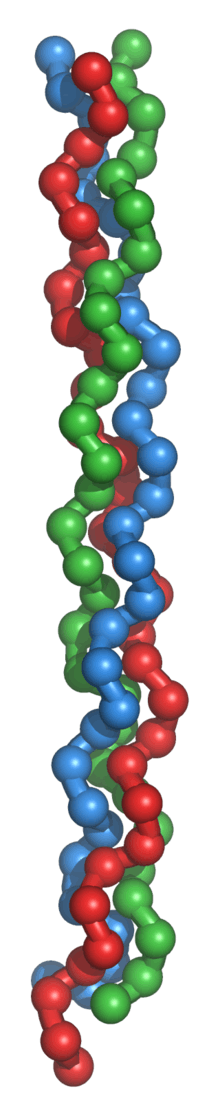
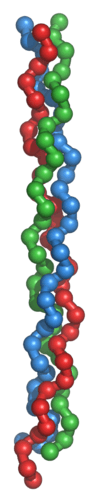
La triple hélice de tropocollagène
Les biochimistes connaissent aujourd’hui plus de 100 000 protéines. Ces molécules interviennent dans de nombreux processus. Certaines sont au cœur de l’immunologie. D’autres ont une activité enzymatique indispensable au bon fonctionnement de la machinerie cellulaire. D’autres encore forment les récepteurs membranaires par lesquels les cellules interagissent avec le milieu environnant. Quelques-unes, enfin, participent à la structuration des organismes. C’est le cas du collagène, une protéine essentielle des tissus conjonctifs des animaux.
Une molécule très abondante
Les protéines se séparent en deux catégories. Les protéines fonctionnelles interviennent dans des processus biochimiques (enzymologie, immunologie, récepteurs membranaires, etc.). Les protéines structurales façonnent les organismes en contribuant à leur structure. Parmi celles-ci, le collagène est particulièrement représentatif. Cette protéine fibreuse est de loin la plus abondante chez tous les Mammifères : elle représente un quart de leurs protéines, soit environ 5 % de leur masse.
Différents types de collagène
Le collagène est une protéine composée de trois chaînes alpha polypeptidiques associées. Ces chaînes sont reliées par des liaisons hydrogène entre l'hydroxylysine et l'hydroxyproline et des liaisons covalentes. Une chaîne alpha est constituée de 1055 acides aminés. Pouvant se combiner de différentes manières, on devrait en toute rigueur parler des collagènes, et non du collagène. Chaque type de collagène possède une structure propre et se retrouve dans des organes particuliers. Par exemple, le collagène de type I intervient dans la formation de la peau, des tendons, des os et de la cornée, tandis que le type III se retrouve au niveau du système cardiovasculaire.
Type Description Gène (s) Troubles I 90 % du collagène d’un vertébré. Il constitue la trame de l’os (à comparer aux armatures du béton armé), et plus généralement des tissus conjonctifs banals. Il se trouve dans les os, la peau, les tendons, la cornée et les organes internes. COL1A1, COL1A2 Ostéogenèse imparfaite, syndrome d'Ehlers-Danlos II Forme de fines fibrilles dans la substance fondamentale du cartilage hyalin (avec les collagènes IX, X et XI) dans le nucléus pulposus du disque intervertébral et dans le corps vitré de l’œil. COL2A1 - III Il est constitutif des fibres de réticuline trouvées en proportion importante dans les tissus hématopoïétiques. À l’état de collagène, il se trouve en particulier dans le muscle squelettique et dans la paroi des vaisseaux sanguins. Les fibres sont argyrophiles et PAS positives COL3A1 Syndrome d'Ehlers-Danlos, maladie de Dupuytren IV Spécifique des lames basales, il constitue un réseau. Il n'est pas strié en microscopie électronique COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 néphropathies par anomalie du collagène IV, syndrome de Goodpasture V Localisé dans les tissus conjonctifs, il s’associe au type I COL5A1, COL5A2, COL5A3 Syndrome d'Ehlers-Danlos VI Localisé dans les tissus conjonctifs, il s’associe au type I COL6A1, COL6A2, COL6A3 Myopathie de Bethlem, dermatite atopique VII Constituant de la lame basale. Il forme des fibrilles permettant l’accrochage de la lame basale au tissu conjonctif sous-jacent. COL7A1 Epidermolyse bulleuse dystrophique VIII Localisé dans les cellules endothéliales. COL8A1, COL8A2 Dystrophie cornéenne postérieure polymorphe IX Localisé dans le cartilage, s’associe au collagène de type II COL9A1, COL9A2, COL9A3 Dysplasies polyépiphysaires X Localisé dans le cartilage hypertrophié et minéralisé. COL10A1 - XI Localisé dans le cartilage. COL11A1, COL11A2 - XII Interagit avec les types I et III. COL12A1 - XIII - COL13A1 - XIV - COL14A1 - XV Disséminés; près de la lame basale des muscles. COL15A1 - XVI - COL16A1 - XVII Également appelé BPAG2, c’est une protéine transmembranaire qui se fixe à la lame basale d’hémidesmosomes, au niveau de l’épiderme notamment. Les fibres de collagène de type XVII sont disposées parallèlement aux intégrines α6β4. Ces deux protéines permettent donc de renforcer l’ancrage de la lame basale. COL17A1 Pemphigoïde bulleuse XVIII - Collagène de « jonction d'ancrage ». C'est l'un des collagènes retrouvés au niveau de la couche fibrillaire des membranes basales. Précurseur de l Endostatin, en lorsqu'on clive la partie C-Terminal COL18A1 - XIX - COL19A1 - XX - COL20A1 - XXI - COL21A1 - XXII - COL22A1 - XXIII - COL23A1 - XXIV - COL24A1 - XXV - COL25A1 - XXVII - COL27A1 - XXVIII Ressemble étroitement au type VI. COL28A1 -
Une colle naturelle
Lorsque le collagène est partiellement hydrolysé, les trois brins de tropocollagène se dissocient. Ils forment ainsi la gélatine, un produit largement utilisé dans l’agroalimentaire. La gélatine a aussi été utilisée dans l’industrie pharmaceutique, en cosmétique et en photographie. Le collagène et la gélatine sont considérés comme des protéines de piètre qualité nutritionnelle car ils ne possèdent pas tous les acides aminés en proportions adéquates.
Le terme collagène signifie « producteur de colle » (le nom vient du mot grec kolla signifiant « colle »). Les propriétés du collagène ont été utilisées par les Égyptiens 2 000 ans av. J.-C.. Les Amérindiens l’utilisaient au V siècle. La plus ancienne colle connue est faite à partir de collagène, et date de 6 000 ans av. J.-C. Au début du XXI siècle, il est utilisé dans les produits de beautés ou comme additif dans certains aliments.
Le tropocollagène
Le tropocollagène est l'unité fondamentale du collagène, et correspond à une molécule asymétrique de 280nm de long et de 1,5 nm de diamètre. Il s'agit d'une glycoprotéine formée par l'enroulement de 3 hélices gauches α, porteuses de glucide (glucose, galactose), superenroulées en hélice droite. Les acides aminés sont constitués pour un tiers de glycine, pour un quart de proline, d'hydroxylysine et de 4-hydroxyproline. Il existe plusieurs types moléculaires de chaînes α. Ces chaînes sont constituées par des séquences répétitives de trois acides aminés, dont le premier, la glycine est répétée tout au long de la molécule. Les glucides sont fixés sur l'hydroxylysine. L'enroulement des 3 chaînes α aboutit à la constitution de la molécule de tropocollagène, dont la cohésion est assurée par des liaisons hydrogène entre la glycine et l'hydroxyproline.
Des acides aminés particuliers
.jpg)
Un acide aminé fréquent dans le collagène, la 4-hydroxyproline
.jpg)
Un acide aminé fréquent dans le collagène, la 5-hydroxylysine
L’analyse de la composition d’une molécule de tropocollagène révèle de nombreuses singularités. Les biochimistes ont montré que le tiers des résidus sont des résidus de glycine, ce qui est caractéristique des protéines de structure. Autre fait singulier, plus de 10 % des résidus sont des prolines. Enfin, on observe la présence de deux acides aminés peu courants, la 4-hydroxyproline (Hyp) et la 5-hydroxylysine (Hyl).
Une séquence particulière
Les biochimistes ont également constaté que l’ordre d’enchaînement des acides aminés qui composent le tropocollagène présente aussi des anomalies. En d’autres termes, la séquence d’acides aminés ne correspond pas à ce que l’on rencontre habituellement. On observe en effet que les glycines se retrouvent régulièrement tous les trois résidus. La structure de la séquence des acides aminés du collagène est donc (Gly – Xn – Yn)n. De plus, la séquence comporte assez souvent des triplets Gly – Pro – Hyp. Toutes ces propriétés sont singulières dans la mesure où elles ne se retrouvent pas chez la plupart des protéines.
Hydroxylation et glycosylation
Hydroxylation
Les deux acides aminés hydroxylés que sont l’hydroxyproline (Hyp) et l’hydroxylysine (Hyl) soulèvent tout naturellement une question : l’hydroxylation intervient-elle avant ou après la synthèse peptidique ? Pour y répondre, les biochimistes ont recherché un aminoacyl-ARNt codant l’un ou l’autre de ces acides aminés. N’en ayant pas trouvé, ils ont conclu que l’hydroxylation de certains résidus de proline et de lysine est un processus post-traductionnel. En fait, deux enzymes catalysent cette réaction. Ce sont respectivement la prolylhydroxylase et la lysylhydroxylase. Toutes deux ne peuvent agir qu’en présence d’ascorbate (ou vitamine C), celui-ci empêchant le fer ferreux (Fe) contenu dans leur centre actif d’être inactivé sous forme de fer ferrique (Fe). Une carence sévère en ascorbate est à l’origine du scorbut, une maladie due à un défaut de fabrication du collagène, lequel se traduit par une fragilisation des tissus. Les marins, lors des grands voyages, étaient souvent victimes du scorbut, faute de pouvoir consommer des fruits et des légumes.
Les résidus de proline susceptibles d’être hydroxylés sont nécessairement situés à gauche d’un résidu de glycine. Les autres résidus ne peuvent être hydroxylés. Il en va de même pour les résidus de lysine.
(extrémité aminoterminale) NH – … – Pro – Gly – … – COO (extrémité carboxyterminale)
(extrémité aminoterminale) NH – … – Lys – Gly – … – COO (extrémité carboxyterminale)
Très rarement, certains résidus de proline sont hydroxylés au niveau du carbone 3 et non du carbone 4. L’enzyme responsable de cette hydroxylation n’est pas la prolylhydroxylase, et l’hydroxylation ne respecte pas les règles que nous venons de définir.
Glycosylation
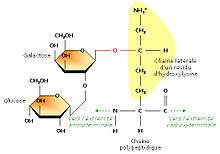
Ajout de sucres sur certains résidus
En étudiant la structure du tropocollagène, les biochimistes ont également montré que certains résidus d’hydroxylysine possédaient des résidus sucrés (2-glucosyl-galactose). Le fait que le collagène soit lié de façon covalente à de courts glucides en fait une glycoprotéine (par opposition aux protéoglycanes, glucides liés à de petits peptides).La formation d’une liaison covalente entre le galactose et le groupement hydroxyle d’un résidu hydroxylysine est catalysée par la galactosyl transférase ; celle du glucose fait appel à la glucosyl transférase.
Structure secondaire
Un cylindre hélicoïdal
La conformation spatiale du tropocollagène est celle d’un cylindre hélicoïdal à trois bandes de 300 nm de long et de 1,5 nm de diamètre. Cette protéine ne présente donc pas la forme globulaire classique des protéines fonctionnelles. C’est une tige longue et fine. Chaque bande du cylindre est une chaîne polypeptidique elle-même repliée en hélice ; l’ensemble des trois chaînes forme une tresse particulièrement résistante. En effet, il faut une charge de 10 kg pour casser une fibre de collagène d’un diamètre d’un millimètre.
Structure en hélice gauche
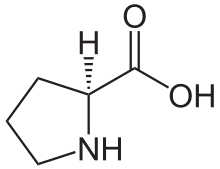
Proline
Nous avons dit que chaque chaîne polypeptidique est repliée en hélice. Cette structure secondaire est sans rapport avec l’hélice alpha. Il s’agit d’un autre type de structure secondaire. Il s’agit ici d’une hélice gauche dont l’enroulement résulte de la répulsion des cycles pyrrolidines des nombreux résidus de proline. Les cycles pyrrolidines se repoussent mutuellement en raison de leur fort encombrement stérique. L’hélice obtenue est moins compacte que l’hélice alpha (0,15 nm par résidu) puisque l’on a pu mesurer une distance de 0,29 nm par résidu. Enfin, contrairement aux hélices alpha, on n’observe pas de ponts hydrogène intracaténaires. On trouve néanmoins des ponts hydrogène intercaténaires. Les ponts hydrogène mettent en jeu les résidus de glycine (donneurs de protons) et les groupements carboxyle (accepteurs de protons). Lorsque les chaînes se croisent, il est nécessaire de réduire l’encombrement stérique. Ceci est rendu possible par la présence de résidus de glycine, l’acide aminé le moins encombré. Les autres chaînes latérales sont rejetées à l’extérieur de la structure en triple hélice.
Des interactions coopératives
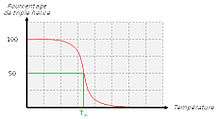
Pourcentage de triple hélice en fonction de la température.
Lorsque l’on chauffe une solution de tropocollagène, on observe un effondrement brusque de la structure en hélice à une température donnée, notée Tm (température de fusion ou melting temperature dans la terminologie anglo-saxonne). Cette expérience montre que les ponts hydrogène assurent le maintien de la structure en triple hélice. Ces interactions faibles (c’est-à-dire non covalentes) sont suffisamment nombreuses pour modifier sensiblement le comportement de la molécule. On ne doit pas s’en étonner : la fibroïne, protéine structurale de la soie fabriquée par les araignées, doit son élasticité et sa résistance à l’existence de très nombreux ponts hydrogène qui constituent des interactions coopératives. De la même façon, les propriétés singulières de l’eau, en particulier son point d’ébullition « anormalement » élevé, sont la conséquence directe de l’existence de nombreux ponts hydrogène. La mesure de la température de fusion Tm est rendue possible par le fait qu’elle marque un changement de viscosité de la solution et une modification de la dispersion optique rotatoire (DOR).
Importance des hydroxylations
Les hydroxylations observées sur le collagène offrent un gain de stabilité. Leur nombre varie donc en fonction du type de tissu et de la température corporelle. Certains tissus présentent un plus fort taux d’hydroxylation que d’autres. C’est notamment le cas du placenta et de la peau.
|
Pro et Hyp (‰) |
Température de fusion (°C) |
Température corporelle (°C) |
| Peau de veau |
232 |
39 |
37 |
| Peau de requin |
191 |
29 |
24 à 28 |
| Cabillau |
155 |
16 |
10 à 14 |
Biosynthèse des collagènes
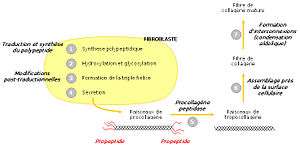
Différentes étapes de synthèse du collagène
.jpg)
Différentes étapes de synthèse du collagène
Le procollagène
Le collagène n’a pas sa place dans les cellules elles-mêmes ; c’est pourquoi sa synthèse s’effectue à partir d’un précurseur présent dans les cellules, le procollagène. Celui-ci est constitué de brins beaucoup plus longs, rallongés par des structures polypeptidiques supplémentaires, de 15 kDa du côté aminoterminal et de 30 kDa du côté carboxyterminal. Ces structures sont banales et portent le nom de propeptides. À l’extrémité carboxy-terminale existent des ponts disulfure intercaténaires à rôle stabilisateur. Les ponts sont intracaténaires à l’extrémité aminoterminale.
Le tropocollagène
Le tropocollagène est un assemblage de 3 protéines de collagène alpha (alpha1 - alpha1 - alpha2 ) en une hélice droite. Les fibres de tropocollagène s'assemblent en une structure appelée fibrille de collagène. L'assemblage de plusieurs fibrilles de collagène forme la fibre de collagène. Les fibrilles présentent une alternance de phase sombre et claire due a l'espacement et au décalage des fibres de procollagène.
Dans le réticulum endoplasmique
Les trois chaînes de procollagène sont synthétisées transférées dans le lumen du réticulum endoplasmique (on parle de translocation). La région contenant la triple hélice est flanquée d’un peptide signal et de deux propeptides aminoterminal et carboxyterminal. Ceux-ci aident à la maturation de la protéine.
Modifications post-traductionnelles
Une fois dans le réticulum endoplasmique, le peptide signal est clivé. Ensuite intervient l’hydroxylation de plusieurs prolines et lysines. Le propeptide carboxyterminal est modifié par N-glycosylation, tandis que certaines hydroxylysines sont O-glycosylées. Les différentes modifications post-traductionnelles et la formation de ponts disulfure entre les propeptides carboxyterminaux de trois chaînes permettent ensuite leur alignement. La triple hélice s’enroule alors comme une fermeture éclair, en direction de l’extrémité aminoterminale.
Dans l’appareil de Golgi
Enfin, dans l’appareil de Golgi, la triple hélice est flanquée de régions non hélicales. Le procollagène est alors libéré dans le milieu extracellulaire par exocytose. Une enzyme, la procollagène peptidase, clive alors les deux propeptides, permettant la formation de tropocollagène mature. En tout dernier lieu, les faisceaux de tropocollagène s’assemblent à proximité de la surface cellulaire, s’interconnectent et forment des fibres de collagène matures.
Formation des fibres de collagène
Pour former des fibres de collagène matures, les faisceaux de tropocollagène doivent s’assembler. Divers processus biochimiques y conduisent. Par exemple, une enzyme, la lysyl oxydase, permet la substitution d’un groupement carbonyle au groupement amine d’un résidu lysine, ce qui est à l’origine de pontages spontanés en plusieurs faisceaux de tropocollagène. On procède ainsi à une réticulation des molécules par condensation aldolique.
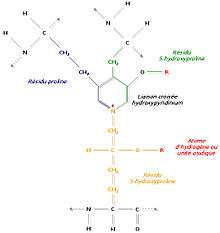
Liaison de trois régions polypeptidiques avec formation d’un hydroxypyridinium
Un autre mécanisme consiste à relier trois régions polypeptidiques par une liaison croisée hydroxypyridinium (ou hydroxypyridinoline). Il se forme alors une structure en échelle qui présente une périodicité de 680 Å, visible en microscopie électronique. Les zones inoccupées entre les différentes molécules de tropocollagène sont remplies à l’aide d’un hydroxyphosphate de calcium, l’hydroxyapatite, de formule Ca10 (PO4)6 (OH)2. La succession régulière de tropocollagène et d’hydroxyapatite est à l’origine de la striation visible en microscopie électronique.
Dégradation du collagène
Les collagénases
La dégradation du collagène est difficile et nécessite des enzymes particulières, les collagénases (de la famille des métalloprotéinases matricielles). Par exemple, les collagénases d’origine bactérienne (par exemple Clostridium histoliticum, dont le nom d’espèce signifie "destructeur de tissus") sont capables de cliver chaque chaîne de collagène en plus de deux cents points (parmi lesquels X – Gly – Pro – Y). D’autres organismes tels que les amphibiens possèdent des collagénases très spécifiques, capables d’effectuer une seule coupure à un site défini.
Maladies liées au collagène
Outre le scorbut dû à une carence en vitamine C, et dont nous avons déjà parlé, de nombreuses maladies sont liées à des défauts de synthèse du collagène, parmi lesquelles la maladie des os de verre.
.
Dans le Syndrome d'Ehlers-Danlos, le collagène est déficient.
Le collagène dans la Cosmétique
Le Collagène de Type | Natif et soluble est maintenant aussi utilisé dans la cosmétique dans le monde entier
Le collagène dans les Beaux-Arts

La sculpture Unraveling Collagen (2005) de Julian Voss-Andreae. Acier inoxydable, 3,40 m de hauteur.
Grâce aux coordonnées atomiques enregistrées dans la banque de données sur les protéines (PDB), l’artiste germano-américain Julian Voss-Andreae a réalisé des sculptures basées sur la structure du collagène et d’autres protéines. Dans l’œuvre Unraveling Collagen, les formes triangulaires révèlent les lignes de force dominantes évoquant les constructions contemporaines en acier.
Sources et liens externes
Présentation du collagène
Plusieurs types de collagène (en anglais)
Tissus conjonctifs
Une autre présentation avec une illustration de qualité
Association des malades du syndrome d'Ehlers-Danlos, Maladie rare des tissus conjonctifs et du collagène http://www.sed66.com

 词典释义:
词典释义:

.jpg)
.jpg)




.jpg)
.svg.png)