Le zinc (prononciation /zɛ̃g/, au Canada /zɛ̃k/, en Suisse /zɛ̃/) est un élément chimique, de symbole Zn et de numéro atomique 30. Il est par certains aspects semblable au magnésium dans la mesure où son état d'oxydation courant est +2, donnant un cation de taille comparable à celle de Mg. C'est le 24 élément le plus abondant dans l'écorce terrestre. Il possède cinq isotopes stables.
Son principal minerai est la sphalérite, un sulfure de zinc. Les réserves mondiales estimées de zinc étaient de 250 millions de tonnes en 2010, détenues notamment par l'Australie (21,2 %) et la Chine (16,8 %). La production mondiale s'est élevée en 2010 à 12 millions de tonnes, assurée essentiellement par la Chine (29,2 %), le Pérou (12,7 %) et l'Australie (12,1 %).
Origine de la découverte du zinc
Les Anciens qui connaissaient la calamine (minerai carbonaté de zinc) ne paraissent pas avoir utilisé le zinc en tant que métal isolé, encore que des bracelets de zinc aient été découverts en Grèce, dans les mines de Camaros, ce qui a permis de situer leur fabrication vers le V siècle av. J.-C..
Lexicologie
Le mot persan zangâr : rouille ; vert-de-gris [Azagar, asugar, asingar, zingar, ziniar (vert-gris) ; de ar. al-zanjâ, qui est le persan zangâr, même signification]. C'est l'alchimiste Paracelse qui lui donne ce nom, dérivé du mot Zinke en allemand qui signifie « pointe acérée » ou « dent », lié à l'apparence du zinc refroidi dans un récipient de coulée (effet dû à la formation de dendrites).
La prononciation académique zɛ̃ɡ (« zing' ») se retrouve dans zincate (zɛ̃ɡat, « zingat' ») et explique les dérivés zingage, zinguerie, zingueur.
Caractéristiques notables

Zinc, métal pur à 99,995 %
Le zinc est un métal de couleur bleu-gris, moyennement réactif, qui se combine avec l'oxygène et d'autres non-métaux, et qui réagit avec des acides dilués en dégageant de l'hydrogène.
L'état d'oxydation le plus commun du zinc est +II (appelé ion zincique).
Le zinc peut réagir avec les éléments ambiants : humidité, oxygène, dioxyde de carbone, etc, pour former une patine. Cette patine se traduit par une diminution progressive de l'éclat métallique de la surface. La couche formée, insoluble, adhérente et protectrice, a comme constituant principal du carbonate basique de zinc.
En contact avec de l'eau stagnante, il forme des taches blanchâtres constituées notamment d'hydroxyde et d'oxyde de zinc, produits pulvérulents généralement peu adhérents et non protecteurs, parfois appelés rouille blanche.
Le zinc est une ressource non renouvelable.
Isotopes
Le zinc possède 30 isotopes connus, de nombre de masse variant de 54 à 83, ainsi que dix isomères nucléaires. Parmi ces isotopes, cinq sont stables, Zn, Zn, Zn, Zn et Zn, et constituent l'ensemble du zinc, le plus abondant étant Zn (48,6% d'abondance naturelle). Sa masse atomique standard est de 65,409(4) u.
Vingt-cinq radioisotopes ont été caractérisés, le plus abondant et le plus stable étant Zn avec une demi-vie de 244,26 jours, suivis du Zn avec une demi-vie de 46,5 heures. Tous les autres radioisotopes ont une demi-vie de moins de 14 heures, la majorité d'entre eux inférieure à une seconde.
Réactions chimiques courantes
Le zinc existe essentiellement aux états d'oxydation 0 et II. À l'état 0, c'est presque exclusivement un réducteur. À l'état II, il possède des propriétés acidobasique, il intervient dans des complexes, et possède une chimie organométallique.
Oxydation de l'état 0
Avec un E° de -0,7 V ENH, le zinc est un métal qui réduit l'eau et de nombreux autres ions métalliques. La réduction est lente à pH neutre, mais assez rapide en milieux très acide ou très basique. La réduction d'autres ions métallique est utilisé :
dans les piles (Leclanché, alcaline) notamment;
dans des procédés industrielle d'hydrométallurgie.
Chimie acidobasique à l'état II
Les ions Zn réagissent vers pH 5 - 6 avec les ions hydroxydes pour donner un précipité d'hydroxyde de zinc Zn(OH)2. L'hydroxyde formé réagit avec des ions H pour redonner Zn (à ce titre Zn(OH)2 est une base) mais aussi avec des ions HO pour donner l'ion zincate ZnO2 (à ce titre Zn(OH)2 est un acide). L'hydroxyde de zinc (et l'oxyde ZnO dont il dérive par hydratation) et donc un hydroxyde (un oxyde) amphotère.
Précipitation de Zn
Quelques anions précipitent les ions Zn, comme les ions HO ou CO3.
Complexation de Zn
Les ions Zn peuvent donner des complexes avec la plupart des ligands courant (H2O, NH3 et les amines, les halogénures, SCN etc.).
L'ion Zn existe également dans des métalloprotéines, telles que certaines histone désacétylases.
Chimie organométallique
Le zinc fut un des tout premiers métaux dont la chimie organométallique fut étudiée par Philippe Barbier. Il permet par exemple la réaction éponyme.
Oligo-élément indispensable à faible dose (dont pour l'Homme)
Le zinc est contenu essentiellement dans la viande rouge et il ne semble pas exister de forme de stockage de ce métal dans l'organisme humain. Une carence patente en zinc est notée dans près d'un tiers de la population mondiale, essentiellement liée à la sous-nutrition. Des données récentes montrent qu'il peut aussi y avoir des carences dans les populations de pays riches lié une alimentation mal équilibrée, chez l'enfant et la personne âgée. Un déficit, même léger, a un impact sur certaines fonctions, dont immunitaires responsable de la défense vis-à-vis de certaines infections. Il peut induire une sensibilité accrue à certaines infections bactériennes (pneumonie) ou virales (diarrhées, infections des voies respiratoires). Le zinc est important pour la santé reproductive (spermatogenèse) et peut être un traitement efficace dans certaines formes d'acné.
Polluant (au-delà d'une certaine dose)
Le zinc est l'un des éléments traces métalliques qui devient un contaminant et un polluant au-delà des doses qui le rendent écotoxiques (qui varient selon les espèces, et le contexte ; par exemple il est plus mobile et biodisponible en milieu acide qu'en milieu basique). On l'a d'abord constaté dans et autour des raffineries de zinc où seules quelques espèces résistent bien aux sols contaminés par ce métal. Le zinc du sol (ou apporté par l'eau, l'air ou des boues d'épuration) peut à certaines doses s'avérer écotoxique pour des plantes cultivées PM(soja par exemple).
Des inquiétudes ont récemment émergé quant aux effet de nanoparticules d'oxyde de zinc sur les cultures. Elles se sont montrées (chez le soja) expérimentalement exposé - sous serre - à des nanoparticules de zinc) non toxiques pour la plante (à la différence du dioxyde de cérium), mais capables de s'y bioaccumuler dans les parties comestibles (feuilles et graine).
Le zinc est détecté et quantifié dans le sol, par des moyens de plus en plus précis.
Utilisations
Ces utilisations peuvent être classée en fonction de leur importance décroissante du zinc exploité dans le monde :
galvanisation (protection du fer) : 50% ;
fabrication de laiton et du bronze : 17% ;
alliages d'aluminium (Zamaks, Kayems) : 17% ;
produits semi-finis à base de zinc : 6%
produits chimiques : 6%
autres : 4%
Protection du fer
Le dépôt d'une mince couche de zinc en surface de l'acier le protège de la corrosion : c'est la galvanisation. L'acier galvanisé est utilisé dans l'automobile, la construction, l'électroménager, les équipements industriels, etc.
Les deux principales techniques qui permettent de produire l'acier zingué sont :
La galvanisation à chaud de produits finis: trempage de l'acier préalablement décapé, dans un bain de zinc en fusion à 450C, procédé mis au point par l'ingénieur français Stanislas SOREL en 1837; l'alliage de surface a une épaisseur de 40 à 200 μm en quelques minutes ; la couche ainsi formée est dure mais ne supporte pas d'être déformée (par exemple par pliage ou emboutissage).
L'électrozingage ; il s'agit d'une électrolyse où l'acier à la cathode (pôle négatif) dans un bain de chlorure de zinc contenant des ions Zn à 30 à 40 g.L. Ces ions se déposent sous forme de zinc à la surface de l'acier (et non d'un alliage comme avec le processus du trempage). Les ions Zn sont régénérés à l'anode de zinc qui s'oxydent simultanément. Ce procédé s'est surtout développé après 1980. Son intérêt est de maîtriser l'épaisseur de la couche de zinc qui se dépose, souvent limitée à 10 µm, au choix sur une seule face de la pièce ou sur les deux.
Le zingage du fer est la plus grosse utilisation du zinc.
Piles
Le zinc est un des deux composants permettant le fonctionnement des piles tant salines qu'alcalines.
Monnaie
Des pièces de monnaie sont en zinc ; ce sont surtout des pièces frappées pendant la Seconde Guerre mondiale et des monnaies de nécessité.
Alliage
Le zinc est utilisé pur ou bien pour réaliser des alliages :
avec le cuivre : le laiton connu depuis la préhistoire;
avec l'aluminium : le Zamak nom déposé avec le brevet en 1926 par la New Jersey Zinc Company ou le Kayem de l'Imperial Smelting Company. Ces produits ne diffèrent que par leur teneur en cuivre et la présence ou non de magnésium. Ils sont utilisés pour confectionner des pièces moulées (automobile, équipements ménagers, pièces industrielles, carters...).
Couverture
On l'emploie pour la couverture (toiture) des bâtiments et pour les gouttières et les descentes d'eaux pluviales.
Agriculture
Il est aussi utilisé en agriculture, comme apport d'oligo-élément, essentiellement en zone de sols fortement calcaires.
La culture la plus sensible à la carence ou insuffisance en zinc est probablement le maïs.
Des symptômes d'insuffisance apparaissent aussi sur la plupart des arbres fruitiers, plus rarement sur la vigne. Les légumes sont moins sensibles, hormis les asperges, les aubergines, les oignons et les pommes de terre.
Les apports, préventifs ou curatifs, se font sur le sol – et il faut alors veiller à la durée de la disponibilité pour les plantes – ou par pulvérisation foliaire.
Pour exemple, les besoins annuels pour le maïs se situent autour de 300 à 500 grammes de zinc par hectare.
Thérapeutique
Le zinc peut être utilisé pour le traitement des dermatoses (acné, érythème fessier), en particulier sous forme d'oxyde de zinc, car il possède des propriétés cicatrisantes et anti-inflammatoires.
Minerais de zinc
Le minerai qui est le plus utilisé est le sulfure de zinc appelé blende ou sphalérite (ZnS). Le mot blende, désormais abandonné dans la littérature minéralogique, provient du mot allemand blenden : « aveugler, éblouir, tromper ». Ce sulfure — le plus répandu dans la lithosphère — cristallise dans le système cubique. Il peut contenir des impuretés métalliques, telles que celles du fer (blendes foncées) : la marmatite, (Zn, Fe)S, contient jusqu’à 14 % de fer. Dans la nature, la sphalérite est associée à d’autres sulfures, comme la galène (sulfure de plomb : PbS).
La wurtzite a la même composition chimique mais cristallise dans le système hexagonal : c'est le polymorphe de haute température de ZnS.
Sous l’ancien vocable de calamine on trouve la smithsonite (carbonate de zinc : ZnCO3) et l'hémimorphite (silicate de zinc : Zn4Si2O7(OH) 2, H2O). Les deux minéraux peuvent être associés. Si historiquement la calamine fut utilisée au début du développement industriel de ce métal, elle est maintenant peu exploitée.
Autres minéraux plus rares :
Franklinite : (Zn, Fe, Mn)(Fe, Mn)2O4, spinelle ;
Willemite : Zn2SiO4, nésosilicate ;
Zincite : ZnO.
Environ 30 % du zinc mondial provient du recyclage.
Couverture en zinc à joint-debout (Toruń, Pologne).
Production de zinc
Les principaux gisements de minerais de zinc se situent en Chine et en Australie. La production de zinc à partir de minerai (blende) est effectuée dans deux filières technologiques distinctes :
la pyrométallurgie ;
l’hydrométallurgie suivie d’une électrolyse.
Les opérations du procédé pyrométallurgique sont :
grillage du sulfure de zinc (ZnS) pour obtenir un oxyde de zinc (ZnO) ;
réduction de l’oxyde pour obtenir du zinc métallique (Zn) ;
affinage du zinc par liquation et distillation pour supprimer les impuretés comme le plomb ou le fer.
Les opérations du procédé hydrométallurgique sont :
grillage du sulfure de zinc (ZnS) pour obtenir un oxyde de zinc (ZnO) et supprimer certaines impuretés (fer) ;
lixiviation pour solubiliser le zinc sous forme de sulfate de zinc (ZnSO4) ;
cémentation pour éliminer les impuretés : cobalt, nickel, cadmium et cuivre de la solution de sulfate de zinc ;
électrolyse pour transformer le sulfate de zinc en zinc métal.
Quelques données économiques
La consommation mondiale de zinc en 2004 a été de l'ordre de 10 millions de tonnes :
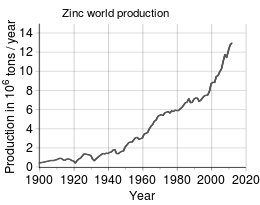
Tendance de la production mondiale
Asie 5 057 kt (kt = milliers de tonnes)
Europe 2 840 kt
Amériques 2 113 kt
Océanie 263 kt
Afrique 193 kt
-
Total 10 466 kt
La production de métal en 2004 s'est répartie de la façon suivante :
Asie 4 729 kt
Europe 2 715 kt
Amériques 1 993 kt
Océanie 474 kt
Afrique 256 kt
-
Total 10 167 kt
La production minière (en kt de zinc contenu dans le concentré) a été en 2004 de :
Asie 3 340 kt
Europe 1 037 kt
Amériques 3 606 kt
Océanie 1 298 kt
Afrique 353 kt
-
Total 9 634 kt
Le zinc est un des métaux non ferreux cotés à la bourse des métaux de Londres. Son prix au comptant, exprimé en $, est cyclique : entre 1994 et 2005, il a varié entre 725 $/t et 1 760 $/t. En 2006, il a dépassé les 3 000 $/t.
Expressions
Dans le langage populaire le zinc désigne le comptoir d'un bar.
Le zinc est un surnom pour désigner un avion ;
Le plombier-zingueur désigne un plombier qui est également zingueur ;
« avoir du zinc dans la tête » : être pénible ;
Dézinguer : tuer.
Zinc est parfois synonyme de joint/pétard/spleef
Ça zinc ? : Ca va ?
Doigt de zinc : motif porté par certaines protéines.
Symbolique
Calendrier républicain
Dans le calendrier républicain, le Zinc était le nom attribué au 28 jour du mois de nivôse.
Commerce
En 2014, la France est nette importatrice de zinc, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 600 €.

 词典释义:
词典释义:
 版
版
 )
) 版
版
 [第30号元素]
[第30号元素]
 汞剂
汞剂 磷合金
磷合金 ; 伪方铅矿
; 伪方铅矿 铜水绿矾
铜水绿矾
 七水锰矾
七水锰矾 水绿矾
水绿矾 锰镁透辉石
锰镁透辉石 铀矾
铀矾
 粘
粘 粉
粉 粉
粉

 华
华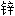 明胶
明胶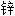 黄
黄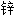
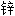
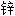 溶液
溶液
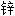 块
块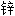

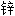
 华
华
 丁香油糊剂
丁香油糊剂 漆
漆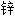 漆
漆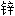 粉基漆
粉基漆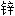 电池
电池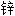 版;
版; 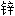 板
板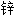 软膏
软膏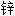
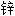
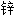 干燥剂
干燥剂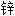 锆
锆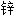 尖晶石
尖晶石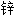
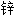 , 皓矾
, 皓矾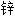 浊度
浊度

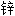 浊度
浊度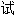
 绿
绿
