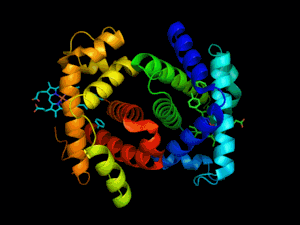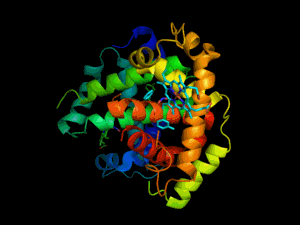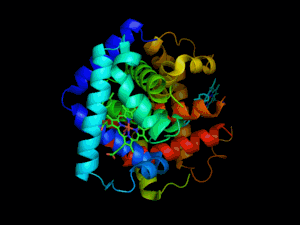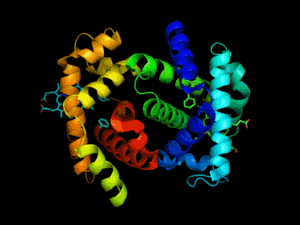
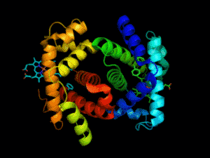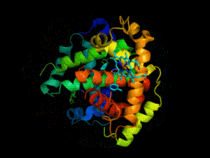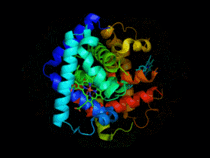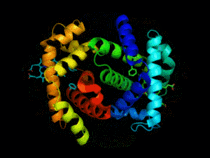
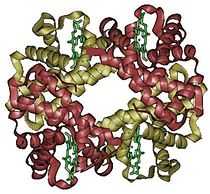
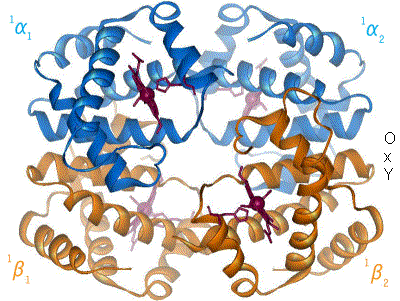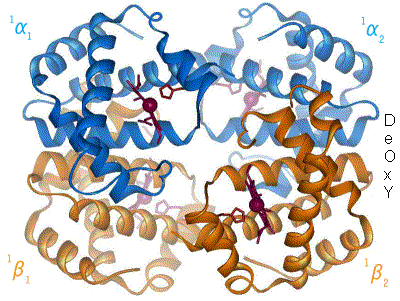
Hémoglobine représentation tridimensionnelle.
L'hémoglobine est une protéine dont la principale fonction est le transport du dioxygène dans l'organisme humain et chez les autres vertébrés. L'hémoglobine se trouve essentiellement à l'intérieur des globules rouges du sang (13,5 à 17,5 g/dl chez l'homme et 12,5 à 15,5 g/dl chez la femme - en grammes d’hémoglobine par dl de sang) ce qui leur confère leur couleur rouge. Elle appartient à la famille des protéines globulaires.
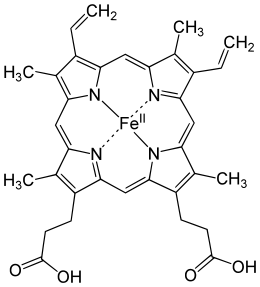
L'hémoglobine humaine est constituée de quatre chaînes identiques deux à deux : deux chaînes α de 141 acides aminés chacune et de deux chaînes β de 146 acides aminés chacune (ce qui donne un total de 574 acides aminés pour l'hémoglobine). Chacune de ces chaînes est associée à un groupement prosthétique : l'hème. Le nom d'hémoglobine provient de deux mots : hème et globine. On la symbolise par « Hb ». Une molécule d'hème est constituée d'un ion fer complexé par une porphyrine.
Historique
En 1960, Max Perutz et John Kendrew expliquent la structure tridimensionnelle de l'hémoglobine. En 1962, ils reçoivent conjointement le prix Nobel de chimie « pour leurs études des structures des protéines globulaires ».
Fonction
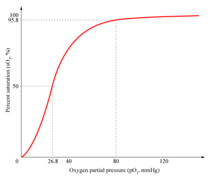
Pourcentage d'hémoglobine ayant fixé du dioxygène, en fonction de la pression partielle en dioxygène. Courbe de Barcroft de type sigmoïde → effet coopératif
Chez les vertébrés terrestres, l'hémoglobine du sang fixe le dioxygène de l'air des poumons. Grâce à la circulation sanguine, l'hémoglobine oxygénée va être transportée vers l'ensemble des autres organes, pour relâcher par la suite le dioxygène qui sera consommé par les cellules qui en ont besoin. L'hémoglobine permet au sang de contenir plus de dioxygène qu'il ne pourrait par simple dissolution.
Structure
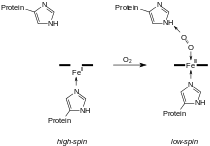
On trouve au cœur de la molécule un cycle hétérogène porphyrique (noyau tétrapyrrolique), l'hème, qui contient un ion fer. Cet ion fer est le site de fixation de l'oxygène. L'ion ferreux établit 5/6 liaisons de coordinence : 4 avec les 4 N de l'hème,1 avec le N d'un acide aminé de la chaîne polypeptidique : l'histidine et dans la forme oxygénée 1 avec O2. Étant donné qu'une sous-unité de l'hémoglobine est formée par un hème enfermé dans une protéine globulaire le nom est très logique. Il y a de nombreuses protéines contenant un hème, mais l'hémoglobine en est la plus connue. L'élément fer peut exister sous 2 formes dans la molécule :
sous forme ferreuse, ion Fe : seule forme active de l'hémoglobine humaine. On parle d'oxyhémoglobine. (interaction réversible avec O2).
sous forme ferrique, ion Fe : on parle de méthémoglobine.
On peut parler du pouvoir oxyphorique de l'hémoglobine. Ceci correspond à la quantité de dioxygène qu'elle peut fixer. Cette valeur est de 1,34 ml d'O2/g d'Hb.
Hémoglobine humaine
Chez l'être humain, l'hémoglobine Adulte (HbA) est un tétramère, constitué de deux globines α et deux globines β liées par des liaisons faibles. Chez le nouveau-né, il s'agit d'hémoglobine fœtale avec deux globines α et deux globines γ. Les sous-unités sont structurellement similaires et ont à peu près la même taille. Chaque globine a une masse moléculaire d'environ 17 000 daltons, pour une masse totale d'environ 68 000 daltons. Chaque globine de l'hémoglobine contient un hème, de telle manière que la capacité totale de liaison de l'hémoglobine pour le dioxygène est de quatre molécules.
Étapes de réaction :
Hb + O2 ↔ HbO2
HbO2 + O2 ↔ Hb(O2)2
Hb(O2)2 + O2 ↔ Hb(O2)3
Hb(O2)3 + O2 ↔ Hb(O2)4
Résumé de la réaction : Hb + 4 O2 → Hb(O2)4
Une structure de la forme désoxy de l'hémoglobine humaine est donnée par le PDB 1A3N.
En pratique, on n'observe pas ceci : Hb + 4 O2 ↔ Hb(O2)4
En effet, dans les conditions physiologiques, deux sous-unités sont toujours oxygénées par deux molécules d'hémoglobine. On peut donc écrire : Hb(O2)2 + 2 O2 ↔ Hb(O2)4
Valeurs normales chez l'adulte
Hommes : 13 - 17,87 g/dL de sang ou 8,3 - 10,5 mmol/L de sang.
Femmes : 12,10 - 16,40 g/dL de sang ou 7,4 - 9,9 mmol/L de sang.
Chez la femme enceinte ce taux est physiologiquement plus bas : on parle d'anémie gravidique lorsque le taux d'hémoglobine est inférieur à 11 g/dL. Chez le nouveau-né le taux est plus élevé que chez l'adulte et diminue rapidement.
Hémoglobine du grand dauphin
La composition de l'hémoglobine du grand dauphin océanique lui permet de rester immergé durant une plus grande période de temps que le grand dauphin vivant plus près des côtes.
Une unique exception chez les vertébrés
Les poissons de la famille des Channichthyidés ne possèdent pas d'hémoglobine dans leur sang, ce qui selon le Pr Guillaume Lecointre est l'unique exception chez les vertébrés.
Liaison à l'oxygène
Hème
Dans la forme tétramérique de l'hémoglobine normale, la liaison avec l'oxygène, ou formation d'oxyhémoglobine, est un procédé coopératif, ou allostérique, où l'affinité de liaison de l'hémoglobine pour l'oxygène est affectée par la saturation en oxygène de la molécule. Cela a pour conséquence que la courbe d'affinité de l'oxygène pour l'hémoglobine a la forme d'une sigmoïde (courbe en forme de S), contrairement à un procédé non coopératif (michaélien) où elle a une forme hyperbolique.
L'affinité de l'hémoglobine pour l'oxygène décroît en présence de dioxyde de carbone (effet Haldane), à pH faible et lorsque la température augmente. Ces propriétés chimiques sont essentielles au vivant puisqu'elles permettent une meilleure libération du dioxygène dans les tissus actifs (ex: le muscle en exercice, par la production de métabolites développe un pH acide, sa température augmente affirmant la dissociation du dioxygène de l'hème). Le dioxyde de carbone réagit avec l'eau pour former du bicarbonate via la réaction: CO2 + H2O ↔ HCO3 + H
Par cette réaction on voit que le sang possédant un haut taux de dioxyde de carbone a aussi un pH plus faible. L'hémoglobine peut se lier aux protons et au dioxyde de carbone ce qui induit un changement de conformation dans la protéine qui facilite la libération de l'oxygène. Le proton peut se lier à différents endroits le long de la protéine, alors que le dioxyde de carbone se lie sur le groupe alpha-amino en formant un carbamate. Ce contrôle porte le nom d'effet Bohr. De la même manière, lorsque le niveau de dioxyde de carbone dans le sang diminue (par exemple près des poumons), le dioxyde de carbone est relâché, augmentant l'affinité de la protéine pour l'oxygène. Ce contrôle de l'affinité de l'oxygène pour sa liaison avec l'hémoglobine et le relâchement du dioxyde de carbone est connu sous le nom d'effet Haldane.
La liaison de l'oxygène est aussi affectée par des molécules telles que le 2,3-diphosphoglycérate, qui diminue l'affinité de l'hémoglobine pour l'oxygène. Chez les personnes acclimatées aux hautes altitudes, la concentration de 2,3-diphosphoglycérate dans le sang est plus importante, ce qui permet à l'hémoglobine de délivrer des quantités d'oxygène plus importantes aux tissus dans des atmosphères pauvres en oxygène.
Poisons de l'hémoglobine
L'hémoglobine forme un composé stable avec le monoxyde de carbone (CO) : la carboxyhémoglobine ; en outre, l'affinité de l'hémoglobine pour le monoxyde de carbone est supérieure de 200 à 250 fois par rapport à celle de l'oxygène, ce qui signifie que le CO concurrence efficacement l'oxygène lors de l'hématose (réoxygénation du sang au niveau des poumons). Le CO est donc un antagoniste de O2, pouvant ainsi provoquer une hypoxie tissulaire : son inhalation à forte doses entraîne des malaises, céphalées (maux de tête), puis asthénie (faiblesse intense) et enfin la mort par asphyxie. On traite les empoisonnements au CO sévères par immersion prolongée en caisson hyperbare réduisant ainsi la demi-vie de la carboxyhémoglobine.
Par ailleurs, des agents oxydants tels que les nitrates contenus dans l'eau ou les légumes peuvent oxyder le fer ferreux(Fe) de l'hème en fer ferrique (Fe), le rendant ainsi incapable de fixer l'oxygène. L'hémoglobine est alors appelée méthémoglobine. Le traitement consiste en l'administration de bleu de méthylène.
L'ion cyanure CN est également un inhibiteur de l'oxydation hémoglobinéique, de même que le sulfure d'hydrogène H2S.
Élimination de l'hémoglobine
Les globules rouges sont phagocytés par les macrophages de la rate et du foie dans les situations pathologiques. Physiologiquement, ils sont plutôt éliminés par les macrophages de la moelle osseuse. Au cours de ce processus, la composante protéique de l'hémoglobine est dégradée sous forme d'acides aminés qui sont recyclés. La composante héminique est dégradée en biliverdine puis en bilirubine insoluble (porphyrine sans fer) de couleur jaune. Le fer est recyclé. La bilirubine insoluble est libérée dans le plasma par les macrophages, où elle se lie à la sérum-albumine. Elle est ainsi acheminée dans la circulation sanguine et captée par les hépatocytes. Elle est alors rendue soluble par une réaction de conjugaison avec une molécule d'acide glucuronique puis est excrétée par le foie dans la bile.
La bile se déverse dans l'intestin et la bilirubine soluble est dégradée par des bactéries en stercobiline de couleur brune, qui donne sa couleur aux selles. La bilirubine est également évacuée dans les urines.
Lorsque la bilirubine ne peut pas être excrétée, sa concentration augmente dans le sang. Elle est alors essentiellement éliminée par les urines, ce qui provoque des urines foncées et des selles décolorées, presque blanches.
Dans les cas d'hémolyse (destruction des hématies dans les vaisseaux), l'hémoglobine est captée par l'haptoglobine et l'hème par l'hémopexine, bloquant ainsi l'effet oxydatif.
Utilisation clinique
En médecine, plusieurs termes se rapportent à l'hémoglobine :
Le taux d'hémoglobine est exprimé en g/100 mL. Les valeurs normales du taux d'hémoglobine dépendent du sexe et de l'âge du sujet. Un taux d'hémoglobine inférieur à la norme définit une anémie.
La saturation SaO2 définie en % est calculée par la quantité d'oxyhémoglobine divisé par la quantité totale d'hémoglobine du sang. La saturation SaO2 peut être mesurée sur du sang veineux ou du sang artériel. La saturation en oxygène du sang est un des paramètres d'un examen appelé gaz du sang. La valeur de la saturation est considérée comme dangereuse si elle est inférieure à 90 % pour du sang artériel. La valeur normale est d'environ 96-100 % pour des conditions atmosphériques normales. À cette valeur, on parle de capacité en O2 du sang.
La cyanose est un signe clinique. Il s'agit de la coloration bleutée des téguments. Elle apparaît lorsque la concentration d'hémoglobine réduite dépasse les 5 g/100 ml de sang capillaire. Elle peut être masquée par une anémie.
Molécules analogues
La molécule d'hème de l'hémoglobine ressemble à la chlorophylle, l'atome de fer étant remplacé par un atome de magnésium, ce qui lui apporte sa couleur verte.
Chez les invertébrés, l'hémocyanine joue un rôle analogue à l'hémoglobine. Quelques espèces semblent cependant posséder une hémoglobine capable de fixer le dioxygène, voire de le transporter de manière aussi efficace que chez les vertébrés (ex : Lamproie marine, qui possède une hémoglobine présentant un mélange curieux et pour le moment tout à fait unique de caractères et propriétés à la fois primitifs et hautement spécialisés). Son poids moléculaire d'environ 17 000, comme celui de l'hémoglobine musculaire, contient apparemment un hème. Son point isoélectrique est celui d'une hémoglobine typique d'invertébré. Les acides aminés qui la composent ne sont cependant qu'en partie caractéristiques des hémoglobines d'invertébrés, pour l'autre partie, ils évoquent plutôt une hémoglobine de vertébrés. Une étude a mesuré la courbe d'équilibre en dioxygène de ce pigment à différents pH ; c'est une hyperbole rectangulaire comme celle qu'on observe avec l'hémoglobine du muscle des vertébrés. L'hémoglobine d'invertébrés tels que le ver Nippostrongylus ou celui de certaines larves de mouches de la famille des Oestridae (qui sont des parasites d'animaux vivants) semblent principalement servir au stockage du dioxygène et peu à son transport. L'hémoglobine de la lamproie est au contraire un agent efficace de transport du dioxygène, grâce à une affinité assez faible pour le dioxygène et un très grand effet Bohr ; il rivalise avec les hémoglobines plus efficaces trouvées dans le sang des vertébrés.
Maladies génétiques de l'hémoglobine
Comme de nombreuses protéines, les chaines d'hémoglobine présentent diverses mutations qui n'ont le plus souvent aucune incidence clinique. Plus de 500 hémoglobines anormales ont été répertoriées. Certaines mutations (Hb Köln, Indianapolis, etc.) entraînent une instabilité du tétramère précipitant en corps de Heinz, ou une méthémoglobinémie (hémoglobines M).
Parfois cette mutation entraîne une affinité anormale pour l'oxygène, soit, telle l'Hb Hope, une diminution d'affinité avec une P50 élevée donnant une anémie bien tolérée et une cyanose au repos, l'effort et l'altitude étant mal supportés, soit, telle l'Hb Chesapeake, Malmö, ou Olympia, une augmentation d'affinité avec une P50 diminuée et une polyglobulie compensatrice entraînant des manifestations cliniques à partir d'un certain âge.
D'autres peuvent être responsables d'une hémolyse chronique, HbS (par mutation de glutamine en valine ce qui va provoquer la polymérisation d'Hb), HbC, ou aggraver à l'état hétérozygote une autre hémoglobinopathie, HbO Arabe, HbD Punjab ou Hb Lepore, ou une β-thalassémie, HbE.
Enfin, l'atteinte génétique peut porter non sur la structure primaire de la protéine, mais sur un défaut quantitatif de sa synthèse, ou une persistance anormalement élevée de l'hémoglobine fœtale HbF.
Les défauts de synthèse, ou l'anomalie moléculaire sont décrits sous les noms de :
Thalassémies.
Drépanocytose.
L'hémoglobine dans les Beaux-Arts

Heart of Steel (Hemoglobin) (2005) de Julian Voss-Andreae. Les images montrent la sculpture de 1,60 m de hauteur juste après son installation, après 10 jours et après plusieurs mois d’exposition aux éléments.
En 2005, l’artiste Julian Voss-Andreae a réalisé la sculpture Heart of Steel (Hemoglobin), ayant pour modèle l’épine dorsale de la protéine. La sculpture est faite de verre et d’acier Corten. L’aspect rouillé de l’œuvre est intentionnel et évoque la réaction chimique fondamentale de l’oxygène se liant au fer contenu dans l’hémoglobine..
L'artiste montréalais Nicolas Baier a réalisé la sculpture Lustre (hémoglobine), une sculpture en acier inoxydable poli qui montre la structure de la molécule d'hémoglobine. La sculpture se trouve à l'atrium du centre de recherches du Centre universitaire de santé McGill à Montréal. La taille de la sculpture est d'environ 10 mètres par 10 mètres par 10 mètres.

 词典释义:
词典释义:



.jpg)