Le terme halogène désigne les éléments chimiques de la 17 colonne du tableau périodique, anciennement appelé groupe VII ou VIIA. Ces éléments chimiques sont : le fluor 9F, le chlore 17Cl, le brome 35Br, l’iode 53I et l’astate 85At.
Le mot « halogène » vient du grec ἅλς (halos) qui veut dire sel, et γεννάν (gennán) qui porte l'idée d’engendrer. Le nom « halogène » a été introduit en 1811 pour désigner le dichlore qui était connu pour attaquer les métaux et donner des sels. Le nom a depuis été étendu à toute la famille ou série chimique.
Ces éléments chimiques peuvent se trouver liés à la quasi-totalité des autres éléments chimiques du tableau périodique, y compris quelques gaz nobles pour ce qui concerne le fluor. À 0 °C, sous la pression atmosphérique, les corps simples correspondant sont sous forme de molécules diatomiques : à l'état gazeux pour le difluor F2 et le dichlore Cl2, liquide pour le dibrome Br2 et solide pour le diiode I2 et l’astate. Ils ne se trouvent généralement pas dans la nature sous cette forme (le difluor a néanmoins été identifié dans l'antozonite). La forme la plus courante, dans la nature est la forme ionique (ions fluorure, chlorure, bromure ou iodure) et, en quantité moins abondante, dans des combinaisons moléculaires, par exemple avec le carbone. C'est le cas des hormones thyroïdiennes iodées par exemple.
La configuration électronique des atomes correspondant est de la forme : [gaz noble] ns np
Ces atomes possèdent donc sept électrons dans leur couche électronique extérieure. Pour respecter la règle de l'octet, cette configuration électronique doit être complétée avec un huitième électron. Ces éléments chimiques sont alors sous forme d'anion appelé ion halogénure : (ion fluorure, ion chlorure, ion bromure, ion iodure). L'ion astature ne se trouve pas dans la nature, tous ses isotopes étant instables et à courte durée de vie.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Fl Uup Lv Uus Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No B Métalloïdes H Non-métaux F Halogènes He Gaz nobles Li Métaux alcalins Be Métaux alcalino-terreux Sc Métaux de transition Al Métaux pauvres La Lanthanides Ac Actinides Ubu Superactinides Uut Éléments non classés
Propriétés des corps simples (dihalogènes)
Propriétés physiques
Comme pour la plupart des groupes du tableau périodique, les propriétés physiques des corps simples du groupe 17 (groupe des halogènes) varient progressivement du haut vers le bas du groupe : pour les halogènes, leur température de fusion et leur température d'ébullition croît en même temps que la polarisabilité de leur cortège électronique : plus cette polarisabilité est grande, plus grande est l'énergie requise pour rompre les liaisons intermoléculaires permettant les changements d'états du plus condensé au moins condensé.
Réactivité chimique
Il faut distinguer la réactivité du difluor de celle des autres dihalogènes. Le difluor réagit avec tous les corps simples, y compris quelques gaz nobles (krypton et radon. Les autres dihalogènes réagissent d'autant moins qu'ils sont positionnés en bas de la colonne.
Les corps simples de cette famille chimique réagissent à température ambiante (et en brûlant à chaud) avec presque tous les métaux pour former des composés ioniques tels que NaCl, FeCl3, UI3 etc. Les halogènes réagissent aussi avec la plupart des corps simples non-métalliques (C, H2, Si, etc.) pour former des composés covalents.
Les dihalogènes réagissent également avec de nombreuses molécules pour former une importante variété de composés, tant en chimie organique (ex. avec le méthane pour donner des halométhanes) que inorganique (avec l'eau pour donner des composés des oxacides (ex. : HClO3).
Les dihalogènes réagissent entre eux pour donner des composés interhalogénés (ex. : ClF, ICl3 etc.).
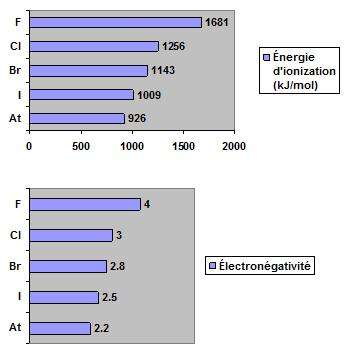
En se déplaçant de haut en bas dans le groupe 7A, l'augmentation du rayon atomique et une diminution de l’électronégativité interprète généralement la diminution de la réactivité des dihalogènes. Il en résulte également une moindre polarité des liaisons chimiques faisant intervenir un halogène.
Les atomes de la famille des halogènes possèdent la plus grande variation d’électronégativité de tous les groupes du tableau périodique (selon l’échelle de Pauling, XF = 4,0, XAt = 2,2).
Dans la plupart des réactions, ces éléments agissent comme agents d’oxydation. Aussi, les halogènes qui sont plus haut dans le groupe peuvent oxyder les anions halogénures qui sont plus bas :
F2 (g) + 2X (aq) → 2F (aq) + X2 (aq) où X= Cl, Br, I.
Donc, la capacité d’oxydation de X2 diminue lorsqu’elle descend du groupe 7A tandis que la capacité de réduction de X augmente lorsqu’elle descend du groupe. Plus l’ion est gros, plus il est facile de perdre un électron.
Composés chimiques
Propriétés périodiques
Dans ce groupe, la configuration électronique est ns np. Ces éléments possèdent une orbitale p à moitié pleine capable de recevoir un électron provenant d’un autre élément, tel un alcalin. Pour le groupe des halogènes :
le rayon atomique et le rayon ionique augmentent de haut en bas ;
l’énergie d'ionisation et l’électronégativité diminuent de haut en bas.
Chimie des composés inter-halogènes
Ces dihalogènes réagissent entre eux de façon exothermique pour former des composés inter-halogènes. Les molécules les plus simples dans ce domaine sont les molécules diatomiques, comme le fluorure de chlore ClF ou le chlorure de brome BrCl. La formule générale des composés inter-halogènes est XYn (n=1, 3,5,7). Le tableau suivant présente les principaux composés inter-halogènes.
Composés inter-halogènes F Cl Br I At F F2 Cl ClF, ClF3, ClF5 Cl2 Br BrF, BrF3, BrF5 BrCl Br2 I IF, IF3, IF5, IF7 ICl, (ICl3)2 IBr, IBr5 I2 At AtCl AtBr AtI At2
Les composés interhalogénés possède des propriétés physico-chimiques intermédiaires des dihalogènes qui les constituent. Par exemple, BrCl est plus oxydant que Br2 et moins que Cl2. Ils peuvent à ce titre être utilisés comme réactifs fluorant plus doux que le difluor, connus pour son extrême réactivité.
Dans chaque cas, l’atome central est le moins électronégatif et possède un état positif d’oxydation. Voici quelques exemples :
Sn (s) + ClF3 (l) → SnF2 (s) + ClF (g) ;
P4 (s) + 5 ClF3 (l) → 4 PF3 (g) + 3 ClF (g) + Cl2 (g) ;
2B2O3 (s) + 4 BrF3 (l) → 4 BF3 (g) + 2 Br2 (l) + 3 O2 (g).
Inter et polyhalogénures
Les composés interhalogénés peuvent s'ioniser.
L'ion triodure I3 est un ion de structure géométrique linéaire qui rend bien compte de la solubilité du diiode dans l'eau. Il se forme par réaction directe (en solution aqueuse) de I2 avec I. C'est le stéréotype de nombreux interhalogénures comme I2Cl, moins courant, mais qui se forment de la même façon.
Usages pratiques
Éclairage
Les lampes dites halogène tiennent leur nom de la présence d'une petite quantité des éléments chimiques brome ou iode introduits pour permettre un survoltage du filament de tungstène, donc pour que celui-ci puisse atteindre une température plus élevée, donc une couleur plus blanche. L'intérêt de la présence d'halogène s'interprète chimiquement. Il est basé sur le fait que les halogénures de tungstène se forment, à température intermédiaire par action directe entre le dihalogène et le tungstène, et se décomposent à haute température en redonnant du tungstène et le dihalogène. Or le filament de tungstène a une température intermédiaire là où il possède son plus gros diamètre (résistance électrique plus faible) et une température élevée là où il possède son plus faible diamètre (forte résistance, donc fort effet Joule).
En réagissant avec le tungstène, le dihalogène oxyde le filament en formant les produits gazeux WBrn, (n = 5 ou 6). Ce bromure de tungstène est gazeux. Cela revient donc à évaporer une partie du filament de la lampe, là où son diamètre est le plus gros.
Cet halogénure gazeux se décompose là où la température de la lampe est la plus élevée. Cela revient à déposer du tungstène sur les parties du filament les plus fines. L'ensemble du processus (évaporation / redéposition) consiste donc à transférer du tungstène des parties épaisses aux parties fines du filament et donc à homogénéiser son diamètre. Ainsi auto-entretenu, le filament supporte d'être chauffé plus qu'une ampoule à incandescence ordinaire.
Photographie
Selon le type de film photographique, des cristaux de chlorures, bromures et/ou d'iodures d'argent absorbent la lumière de diverses couleurs. Ces cristaux exposés deviennent capables de réagir avec les révélateurs pour former les grains de l'image.
Hygiène
L'élément chimique chlore, sous forme d'ion hypochlorite ClO, présent dans l'eau de Javel est un agent oxydant et bactéricide efficace.; Il sert également pour le blanchiment. Sur le plan industriel, certains oxyde de chlore sont également utilisés.
L'élément chimique brome, sous forme de dibrome, est utilisé pour la stérilisation de piscine. Le dibrome, liquide est plus facile à stocker que le dichlore, gazeux, et est moins agressif pour les cellules. Il est intéressant pour les piscines d'eau chaude comme les spas. Mais il reste un réactif coûteux.
L'élément chimique iode est également utilisé pour la désinfection, par exemple avec teinture d'iode ou la bétadine.
L'élément chimique fluor n'est pas utilisé pour l'hygiène. Sous forme F2, il serait bien trop réactif et destructeur.
Alimentaire
Les halogènes, surtout l'élément chimique chlore, étant omniprésent dans la nature, ils font partie de l'alimentation. L'ion chlorure est présent en particulier dans le sel de table qui est essentiellement constitué de chlorure de sodium. Cet élément chimique se retrouve aussi sous forme moléculaire dans l'alimentation par exemple avec un édulcorant artificiel, le sucralose L'élément chimique iode est nécessaire à la santé humaine: une glande, la thyroïde est chargée de fixer cet élément chimique et de synthétiser des hormones iodées.
Pharmaceutique
De très nombreux médicaments contiennent des halogènes.
Exemples :
les agents anesthésiques volatils halothane, enflurane, desflurane, sévoflurane et isoflurane ;
le bromure de potassium était utilisé comme somnifère ;
Polymères halogénés
Fluoropolymères : polytétrafluoroéthylène (PTFE) (Téflon) ; polyfluorure de vinyle (PVF) ; polyfluorure de vinylidène (PVDF) ; éthylène tétrafluoroéthylène (ETFE) ; perfluoroalkoxy (PFA) ; polychlorotrifluoroéthylène (CTFE) ; polydifluoroéthylène.
Chloropolymères : polychlorure de vinyle (PVC) ; polychlorure de vinyle surchloré (PVC-C) ; polychlorure de vinylidène (PVDC).
Solvants halogénés
Les hydrocarbures halogénés (fluorés, chlorés, bromés ou iodés) : perchloroéthylène, trichloréthylène, dichlorométhane, chloroforme, tétrachlorométhane (nocifs pour la couche d'ozone).

 词典释义:
词典释义:
 )
) ; 卤化
; 卤化 ; 卤代
; 卤代 ; 卤素
; 卤素 halogènem卤素
halogènem卤素