
La phosphorescence est le phénomène observé lorsqu'une matière continue à émettre de la lumière après avoir été éclairée. Le terme signifie approximativement illuminer comme le phosphore. Le phosphore blanc donne en effet de la lumière dans le noir, mais dans cette matière ce sont des réactions d'oxydation (chimiluminescence) qui en sont la cause. Phosphorescence et fluorescence sont deux formes différentes de luminescence.
Le phénomène de phosphorescence proprement dit est dû, lui, à une autre réaction : il s'agit d'une suite de pertes d'énergie par des électrons qui ont été excités et qui retournent à des niveaux d'énergie plus bas. Le fait que cela se passe lentement relève du domaine de la mécanique quantique : le retour des électrons à leur état habituel concerne un passage interdit.
Des matières phosphorescentes comme les aluminates de terres rares sont utilisées pour peindre les aiguilles de certains réveils ou montres, ainsi que dans la fabrication de jouets lumineux.
Différences entre « fluorescence » et « phosphorescence »
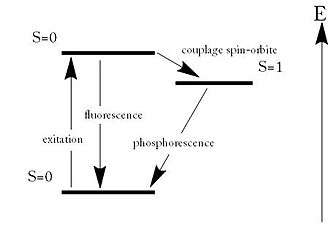
Une molécule phosphorescente possède la propriété d'absorber de l'énergie lumineuse (lumière d'excitation) et de la restituer lentement sous forme de lumière phosphorescente (lumière d'émission). Une fois l'énergie du photon absorbée, la molécule se trouve alors généralement dans un état électroniquement excité, souvent un état singulet, que l'on note S0*. Le retour à l'état fondamental peut alors se faire de différentes manières : soit par fluorescence, soit par phosphorescence.
La fluorescence est caractérisée par l'émission d'un photon de manière très rapide. Cette rapidité s'explique par le fait que l'émission respecte une des règles de sélection de l'émission de photons de la mécanique quantique qui est ΔS=0, ce qui signifie que la molécule reste dans un état singulet.
La phosphorescence quant à elle est caractérisée par une transition d'un état S=0 vers un état S=1 (état triplet), qui n'est pas permise par le modèle quantique, mais qui est rendue possible par le couplage spin-orbite. Cependant, la transition est plus lente à s'effectuer. Suit alors une émission de photon pour retourner à l'état fondamental.
Utilisation
Certaines montres fabriquées dans la première moitié du XX siècle utilisaient des traces de radium ou tritium pour exciter en permanence la peinture phosphorescente (à base de sulfure de Zinc ZnS) de leurs aiguilles.
Cette pratique dangereuse (en particulier pour ceux qui travaillaient à leur fabrication) a été abandonnée au profit de peintures à base d’aluminate de strontium (SrAl2O4) dopé par de l'europium, ces peintures ayant une rémanence et une luminosité dix fois plus grandes.
Pigments phosphorescents - comparaison ZnS versus SrAl
Poudre de ZnS Poudre de SrAl
Pigments dans l'obscurité
Pigments dans l'obscurité après 4 minutes


磷光是一种缓慢发光的光致发光现象。当某种常温物质经某种波长的入射光(通常是紫外线或X射线)照射,吸收光能后进入激发态(通常具有和基态不同的自旋多重度),然后缓慢地退激发并发出比入射光的的波长长的出射光(通常波长在可见光波段),而且与荧光过程不同,当入射光停止后,发光现象持续存在,其衰退时间大于 秒。发出磷光的退激发过程是被量子力学的跃迁选择规则禁戒的,因此这个过程很缓慢。
机制
电子依照泡利不兼容原理(Pauli Exclusion Principle)排布在分子轨道上,当分子吸收入射光的能量后,其中的电子从基态(通常为自旋单重态)跃迁至具有相同自旋多重度的激发态。处于激发态的电子可以通过各种不同的途径释放其能量回到基态。比如电子可以从经由非常快的(短于秒)内转换过程无辐射跃迁至能量稍低并具有相同自旋多重度的激发态,然后从经由系间跨越(intersystem crossing)过程无辐射跃迁至能量较低且具有不同自旋多重度的激发态(通常为自旋三重态,self-triplet excited state),再经由内转换过程无辐射跃迁至激发态,然后以发光的方式释放出能量而回到基态。由于激发态和基态具有不同的自旋多重度,虽然这一跃迁过程在热力学上有利,可是它是被跃迁选择规则禁戒的,从而需要很长的时间(从秒到数分钟乃至数小时不等)来完成这个过程;当停止入射光后,物质中还有相当数量的电子继续保持在亚稳态上并持续发光直到所有的电子回到基态。
公式
那里是自旋单重态,是自旋三重态,*表示激发态,h 是普朗克常数。

 词典释义:
词典释义:
 词:
词: 光,闪光;
光,闪光;
 镜进行的;
镜进行的;