Le sodium est l'élément chimique de numéro atomique 11, de symbole Na. C'est un métal mou et argenté, qui appartient aux métaux alcalins. On ne le trouve pas à l'état de corps pur dans la nature, mais il est très abondant sous forme de composés, par exemple dans le sel de cuisine. Il brûle dans l'air avec une flamme jaune.
Histoire
Le sodium est depuis longtemps reconnu dans les composés, mais il ne fut pas isolé avant 1807, lorsque Sir Humphry Davy réalisa l'électrolyse de la soude caustique. Pendant le Moyen Âge, un composé du sodium avec le nom latin de sodanum était utilisé pour le traitement des maux de tête. Le symbole du sodium, Na, vient du nom latin d'un composé du sodium appelé natrium, qui lui-même vient du grec νίτρον (nitron), un carbonate de sodium naturel (le natron). En allemand, comme en danois ou en néerlandais, sodium se dit natrium.
Isotopes
Le sodium possède 22 isotopes connus, avec un nombre de masse variant entre 18 et 37. Seul le sodium 23 (Na) est stable, ce qui fait du sodium un élément monoisotopique. À part Na et Na, isotopes radioactifs cosmogéniques avec une demi-vie de respectivement 2,605 ans et environ 15 heures, les radioisotopes du sodium ont tous une demi-vie inférieure à une minute, voire une seconde pour la majorité d'entre eux. En pratique, seul Na est trouvé dans la nature et le sodium est donc considéré comme un élément mononucléidique.
Caractéristiques notables
Caractéristiques chimiques
.jpg)
Sodium métallique.
Raies spectrales.
Comme les autres métaux alcalins, le sodium a un aspect doux, blanc argenté, légèrement rosé. C'est un élément très réactif ; en particulier il s'oxyde lentement à l'air humide et réagit violemment avec l'eau : il libère une grande quantité d'hydrogène et produit une explosion, ce qui force à le conserver dans le pétrole ou sous une atmosphère inerte d'azote ou d'argon. Le sodium est léger, flotte sur l'eau et la décompose en libérant du dihydrogène et en formant de la soude (hydroxyde de sodium) :
Na + H2O → Na + OH + H2
La chaleur dégagée par la réaction exothermique de décomposition de l'eau suffit généralement, en présence d'oxygène, à faire détoner l'hydrogène produit.
Sa température de fusion relativement basse, aux alentours de 97,81 °C, le rend facile à manipuler, stocker et transporter (en citernes par exemple, dans lesquelles on le solidifie pour le refondre à l'arrivée), à condition d'être très vigilant à bien le laisser toujours sous atmosphère inerte et à l'abri de l'eau ou de l'humidité, en raison de sa grande réactivité.
Ce métal ne brûle dans l'air qu'à des températures supérieures à 388 K (soit 115 °C).
Le spectre du sodium possède la particularité de présenter un doublet spectral très brillant dans le jaune. Ces deux raies, localisées à 589,00 et 589,59 nm sont généralement notées D1 et D2. Leur interférence est responsable d'un phénomène de battement en intensité.
À mesure que la pression augmente, le sodium devient isolant et prend l’aspect d’un matériau noir, puis celui d’un matériau translucide rouge avant de finalement devenir transparent sous une pression de 200 gigapascal.
Caractéristiques physiques
C'est un excellent conducteur électrique.
Le sodium est utilisé comme fluide caloporteur (réfrigérant) à haute température, seul, ou fréquemment allié au potassium. Le mélange NaK abaisse la température de fusion en deçà de 0 °C, facilitant ainsi l'exploitation de la boucle fluide. L'alliage de 78 % K potassium et 22 % Na est liquide jusqu'à −12,6 °C et bout à 785 °C.
Coefficient de dilatation à 25 °C = 70×10 °C.
Formule pour la masse volumique du solide : ρ = 971 / (1+0,00007*(t-20)) ; avec ρ en kg/m et t en °C.
Corrélation pour la masse volumique du liquide : ρ = 949 - 0,223 × t - 0,0000175 × t ; avec ρ en kg/m et t en °C ; applicable entre 100 et 800 °C.
Corrélation pour la valeur de Cp du solide : Cp = 1,02954 + 0,00059184 × t + 0,00000010528 × t ; avec Cp en kJ/(kg⋅K) et t en °C ; applicable entre 0 et 90 °C.
Corrélation pour la valeur de Cp du liquide : Cp = 1,62957 - 0,000832987 × T + 0,000000462265 × T ; avec Cp en kJ/(kg⋅K) et T en K ; applicable entre 100 et 800 °C.
Corrélation pour la viscosité dynamique du liquide : μ = -3,759×10 × t + 6,3008×10 × t - 3,729×10 × t + 9,9806×10 ; avec μ en kg/(m⋅s) et t en °C ; applicable entre 100 et 700 °C.
Corrélation pour la conductivité thermique du liquide : λ = (2,442544 × (t + 273,15)) / (6,8393 + 0,033873 × t + 0,000017235 × t) ; avec λ en W/(m⋅K) et t en °C ; applicable entre 100 et 700 °C.
Corrélation pour la pression de vapeur saturante : Ps = 4,216×10 × (t + 273,15) × exp[-13 308,94 / (t + 273,15)] ; avec Ps en Pa et t en °C ; applicable entre 100 et 800 °C.
Quelques caractéristiques thermodynamiques du sodium
Température
(°C) |
Masse
volumique
ρ
(kg/m) |
Viscosité
dynamique
μ
(10 kg/(m⋅s) |
Conductivité
thermique
λ
(W/(m⋅K)) |
Capacité
calorifique
à pression
constante
Cp
(kJ/(kg⋅K) |
Commentaire |
| −173,15 |
1 011,5 |
|
|
0,9791 |
solide |
| 0 |
975,1 |
|
141,0
(142,0) |
1,0295 |
solide |
| 20 |
971 |
|
142 |
1,0414 |
solide |
| 25 |
970,0 |
|
|
1,2259
(1,0444) |
solide |
| 97,80 |
955,3
(solide)
927,0
(liquide) |
0,690
(0,705) |
83,7 |
1,5525 |
liquéfaction |
| 200 |
903,7 |
0,450 |
81,5
(80,8) |
1,4815 |
liquide |
| 300 |
880,5 |
0,340
(0,345) |
75,7
(75,5) |
1,4213 |
liquide |
| 400 |
857,0 |
0,278
(0,284) |
71,2
(71,0) |
1,3704 |
liquide |
| 500 |
831,1 |
0,234
(0,239) |
66,8
(67,2) |
1,3704 |
liquide |
| 600 |
808,9 |
0,212
(0,210) |
63,9 |
1,2962 |
liquide |
| 700 |
784,3 |
0,186
(0,193) |
61,0 |
1,2730 |
liquide |
| 800 |
759,4 |
0,179
(0,165) |
58,3 |
1,2590 |
liquide |
| 883 |
|
|
|
|
ébullition |
|
Utilisations du sodium
Le sodium sous sa forme métallique est utilisé dans la fabrication des esters ainsi que dans celle d'autres composés organiques, utilisés en particulier dans l'industrie pharmaceutique, les cosmétiques, les pesticides, etc.
Il a été longtemps utilisé, sous forme d'alliage avec le plomb, pour la production de plomb tétraéthyle, additif antidétonant pour le carburant automobile.
Autres utilisations du sodium métal :
pour la synthèse de l'indigo artificiel, du borohydrure de sodium, dans la réduction de Birch
dans certains alliages, pour améliorer leur structure ;
pour purifier les métaux fondus ;
pour la fabrication des lampes à vapeur de sodium ;
pour la fabrication du silicium utilisé dans l'électronique ou les panneaux solaires ;
pour les batteries sodium - soufre ;
le sodium sous forme liquide constitue un fluide caloporteur efficace (assurant le transfert de chaleur): on l'utilise dans ce but principalement dans les soupapes (creuses) de moteurs poussés, mais il sert également dans les réacteurs nucléaires à neutrons rapides, avec le risque de feux de sodiums particulièrement difficiles à éteindre, étudié à Cadarache par le CEA, y compris pour le démantèlement de Superphénix, entamé en 1998 et dans la perspective d'une éventuelle mise en œuvre du projet de prototype de réacteur à neutrons rapides « Astrid ». Le sodium est peu capturant aux neutrons thermiques (0,4 barn de section efficace) et a fortiori aux neutrons rapides, cependant un peu de sodium 24 est formé dans le cours du fonctionnement qui gène l'approche des circuits dans la semaine suivant l'arrêt. Le sodium 24 est émetteur bêta et gamma de 4 MeV de période 15 h en donnant du magnésium 24 stable.
Le NaK est un alliage de sodium et de potassium, c'est un matériau important pour les transferts thermiques.
Le sodium est utilisé sous forme de vapeur alcaline dans les lampes à vapeur de sodium. Cette vapeur est très réactive : par exemple, à 1 400 °C, elle réagit avec l'alumine en formant de l'aluminate.
Le sodium liquide est un produit dangereux mais qui intéresse l'industrie nucléaire ; les technologies de maîtrise de ce sodium font l'objet d'un travail continu au sein d'un réseau dit « école internationale du sodium et des métaux liquides », qui a accueilli, depuis sa création en 1975, plus de 4000 stagiaires ; « L’essentiel des recherches s’applique au fonctionnement d’un générateur de vapeur chauffé directement par une circulation de sodium, et vise au contrôle du risque de contact entre le sodium et l’eau. Mais des expériences concernent aussi l’hypothèse d’un générateur de vapeur alimenté par un circuit tertiaire au gaz, avec un circuit secondaire au sodium » ; Des travaux visent à mieux neutraliser la vapeur de sodium (qui peut boucher certains filtres), à mieux neutraliser le sodium en cas d'accident ou incident ou lors des vidanges ou démantèlement d'installations (le procédé actuel, procédé NOAH, produit de l'hydrogène et de la soude, deux produits dangereux), ainsi qu'à mieux utiliser l'acoustique pour détecter des débuts d’ébullition ou un état d’engazement du sodium, les ultrasons pour la mesure du débit et de la température du sodium fondu, et la chimie pour la mesure de la teneur en oxygène, les courants de Foucault pour le repérage de défauts dans les installations, la télémétrie, pour la mesure des distances ainsi que des capteurs pouvant être plus ou moins durablement immergés dans le sodium liquide. Un procédé de « carbonatation » permet par contact avec de la soude sous exposition d'un flux de gaz carbonique de nettoyer des parois contaminées, en produisant des carbonates de sodium, inertes et solubles mais ce procédé est lent (moins d'un millimètre/jour).
Fabrication
Le sodium sous forme métallique est fabriqué par électrolyse du chlorure de sodium fondu. Le chlorure de sodium fondant vers 800 °C, il est nécessaire pour des raisons technologiques de l'utiliser en mélange avec du chlorure de calcium et du chlorure de baryum. Ce mélange permet de travailler à environ 600 °C. Les principaux producteurs de sodium sous forme métallique dans le monde sont :
MSSA - Métaux spéciaux en France à Pomblière-Saint-Marcel près de Moûtiers en Savoie ;
DuPont aux États-Unis à Niagara Falls ;
différents producteurs sont apparus récemment en Chine en Mongolie Intérieure, dans le Ningxia et le Henan.
Il est aussi possible d'obtenir du sodium métallique par électrolyse d'hydroxyde de sodium, NaOH, fondu c'est-à-dire vers 300 °C. Toutefois, comme il est plus difficile de récupérer le métal pur dans ce cas, l'industrie préfère l'électrolyse de NaCl.
Il est possible, et utilisé de manière artisanale aussi, d'utiliser une oxydo-réduction du mélange de magnésium et soude cristalline, le tout chauffé.
Composés du sodium
Les composés chimiques dans lesquels on trouve un ion sodium Na+ sont extrêmement nombreux. Parmi les plus simples on peut citer :
le sel marin ou sel de table, qui est du chlorure de sodium (NaCl) ;
la soude (Na + OH) ou l'hydroxyde de sodium (NaOH) ;
l'eau de Javel, qui contient du chlorure de sodium et de l'hypochlorite de sodium (NaClO).
Le chlorure de sodium est indispensable à la vie, par exemple à la transmission de l'influx nerveux, faisant intervenir des échanges intermembranaires d'ions Na.
On trouve également des composés du sodium :
dans le savon (en combinaison avec des acides gras) ;
dans les chaufferettes sous forme d'acétate de sodium.
Impacts environnementaux
Quand il provient du sel, NaCl, massivement utilisé pour le salage des routes (près de la moitié de la consommation mondiale de sel), ou de remontées de sel suite à un drainage ou à des arrosages excessifs, il contribue à la destruction et salinisation des sols et à l'intoxication de nombreuses espèces animales, végétales, fongiques et microbiennes. Il existe néanmoins des bactéries extrêmophiles qui peuvent survivre dans des milieux hypersalés.
Impacts sanitaires
L'ion sodium est l'un des éléments indispensables à l'organisme, mais, lorsque présent en excès (généralement à cause d'un régime trop riche en sel), c'est un facteur d'hypertension et de dégradation de la fonction rénale (au niveau des tubules). Dans le sang d'un adulte de poids moyen à jeun, il doit être compris entre 136 et 145 mEq/L.
Commerce
En 2014, la France est nette importatrice de sodium, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 2 000 €.

 词典释义:
词典释义:
 (第11号元素)
(第11号元素) [第 11号元素, 符号Na]
[第 11号元素, 符号Na]
 明矾
明矾 直闪石
直闪石 石
石 铀矿
铀矿 环晶沸石
环晶沸石 铝直闪石
铝直闪石
 砷铀云母
砷铀云母 铀矾
铀矾
 用
用
 矾
矾
 ; 重碳酸
; 重碳酸 ; 重碳酸氢
; 重碳酸氢
 酪蛋白
酪蛋白
 测定
测定
 二酸
二酸

 酸
酸
 锆
锆
 酸[盐、酯]
酸[盐、酯]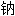
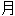
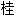 酸[盐、酯]
酸[盐、酯]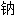 溶液
溶液
 冷反应堆
冷反应堆 水反应
水反应 皂
皂 (食盐)
(食盐)
 溶液
溶液
 含量
含量
 泵
泵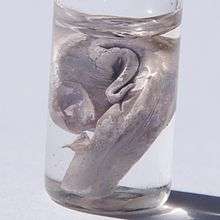
.jpg)
.jpg)