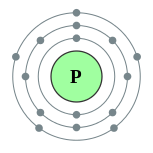
Le phosphore est l'élément chimique de numéro atomique 15, de symbole P. C'est un membre du groupe des pnictogènes.
Le phosphore se présente sous plusieurs formes de couleurs différentes : blanc-jaune, rouge et violet-noir.
Très pur, le phosphore « blanc » est transparent ; plus généralement il est blanc ambré, légèrement malléable avec une faible odeur d'ail. Les formes rouge et noire peuvent se présenter en poudre ou cristallisées.
Le nom dérive du mot grec phosphoros, ce qui signifie « porteur de lumière » et évoque la planète Vénus, l'étoile du berger. Cette origine a été attribuée au fait que le phosphore blanc émet de la lumière visible dans l'obscurité quand il est exposé à l'air (chimiluminescence).
En raison du fait qu'il est indispensable à la vie et d'une consommation mondiale qui pourrait dépasser les ressources disponibles avant une centaine d'années, l'ONU et divers scientifiques le classent comme matière première minérale critique qu'il faudrait apprendre à économiser et mieux recycler.
Histoire
Éléments connus lors de la découverte du phosphore Élément C S Cu Au Ag Fe Sn Sb Hg Pb As Zn Bi Date ? ? -5000 -3000 -3000 -2500 -2100 -1600 -1500 -1000 1250 1500 1500

Phosphore en poudre dans l'obscurité.
Lors de sa découverte, nous ne connaissons que 13 éléments (voir tableau) des 118 éléments connus à ce jour (cf. Tableau periodique). Comme tous les éléments, il ne fut reconnu comme tel que grâce aux travaux de Lavoisier.
Ses différents découvreurs lui donnèrent beaucoup de noms différents : Phosphorus fulgurans ou Lumen conflans (Kunckel), Noctiluca aërea (Boyle), Lumiere condensée ou encore Phosphorus igneus puis Phosphorus pyropus par Leibnitz. Tous ses noms sont en rapport avec la forte lumière que celui-ci produit lors de sa combustion à l’air libre.
Une triple découverte
La découverte de cet élément est attribuée à l'alchimiste allemand Hennig Brandt en 1669 à partir de l'urine. Le procédé resta longtemps secret, mais malgré tout, le chimiste allemand Jean Kunckel, puis le physicien anglais Robert Boyle réussirent peu de temps plus tard à trouver leur propre voie de synthèse.
Au cours de ses recherches de la pierre philosophale, c'est-à-dire l'art de convertir les métaux vils ou imparfaits en or et en argent, Brandt s'était imaginé qu'en ajoutant de l'extrait d'urine aux métaux dont il voulait opérer la transmutation, il réussirait plus sûrement dans son entreprise. Mais au lieu d'obtenir ce qu'il cherchait avec tant d'ardeur, il obtint un corps nouveau, blanc, lumineux par lui-même et brûlant avec une énergie sans exemple : le phosphore.
Surpris de l'apparition de ce corps, il en envoya un échantillon à Kunkel, chimiste allemand, qui s'empressa de le montrer à son ami Kraft de Dresde (de). Celui-ci le trouva si merveilleux qu'il se rendit immédiatement à Hambourg dans l'intention d'acheter le secret de sa préparation. Il l'obtint moyennant deux cents Rischedales(monnaie allemande) et son silence. Mais Kunkel désirait lui aussi vivement le connaître, et voyant que Kraft, malgré leur amitié, le lui confierait pas, il se résolut à le découvrir par la voie de l'expérience. Il y parvint en 1674, après beaucoup de tentatives infructueuses et devint ainsi le deuxième découvreur du phosphore, et se ventait dans le 44e chapitre de son Laboratoire chimique de savoir en synthétiser un plus pur que son ami.
La troisième personne à découvrir une méthode de par lui-même n'est autre que le chevalier Boyle. En 1679, il avait pu voir un morceau de phosphore apporté par Kunkel pour le montrer au roi et à la reine d'Angleterre et réussir à savoir que le phosphore était une substance tirée du corps humain. Ses essais portèrent leurs fruits en 1680.
Découverte publique
Cependant la préparation du phosphore demeura cachée jusqu'en 1737 alors qu'un apothicaire londonien (Godfrey Hankwitz), d'après la recette de (Boyle) en produisait pour toute l'Europe, sous le nom de « Phosphore d'Angleterre ».
Hellot dans les Mémoires de l'Académie pour l'année 1737 fait la première description publique détaillée d'une méthode de synthèse du phosphore à partir de l'Urine. Il explique le 13 novembre 1737 comment un étranger divulgua pour la première fois tout le mystère du procédé qui jusqu'ici était jalousement gardé par ses premiers inventeurs. Celui-ci l'exécuta en présence de quatre commissaires nommés par l'Académie des Sciences, Duhamel, Dufay, Geoffroy et, lui-même. La recette était enfin devenue publique. Dans la même année, Rouelle la répéta dans ses Cours de Chimie. Tout le monde y a accès depuis ce temps (lire ). Cette préparation consiste à faire évaporer à siccité l'urine putréfiée, et à chauffer ensuite fortement le résidu dans une cornue de grès dont le col, par une allonge, plongeait dans l'eau. Il était ensuite moulé en cylindres et stocké dans de l'eau préalablement bouillie et à l'abri de la lumière.
Même si Margrall ajouta quelques années après un sel de plomb (nitrate de plomb) à l'urine épaissie par évaporation, c'est ainsi que, pendant longtemps, le phosphore fut préparé. Le phosphore resta encore longtemps une curiosité, et un des objet les plus précieux que l'on pouvait voir. On ne le trouvait que dans les laboratoires des principaux chimistes, et les cabinets de quelques gens riches, amateurs de nouveautés.
Démocratisation
Os de mouton
En 1769, le suédois Johan Gottlieb Gahn découvrit que le phosphore était présent dans la poudre d'os calcinée puis décomposée par l'acide sulfurique. Peu de temps après, il publia, avec Scheele, un procédé qui lui permit de s'en procurer des quantités assez considérables à partir d'os de bœufs ou de moutons.
Ce nouveau protocole consiste à faire brûler les os jusqu’à ce qu’ils soient friable, puis mélangés avec du Carbonate de calcium (CaCO3) et d’autres sels. On ajoute ensuite l’Acide sulfurique. Puis après réaction et lavages, on le sèche avec du charbon, avant de faire chauffer le tout dans une cornue remplie d’eau.
On note que combiné à l'hydrogène, il produit un gaz inflammable. Cela peut expliquer les feux-follets causés par la décomposition de matières riches en phosphore dans les marais. On comprend aussi que c'est sa présence qui fait luire dans le noir certaines matières organiques telles que la laitance et les œufs de poissons, la chair de certains mollusques (huitres), certains squelettes frais de poissons, la substance cérébrale ou le foie de certains animaux. On lui attribue aussi (à tort parfois) la phosphorescence de certains organismes marins et « des eaux mêmes de la mer, dans quelques cas au moins ».
Troisième mode de synthèse
Site d'extraction de roches phosphorées sur l'ile de Nauru (2007)
La méthode de synthèse actuelle a été mise au point en 1867 par les chimistes E. Aubertin et L. Boblique. Elle permet d’extraire le phosphore de roches phosphorées. Cela permet de se procurer du phosphore en plus grande quantité et à un meilleur prix.
Le protocole consiste aujourd’hui Greenwood p479 à chauffer les roches entre 1400-1500°C avec du sable et du petrole. Il se forme alors le phosphore blanc (P4) selon la réaction :
2Ca3(PO4)2+6SiO2+10C → 6CaSiO3+10CO+P4
Le procédé initial a été amélioré par J.B. Readman en 1888 en ajoutant l’utilisation d’un four électrique. Malgré un rendement de près de 90%, la formation d’une tonne de phosphore blanc par cette méthode requiert tout de même 15 MWh environ.
Travaux importants
Grands noms
Allumette
Le phosphore étant devenu plus commun, les chimistes purent plus facilement en étudier les propriétés. Les travaux les plus remarquables qui aient été faits sur ce corps sont dus à :
Pelletier, qui l'a combiné avec le soufre et beaucoup de métaux ;
Lavoisier, qui nous a fait connaître ses combinaisons avec l'oxygène ;
M. Dulong et à M. Davy, qui ont étudié ses divers acides ;
M. Berzelius, qui a étudié non seulement ceux-ci, mais encore leurs combinaisons avec les bases.
Première utilisation : l'allumette
Les premières allumettes (fósforo en espagnol) utilisaient du phosphore blanc dans leur composition, la toxicité du phosphore les rendait d'ailleurs assez dangereuses : leur usage entraîna des meurtres, des suicides et des empoisonnements accidentels.
De plus, l'inhalation des vapeurs de phosphore entraînait, chez les ouvriers des fabriques d'allumettes, une nécrose des os de la mâchoire, connue sous le nom de nécrose phosphorée.
Lorsque le « phosphore rouge » fut découvert, son inflammabilité et sa toxicité plus faibles poussèrent à son adoption comme une alternative moins dangereuse pour la fabrication des allumettes.
Propriétés
Les phosphores blancs et rouges ont une structure quadratique.
Il existe un « phosphore noir » allotrope, ayant une structure similaire à celle du graphite : les atomes sont arrangés en couches hexagonales, et il est conducteur électrique.
Le phosphore blanc est constitué de molécules tétraédriques P4. C'est un corps toxique qui s'oxyde lentement à l'air à température ambiante. On le conserve toujours sous l'eau. Le phosphore blanc se transforme en phosphore rouge sous l'influence de la lumière.
Le phosphore rouge est constitué de molécules de longueur indéterminée, mais très grande. On peut lui donner à titre d'exemple la formule P2 000. Il n'est ni toxique ni facilement inflammable. Le phosphore rouge se transforme en phosphore blanc (gazeux) sous l'influence de la chaleur, soit 280 °C.
Gisements
Les phosphates sont des minéraux assez fréquents en quantité faible et dispersée, dont la concentration a généralement une origine animale (guano d'oiseaux ou de chauve-souris accumulés durant des milliers ou millions d'années sur des sites dortoirs ou de reproduction).
Le phosphore provient de roche phosphatée transformée chimiquement. Entre 120 et 170 millions de tonnes de roches sont extraites chaque année depuis les trente dernières années, correspondant à 20 à 30 millions de tonnes de phosphore purifié par an.
Les roches phosphatées exploitables se concentrent cependant en peu d'endroits : Maroc (plus du tiers des réserves mondiales), Chine (un peu plus du quart des réserves mondiales), Afrique du Sud, États-Unis. De plus ces réserves pourraient être épuisées avant un siècle. Les ressources prouvées sont de 71 milliards de tonnes en 2012 selon l'USGS et la production annuelle est d'environ 191 millions de tonnes extraites en 2011.
Aliments à forte teneur en phosphore
Sodas (ceux riches en acide phosphorique ont environ 20 mg de phosphore dans 100 ml.)
Bacon, cervelle d'agneau, foie de veau
Fromages à pâte dure : parmesan, emmental, comté, gruyère, gouda, édam, morbier, cantal
Poudre de lait entier
Sardine, saumon, morue, carpe, seiche
Datte
Noix de cajou, noix du Brésil, pignon, pistache
Germe de soja, contient environ 700 mg de phosphore dans 100 g
Son de blé, avoine, millet
Selon une idée reçue, le poisson serait bon pour la mémoire car il contiendrait beaucoup de phosphore. Cette idée reçue est fausse.
Dans l'organisme humain, le phosphore est présent dans les cellules où il sert de support à l'énergie (adénosine triphosphate).
Un excès de phosphore alimentaire déclenche une hyperphosphatémie appelée aussi l'hyperphosphorémie temporaire qui inhibe la synthèse de vitamine D.
Utilisation
Phosphore
Allumettes et pyrotechnie : le phosphore sous sa forme rouge est l'élément igniteur des allumettes et d'un grand nombre de dispositifs pyrotechniques.
Alliage : involontaire dans l'acier, car étant présent dans les minerais de fer, il provoque un effondrement des caractéristiques mécaniques, en particulier de la résilience à basse température, et parfois un alliage volontaire est réalisé avec le bronze, où il permet une usinabilité améliorée. Par contre les pièces en bronze phosphoreux soudées ou brasées donnent une très mauvaise tenue mécanique.
Phosphate
De loin, les utilisations les plus répandues du phosphore sont :
engrais minéraux : élément essentiel entrant dans la composition des engrais minéraux (NPK), sous forme monohydrogénophosphate CaHPO4 ou dihydrogénophosphate Ca(H2PO4)2. Cette utilisation du phosphore représenterait à elle seule 80% de l'utilisation totale ;
pâte dentifrice : agent polisseur sous forme de dihydrogénophosphate et comme apporteur de fluor Na2PO3F ;
additif stabilisant (E339, E340) : des phosphates de sodium ou de potassium, substances « tampons » ont un effet stabilisateur dans des compositions alimentaires ;
par les êtres vivants : le phosphore entre dans la composition de l’ATP et de l’ADP, de certains lipides tels que les lécithines, et est un constituant des molécules d'ADN.
Acide phosphorique : H3PO4
L'acide phosphorique a de nombreuses applications :
détartrants : on utilise une solution d'acide phosphorique comme détartrant pour les appareils sanitaires et ménagers, tels les cafetières électriques ;
additif alimentaire (E338) : agent acidifiant dans les boissons gazeuses ;
nutriment : dans le traitement des eaux, le phosphore est ajouté à un réacteur biologique pour assurer la survie et la croissance des bactéries ;
protection contre la corrosion des aciers par trempage des pièces dans cet acide (opération dite de phosphatation). Il en résulte une pellicule noire, fine, stable et poreuse qui est une excellente base dans l'accrochage des peintures anti-rouille.
Usages militaires
Les bombes, obus et grenades incendiaires au phosphore ont été largement utilisées pendant et depuis la Seconde Guerre mondiale, par exemple lors du bombardement de Dresde.
Le protocole III de la Convention sur certaines armes classiques (CCAC), entré en vigueur en 1983, interdit les armes incendiaires contre des civils, et même contre des bases militaires situées « à l’intérieur d’une concentration de civils ».
L'armée américaine aurait cependant utilisé du phosphore blanc lors de l'attaque contre Falloujah, le 8 mars 2004. Cependant, le Département de la Défense des États-Unis se défend de s'être servi de Willie Pete pour des usages incendiaires. Si les États-Unis sont signataires de ce protocole additionnel aux Conventions de Genève, ils n'ont par contre pas signé le protocole III de la convention de 1983 régissant l'usage des armes conventionnelles, dont Willie Pete - le phosphore blanc peut aussi bien être utilisé comme éclairage que comme arme incendiaire et chimique. Mais, en raison de cette ambiguïté, il reste classé dans les armes conventionnelles.
Explosion d'un obus au phosphore (Première Guerre mondiale). L'USS Alabama (BB-8) touché par une bombe incendiaire au phosphore, septembre 1921.
Dosage
Un protocole de dosage a été validé en France par l'AFNOR.
Écologie et phosphore
Le cycle naturel du phosphore. Le phosphore tend à être lessivé vers les mers sous l'action du lessivage par les pluies, du haut du bassin versant vers la mer. L'érosion éolienne peut transporter des quantités significatives de phosphore vers des zones très éloignées (dont du Sahara jusqu'en Amazonie, via des aérosols visibles de satellite). Autrefois, c'étaient surtout les migrations d'oiseaux marins ou piscivores (via leurs fientes enrichies en phosphore) et plus encore les migrations de saumons qui constituaient le mécanisme principal de « retour à la terre » du phosphore. Après leur phase de croissance en mer et leur remontée, en mourant par dizaines de millions dans les rivières des hauts de bassin versant après y avoir pondu, les saumons remontaient et libéraient des quantités importantes de phosphore recyclées dans les écosystèmes situés en amont des bassins versants, via leurs squelettes et cadavres particulièrement riches en phosphore, et via les urines et excréments des animaux qui chassaient ou pêchaient les saumons lors de leur remontée (ours en particulier). Aujourd'hui les saumons ont fortement régressé ou ont disparu sur une grande partie de leur ancienne aire de répartition, et l'agriculture intensive se fournit en phosphates de guano ou de synthèse, importés.
Toxicologie, écotoxicologie
Le phosphore est un oligoélément indispensable - sous forme de sels - pour de nombreux organismes vivants, et sous forme de phosphate notamment pour les plantes. Sous formes solubles et solubilisées notamment, le phosphore a servi de médicament (extrait de l'urine humaine jusqu'en 1774). Mais quand il est pur, et sous certaines de ses formes, c'est un puisant toxique et corrosif de l'organisme. On le sait depuis longtemps. Il a néanmoins été utilisé dans des expériences de « physique amusante » ou de magie en causant des blessures parfois sérieuses chez les expérimentateurs ; Puis certains médecins lui ont attribué des vertus médicales merveilleuses, notamment administré sous forme de « Pilules lumineuses » contenant une poudre de phosphore finement divisée associée à d'autres ingrédients, dont Kunckel semble avoir eu l'idée ; il était réputé prolonger la vieillesse, revigorer l'organisme, « rallumer, pour ainsi dire le flambeau de la vie ». On l'a prétendu fébrifuge, anti-rhumatismal, anti-goutteux, anti-chlorolique, et semble-t-il parfois efficace contre des « fièvres intermittentes », certaines « fièvres graves », « malignes », « fièvres asthéniques », « fièvre pétéchiale » ou « bilieuses », etc., mais sa toxicité a rapidement été manifeste chez l'Homme (1/8ème de grain suffit parfois à déterminer des « accidents funestes » (Observation de M Loebelstein-Loebel, d'Iéna. On se demanda ensuite si ces effets médicaux sont vraiment dus au phosphore, où à ses sels, ou aux synergies avec d'autres ingrédients ; Ainsi en 1798, la société de médecine de Paris questionne « les propriétés médicamenteuses du phosphore, des acides phosphoriques et phosphoreux » (question restée sans réponse). […] « Du système nerveux dont il exalte d'abord la sensibilité, il parait répandre son action sur les principaux systèmes de l'économie, accélérer ainsi la circulation, augmenter la chaleur, accroître au plus haut degré l'irritabilité musculaire, d'après les expériences de Fr. Pilger (Ann. clin, de Montp., XXXVII, 360); enfin agir souvent aussi sur les exhalants cutanés, la sécrétion urinaire, dont le produit devient quelquefois phosphorescent, peut exhaler l'odeur du soufre ou de la violette, enfin et surtout, exciter puissamment l'appareil génital. Ce dernier phénomène, qui peut aller jusqu'au priapisme, est le plus constant et le plus remarquable de ses effets physiologiques : A. Leroy et M. le docteur Bouttatz l'ont eux-mêmes éprouvé ; M. Boudet (Il l’avait observé chez un vieillard ; B. Pelletier l'avait vu chez les canards, dont le mâle n'a cessé qu'à la mort de couvrir ses femelles) nous assure que le contact prolongé de la peau avec le phosphore suffit pour le faire naître : aussi a-t-on cru pouvoir rapporter à la présence du phosphore dans les poissons la vertu aphrodisiaque qu'on leur attribue ».
F.V. Mérat et A.J. de Lens, dans leur Dictionnaire universel de matière médicale et de thérapeutique (volume 3 rappellent qu'après que le phosphore ait été découvert dans l'urine, puis utilisé comme médicament, sa toxicité a été largement observée chez l'Homme et confirmée expérimentalement chez l'animal par M. Lœbelstein-Lœbel sur des chiens, M. Bouttatz sur des chats, des cochons d'Inde, des poules et des pigeons, des jeunes coqs et des grenouilles, enfin MM. Orfila, Brera, Mugetti, Worbe et Bogros sur des chiens, prouvent, la plupart, que le phosphore agit à la manière des poisons corrosifs ; que les accidents une fois développés ne peuvent que difficilement être entravés par les secours de l'art. (...)Dissous ou divisé dans l'huile, et aussi à l'état de fusion dans l'eau chaude (M. Worbe), la combustion, qui en est rapide produit, semble-t-il, de l'acide phosphorique ; l'inflammation est alors des plus vives, les douleurs atroces, les vomissements opiniâtres, et la mort arrive au milieu des mouvements convulsifs les plus horribles. Injectée dans les veines ou dans la plèvre, cette même huile phosphorée donne lieu, dans l'espace de quelques minutes, à des flots de vapeurs blanches chargées d'acide phosphatique, qui à chaque expiration s'échappent de la gueule de l'animal (Magendie, Além. pour servira Phi* t. de la transpiration pulmonaire; Bibl. méd., XXXII, 19) : la mort dans ce cas a lieu par asphyxie et résulte de l'inflammation subite des poumons.
Son usage s'est ensuite fortement réduit, mais il a été utilisé dans les armes chimiques et munitions incendiaires, et son isotope radioactif a été utilisé comme « radiotraceur », dans des éléments solides (métal ou alliage par exemple) ou chez des espèces vivantes (pour le suivi de la pollinisation par exemple, via des pollens marqués au soufre ou au phosphore radioactif, pour le suivi de microbes ou virus dans l'organisme) ou encore pour le suivi de mouches afin d'étudier leurs rôle épidémiologique (1957). On a aussi tenté de l'utiliser comme médicament dans les années 1950, aux débuts de la médecine nucléaire, par exemple contre la leucose chronique (1955) ou pour traiter des tissus calcifiés (1958) ou pour détecter des néoplasmes intraoculaires, comprendre ou traiter des cancers, ou pour l'étude de certaines maladies (ex. : maladie de Vaquez (1967) ou de cancers (1946)).
Mutagénicité : un autre problème environnemental est posé par la radioactivité de certains isotopes du phosphore.
Les terrils ou crassiers de phosphogypse découlant de la production industrielle d'engrais contiennent des éléments radioactifs, et que les engrais phosphatés sont aussi une source de cadmium toxique qui s'accumule dans les champs ou pollue l'environnement.
L'isotope radioactif stable du phosphate est sous certaines formes (phosphates) très bioassimilable (il est notamment incorporé dans l'adénosine triphosphate) ; il est mutagène.
Le phosphore en excès a aussi des effets écotoxiques en tant qu'eutrophisant (voir ci-dessous)
Eutrophisation
Le phosphore, abondamment gaspillé par l'Agriculture intensive et certaines unités de traitements des eaux usées, et fortement présent dans les lessives notamment dans les années 1980 est avec le nitrate un des grands responsables de l'eutrophisation.
En France, depuis les années 1970, l'amélioration des pratiques culturales a permis de réduire significativement les apports en engrais minéraux phosphatés par unité de surface. Malgré cela, les teneurs en phosphore des sols agricoles augmentent globalement, bien que de manière inégale selon les régions : augmentation en Bretagne, Pays de la Loire, Champagne-Ardenne et Aquitaine, et diminution au nord, au centre et à l'ouest. En Bretagne, par exemple, cette hausse est causée par l'emploi des effluents issus de l'élevage intensif pour la fertilisation des sols.
Son mécanisme entrophisant est complexe. Il varie selon les environnements et diffère de celui des nitrates. Selon une étude faite dans de vrais lacs et dans des lacs expérimentaux, la charge du milieu en phosphore n'est un bon prédicteur de l'eutrophisation que si l'on introduit un facteur de correction tenant bien compte du renouvellement de l'eau, alors que la correction selon le sédiment a un rôle mineur.
Une future pénurie
Vingt-six éléments du tableau de Mendeleïev seraient en voie de raréfaction, comme le cuivre, l'or, le zinc le platine, l'uranium, le phosphore…. « Sans phosphore, pas de vie sur Terre ! »
« Il suffit de penser que cet élément forme la structure même de l'ADN, qu'il pilote la respiration - ainsi que la photosynthèse chez les plantes - ou encore le métabolisme cellulaire. C'est pourquoi chaque être humain en réclame à peu près deux grammes par jour. […] Au vu de la consommation actuelle couplée à l'épuisement des gisements de qualité à travers le monde, les chercheurs de l'Institute for sustainable futures (Australie) annoncent un pic de production du phosphore au milieu des années 2030, et estiment les réserves à 340 ans. Cette prévision, quoique controversée, suscite néanmoins une vive angoisse : pourra-t-on extraire assez de phosphore pour nourrir les 9 milliards d'habitants prévus en 2050 ? De plus, avertit Jean-Claude Fardeau, de l'Institut national de la recherche agronomique, il n'y a aucun substitut possible au phosphore, véritable facteur limitant du vivant. Indispensable à l'homme et surtout à l'agriculture, ignorer ce problème [celui d'une future pénurie en phosphore] pourrait mettre en péril la sécurité alimentaire mondiale conclut Andrea Ulrich, de l'Institute for Environment Decisions (École polytechnique fédérale de Zurich). Car, si les ressources s'épuisent, il est bien certain que la demande en phosphore ne disparaîtra jamais… »
Le risque de manque de phosphore est confirmé.
Une tonne de fumier contient de 2 à 3 kg de phosphore (et également 4 à 5 kg d'azote et 5 à 6 kg de potassium). Dans ces conditions, des associations (telles que Zero Waste France) refusent de voir les biodéchets (qui pourraient en outre fournir du biogaz dans le cadre de la méthanisation) finir en décharge ou dans des incinérateurs.
Des solutions existent qui consistent à composter les déchets humains (y compris l'urine), utiliser plus efficacement les fertilisants, et cultiver de telle sorte que le phosphore soit plus facilement accessible aux plantes. En 2009, la Chine produisait 35 % du phosphore mondial, les États-Unis 17 %, et le Maroc (et dans une moindre mesure le Sahara Occidental) 15 %. Les États-Unis ont mis fin à leurs exportations, cependant que la Chine les a fortement réduites.

 词典释义:
词典释义:
 [第15号元素]
[第15号元素] , 黄
, 黄
 , 红
, 红
 (
(
 )弹
)弹 酸盐;
酸盐;
 ; 黄
; 黄

 , 赤
, 赤

 弹
弹 [
[
 ]弹
]弹 铁
铁


 氧四面体
氧四面体