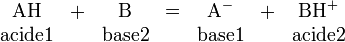L'hydrogène est l'élément chimique de numéro atomique 1, de symbole H. L'hydrogène présent sur Terre est presque entièrement constitué de l'isotope stable H (un proton, zéro neutron), mais comporte environ 0,01 % de H (un neutron), stable également. Un troisième isotope H (deux neutrons), radioactif, est produit dans les explosions nucléaires.
L'hydrogène peut avoir les nombres d'oxydation 0 (dihydrogène H2 ou hydrogène métallique), +I (dans la plupart de ses composés chimiques) et –I (dans les hydrures métalliques). L'hydrogène est un élément électropositif, fréquemment ionisé à l'état H ou H3O. Mais il forme aussi des liaisons covalentes, notamment dans l'eau et la matière organique.
L'hydrogène est le principal constituant du Soleil et de la plupart des étoiles (dont l'énergie provient de la fusion thermonucléaire de cet hydrogène), et de la matière interstellaire ou intergalactique. C'est un composant majeur des planètes géantes, sous forme métallique au cœur de Jupiter et de Saturne, et sous la forme de dihydrogène solide, liquide ou gazeux dans leurs couches plus externes et dans les autres planètes géantes. Sur Terre il est surtout présent à l'état d'eau liquide, solide (glace) ou gazeuse (vapeur d'eau), mais il se trouve aussi sous forme de dihydrogène H2 et de méthane CH4 dans les émanations de certains volcans.
Le nom hydrogène est composé du préfixe « hydro », du grec ὕδωρ (hudôr) signifiant « eau », et du suffixe « gène », du grec γεννᾰν (gennan), « engendrer ». Ce nom a été inventé par Lavoisier pour désigner le gaz appelé à l'époque « air inflammable » et qui avait été mis en évidence par Cavendish en 1766. Il s'agit du gaz de formule chimique H2 dont le nom scientifique est désormais dihydrogène. Dans le langage courant, le dihydrogène est encore couramment appelé « hydrogène ».
Abondance
L'hydrogène est l'élément le plus abondant de l'Univers : 75 % en masse et 92 % en nombre d'atomes. Il est présent en grande quantité dans les étoiles et les planètes gazeuses ; il est également le composant principal des nébuleuses et du gaz interstellaire.
Dans la croûte terrestre, l'hydrogène ne représente que 0,22 % des atomes, loin derrière l'oxygène (47 %) et le silicium (27 %). Il est rare également dans l'atmosphère terrestre, puisque le dihydrogène ne représente en volume que 0,55 ppm des gaz atmosphériques. Sur Terre, la source la plus commune d'hydrogène est l'eau, dont la molécule est constituée de deux atomes d'hydrogène et d'un atome d'oxygène ; l'hydrogène est surtout le principal constituant (en nombre d'atomes) de toute matière vivante, associé au carbone dans tous les composés organiques. Par exemple, l'hydrogène représente 63 % des atomes et 10 % de la masse du corps humain.
Sous de très faibles pressions, comme celles qui existent dans l'espace, l'hydrogène a tendance à exister sous forme d'atomes individuels, simplement parce qu'il est alors improbable qu'ils entrent en collision pour se combiner. Les nuages de dihydrogène sont à la base du processus de la formation des étoiles.
L'atome d'hydrogène
L'hydrogène est l'élément chimique le plus simple ; son isotope le plus commun est constitué seulement d'un proton et d'un électron. L'hydrogène est ainsi le plus léger atome existant. Comme il ne possède qu'un électron, il ne peut former qu'une liaison covalente : c'est un atome univalent.
Cependant, l'hydrogène solide peut être métallique lorsqu'il se trouve sous très haute pression. Il cristallise alors avec une liaison métallique (voir hydrogène métallique). Dans le tableau périodique des éléments, il se trouve dans la colonne des métaux alcalins. N'étant toutefois pas présent dans cet état sur Terre, il n'est pas considéré comme un métal en chimie.
La section efficace de capture de l'hydrogène (200 mb aux neutrons thermiques et 0,04 mb aux neutrons rapides) est suffisamment faible pour permettre l'utilisation de l'eau comme modérateur et réfrigérant des réacteurs nucléaires.
Mécanique quantique
L'atome d'hydrogène est l'atome le plus simple qui existe. C'est donc celui pour lequel la résolution de l'équation de Schrödinger, en mécanique quantique, est la plus simple. L'étude de ce cas est fondamentale, puisqu'il a permis d'expliquer les orbitales atomiques, et ensuite les différentes liaisons chimiques avec la théorie des orbitales moléculaires.
Isotopes et propriétés nucléaires
Isotopes
L’hydrogène est le seul élément dont chaque isotope porte un nom spécifique, car leur différence de masse (comparativement à celle de l'atome d'hydrogène) est significative : du simple au double ou au triple, ce qui explique que, contrairement à ce qui vaut pour les isotopes en général, ces différences peuvent influencer les propriétés chimiques du deutérium ou du tritium par rapport au protium (effet isotopique). L'eau lourde (D2O) est par exemple toxique (à forte dose) pour de nombreuses espèces : en raison de la grande différence de masse entre les isotopes la cinétique des réactions en solution aqueuse « lourde » est considérablement ralentie.
Les isotopes les plus notables de l'hydrogène sont :
l’hydrogène léger ou protium H, le plus abondant (~99,98 % de l'hydrogène naturel). Simplement constitué d'un proton et ne possédant donc pas de neutron, c'est un isotope stable.
le deutérium H (ou D), beaucoup moins abondant (de 0,0082 à 0,0184 % de l'hydrogène naturel, ~0,015 % en moyenne). Constitué d'un proton et d'un neutron, c'est aussi un isotope stable. Sur Terre il est essentiellement présent sous forme d'eau deutérée HDO (eau semi-lourde).
le tritium H (ou T), présent seulement en quantité infime dans l'hydrogène naturel (un atome de tritium pour 10 atomes d’hydrogène). Constitué d’un proton et de deux neutrons, il est radioactif et se transforme en He par émission d'un électron (radioactivité β). H et H peuvent participer à des réactions de fusion nucléaire. La radiotoxicité du tritium est réputée très faible lorsqu'il est présent sous forme HTO (eau tritiée), elle est moins connue et moins bien comprise lorsqu'il est présent sous forme organique (les études présentent des résultats contradictoires ou très variables selon leurs protocoles expérimentaux). Dans l’environnement, le tritium peut prendre la place du protium dans toutes les molécules comprenant de l'hydrogène, y compris dans les molécules biologiques et jusque dans l'ADN où il peut être cause de cassure de l'ADN, de mutations ou d'apoptoses cellulaires. Le tritium étant un isotope rare, sa concentration dans l'eau et les tissus est généralement très faible (hors contaminations accidentelles liées à une source anthropique de tritium).
le quadrium ou tétradium H (ou Q), l'isotope le plus instable de l'hydrogène (sa demi-vie est ultracourte : 1,39×10 seconde). Il se décompose par émission de neutron.
l'hydrogène 7 (H), l'isotope le plus riche en neutrons jamais observé. Sa demi-vie est de l'ordre de 10 seconde.
Fusion nucléaire
L'hydrogène présent en grandes quantités dans le cœur des étoiles est une source d'énergie via les réactions de fusion nucléaire, qui combinent 2 noyaux d'atomes d'hydrogène (2 protons) pour former un noyau d'atome d'hélium. Les deux voies de cette fusion nucléaire naturelle sont la chaîne proton-proton, de Eddington, et le cycle carbone-azote-oxygène catalytique, de Bethe et von Weizsäcker.
La fusion nucléaire réalisée dans les bombes à hydrogène ou bombes H concerne des isotopes intermédiaires de la fusion (de l'hydrogène en hélium) en cours dans les étoiles : isotopes lourds de l'hydrogène, hélium 3, tritium... En effet, dans une bombe H, les réactions nucléaires ne durent que quelques dizaines de nanosecondes, ce qui permet uniquement des réactions en une unique étape. Or, la transformation de l'hydrogène en hélium s'effectue en plusieurs étapes, dont la première (la réaction d'un proton) est extrêmement lente.
Le corps simple hydrogène
Sauf aux pressions extrêmement basses (comme dans l'espace intergalactique) ou extrêmement hautes (comme dans les parties centrales de Jupiter et Saturne), le corps simple hydrogène est formé de molécules H2 (dihydrogène).
Aux pressions les plus basses l'hydrogène est un gaz monoatomique. Aux pressions les plus hautes l'hydrogène devient un métal (liquide ou solide) semblable aux métaux alcalins qui le suivent dans le groupe 1 du tableau de Mendeleïev.
Isomérie
La molécule de dihydrogène existe sous deux isomères de spin nucléaire: l'hydrogène ortho (spins parallèles) et l'hydrogène para (spins antiparallèles).
Hydrogène gazeux
Hydrogène liquide
Hydrogène solide
L'hydrogène solide est obtenu en abaissant la température en dessous du point de fusion du dihydrogène, situé à 14,01 K (-259,14 °C). L'état solide fut obtenu pour la première fois en 1899 par James Dewar.
Hydrogène métallique
L'hydrogène métallique est une phase de l'hydrogène survenant lorsqu'il est soumis à une très forte pression et à de très basses températures. C'est un exemple de matière dégénérée. D'aucuns estiment qu'il y a un intervalle de pressions (autour de 400 GPa) sous lesquelles l'hydrogène métallique est liquide, même à de très basses températures.
Propriétés chimiques et composés
Ions hydron H, hydronium H3O et hydrure H
L'atome d'hydrogène peut perdre son unique électron pour donner l'ion H, désigné couramment par le nom de proton. En effet l'atome qui a perdu son seul électron est réduit à son noyau, et dans le cas de l'isotope le plus abondant H, ce noyau n'est constitué que d'un proton. Cette appellation n'est pas rigoureusement correcte si l'on tient compte de la présence, certes discrète (inférieure à 0,02 %), des autres isotopes. L'appellation hydron est plus générale (on dit aussi ion hydrogène, malgré la confusion possible avec l'anion H). Son rayon est très petit : environ 1,5×10 m contre 5×10 m pour l'atome.
En solution, le proton n'existe pas à l'état libre mais est toujours lié au nuage électronique d'une molécule. En solution aqueuse il est solvaté par des molécules d'eau ; on peut en simplifiant considérer qu'il est capté par une molécule d'eau H2O, formant un ion hydronium H3O, aussi appelé oxonium ou hydroxonium.
L'atome d'hydrogène peut aussi acquérir un second électron pour donner l'ion hydrure H, ce qui lui confère le même cortège électronique stable que l'atome d'hélium.
Réactions acido-basiques
L'hydrogène joue un rôle primordial dans une réaction acido-basique (au sens de la théorie de Brønsted-Lowry) puisque cette dernière correspond formellement à l'échange d'un ion hydrogène H entre deux espèces, la première (l'acide) libérant H par rupture d'une liaison covalente, et la deuxième (la base) captant cet H par formation d'une nouvelle liaison covalente :
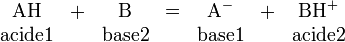
Liaison hydrogène
La liaison hydrogène est une interaction électrostatique entre un atome d'hydrogène, lié chimiquement à un atome électronégatif A, et un autre atome électronégatif B (A et B étant typiquement O, N ou F en chimie organique).
Cette liaison joue un rôle important en chimie organique, puisque les atomes d'oxygène O, d'azote N ou de fluor F sont susceptibles de créer des liaisons hydrogène, mais aussi en chimie inorganique, entre les alcools et les alcoolates métalliques.
Composés covalents
L'atome d'hydrogène peut engager son unique électron pour former une liaison covalente avec de nombreux atomes non-métalliques.
Les composés les plus connus sont :
la molécule de dihydrogène H2 ;
la molécule d'eau H2O ;
les molécules d'hydrocarbures CxHy.
L'hydrogène est également présent dans toutes les molécules organiques, où il est lié principalement à des atomes de carbone, d'oxygène et d'azote.
Hydrures
L'hydrogène se combine avec la plupart des autres éléments car il possède une électronégativité moyenne (2,2) et peut ainsi former des composés avec des éléments métalliques ou non-métalliques. Les composés qu'il forme avec les métaux sont appelés hydrures, dans lesquels il se trouve sous forme d'ions H qui parfois n'existent qu'en solution. Dans les composés avec les éléments non-métalliques, l'hydrogène forme des liaisons covalentes, car l'ion H a une trop forte tendance à s'associer avec les électrons. Dans les acides en solution aqueuse, il se forme des ions H3O appelés ions hydronium ou encore oxonium, association du proton et d'une molécule d'eau.
Production et usages
Production industrielle
Le processus industriel le plus économique pour produire de l'hydrogène est le reformage d'hydrocarbures. En pratique, la méthode la plus usuelle est le vaporeformage du gaz naturel qui est essentiellement composé de méthane. À une température comprise entre 700 et 1 100 °C, la vapeur d'eau réagit avec le méthane en donnant du monoxyde de carbone et de l'hydrogène. La purification de l'hydrogène étant plus facile sous forte pression, le reformage est réalisé sous une pression de vingt atmosphères. Le mélange hydrogène/monoxyde de carbone est communément appelé gaz de synthèse. Si la réaction est faite en présence d'un excès de vapeur d'eau, le monoxyde de carbone est oxydé au niveau d'oxydation supérieur, conduisant au dioxyde de carbone, ce qui augmente la production d'hydrogène.
La société Air liquide possède une maîtrise particulière de ce processus. En 2015, elle a mis en service en Arabie saoudite, sur le site de Yanbu, une unité ayant une capacité totale de production d'hydrogène de 340 000 m/h aux CNTP.
Filière hydrogène
C'est la filière qui produit, stocke, promeut et valorise l'hydrogène. Elle contribue aussi à la Recherche sur l'hydrogène.
En 2015, il est encore « majoritairement produit à partir de gaz naturel et employé comme composant chimique dans des procédés industriels », mais cet élément est souvent présenté comme intéressant pour le développement durable (car si sa production produit des NOx, il n'émet pas de CO2), s'il est issu de ressources renouvelables et surtout s'il peut être produit assez près du lieu de consommation, car pouvant « apporter une contribution importante à la transition vers un modèle énergétique décarboné, notamment dans le secteurs du stockage d’énergie et pour accompagner l’électromobilité ».
L'une des pistes de développement est l'injection dans le réseau de gaz.
La filière cherche à industrialiser ses processus afin d'en permettre une baisse des coûts (pile à combustible notamment). Le développement d'une « mobilité hydrogène » est également freiné par un nombre encore très faible de stations de recharge (et de leur capacité encore faible : 10 à 80 kg H2/j, 350 bars) ; L'hydrogène peut améliorer la puissance du véhicule, prolonger son autonomie, et améliorer la rapidité de recharge (par rapport aux batteries).
Moteur à hydrogène
Fusion nucléaire : bombe H et réacteurs à fusion

 词典释义:
词典释义:
 氢
氢 ]氢
]氢 氢
氢