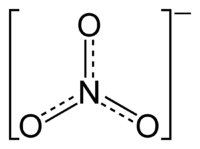
Au singulier, nitrate désigne l'ion et le radical nitrate. Au pluriel, le radical nitrates désigne les sels et les esters contenant des ions nitrate (nitrate de sodium, nitrate de potassium, etc.) ou le radical nitrate (nitrate d'éthyle, nitrate d'amyle, nitrate de cellulose, etc.). Ce sont les sels et les esters de l'acide nitrique. Les anciens noms des nitrates sont le nitre ou le salpêtre). La formule chimique de l’ion nitrate est NO3.
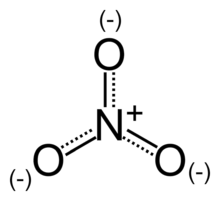
Vue planaire de la structure de l'ion nitrate.
Vue en 3D de la structure de l'ion nitrate.
Modèle boules et bâtonnets de la structure de l'ion nitrate.
![Niveaux de nitrates à la surface des océans[1]](https://wiki-gateway.eudic.net/wikipedia_fr/I/m/WOA05_sea-surf_NO3_AYool.png)
Niveaux de nitrates à la surface des océans
La présence d'un excès de nitrates dans l'eau est un indice de pollution d'origine agricole (engrais), urbaine (dysfonctionnement des réseaux d'assainissement) ou industrielle.
En Europe, la directive Nitrates vise à réduire cette pollution. Dans de nombreux pays, les eaux destinées à la consommation humaine doivent respecter des valeurs limites (par exemple 50 mg/L en France et en Europe) pour être qualifiées de potables. L'OMS recommande également de ne pas dépasser ce seuil de 50 mg/L.
Les nitrates ne doivent pas être confondus avec les nitrites NO2 qui sont des sels de l'acide nitreux, et peuvent résulter de la réduction des nitrates par des bactéries spécifiques.
Les nitrates, comme les phosphates sont de puissants eutrophisants, et en tant que tels considérés comme des polluants de l'environnement au-delà des doses normalement trouvées dans la nature, qui varient selon les types d'habitats naturels.
Certains de leurs effets sur la santé humaine ou d'autres mammifères sont encore discutés et font l'objet de polémiques médiatiques et de débats scientifiques.
Caractérisation et grandeurs
On parle généralement de teneurs en « ion nitrate » (NO3) ou de teneurs en « composés du nitrate » et il est parfois considéré au sein d'une mesure plus large : l'« azote total ».
Ces grandeurs peuvent être exprimées sous différentes formes (NO3N, NO3…), avec alors un risque de confusion ou de biais d'interprétation induite par des masses moléculaires différentes.
Pour convertir les éléments en oxyde, par exemple pour passer de l’azote (N) au nitrate (NO3), il est possible de se baser sur la formule :
-
N (ou N-NO3) × 4,427 = NO3 (où l'expression « N-NO3 » [ou « NO3-N »] signifie l'élément azote N des nitrates NO3.
Teneurs naturelles
Les nitrates étant très solubles dans l'eau, il est normal d'en trouver de faibles quantités partout, dans les eaux douces et marines, en surface et dans les nappes. À faible dose, ils sont un nutriment important pour les plantes, algues et certaines bactéries photosynthétiques (cyanophycées).
La teneur naturelle des eaux de surface non-polluées en nitrates varie selon la zone biogéographique, l'origine de l'eau (ruissellement, remontée de nappe...), et selon la saison (et la météorologie). Cette teneur varie de 1 à 10 mg/L, et monte parfois à 15 mg/L. Même en tenant compte des phénomènes naturels de dénitrification, les eaux à basse teneur en nitrates sont de plus en plus rares, en raison d'une contamination par le ruissellement, par les retombées d'eaux météoritiques polluées par les nitrates, et parfois par des alimentations par la nappe (dont en France le taux de nitrate augmente régulièrement depuis le milieu du XX siècle). En France, avant les années 1950, le taux de nitrates n'excédait que rarement 1 mg/L. Aujourd’hui il ne dépasse généralement pas 2,2 mg/L dans l'Hudson (soit 0,5 mg/L pour le NO3–N, c'est-à-dire d'azote pur), ce qui serait suffisant pour générer des blooms planctoniques si l'eau n'était pas aussi turbide. L'eau de l'Hudson est considéré en Amérique du Nord comme une eau de fleuve plus de deux fois trop riche en azote, et responsable de problèmes d'eutrophisation marine en aval de son estuaire. De plus certaines pluies sont polluées par les nitrates résultant de l'action de l'ozone troposphérique sur le NO2 ; des mesures nord-américaines donnent des teneurs atteignant 4 mg/L de N-NO3, avec des variations d'origine météorologique : le taux de N-NO3 dans les faibles pluies varie de 3,0 à 4,0 mg/L, alors que dans les fortes pluies, il est bien plus dilué (0,4 à 1,0 mg/l).
Utilisations
Il est principalement utilisé sous trois formes :
Le nitrate de potassium (autrefois appelé salpêtre). Il est principalement utilisé pour les engrais (apport des éléments potassium et azote), les moteurs de fusées et les feux d'artifice. Il était utilisé dans la fabrication de poudre noire.
Le nitrate de sodium, autrefois appelé salpêtre du Chili pour le distinguer du nitrate de potassium. Il est utilisé dans la production d'engrais, pour la pyrotechnie, les bombes à fumée, le verre et les émaux, etc.
Le nitrate d'ammonium. Il est essentiellement utilisé comme engrais. Mélangé à un réducteur comme le fioul, il constitue un explosif. Ce composé est stable ; il doit être amorcé ou être mélangé à un autre corps pour exploser. C'est ce qui s'est passé lors de l'accident d'AZF à Toulouse.
Propriétés chimiques
L'ion nitrate est un oxydant assez fort, surtout en milieu acide ; c'est la forme de l'azote ayant le nombre d'oxydation le plus élevé (V). Il oxyde par exemple des métaux comme le cuivre et même l'argent qui ne sont pas attaqués par les acides dits « non-oxydants », par exemple l'acide chlorhydrique. Le couple redox mis en jeu est souvent NO3/NO, plus rarement le couple NO3/NO2.
L'ion nitrate est également impliqué dans la nitration des composés organiques. En milieu acide nitrique fumant (acide très concentré), l'ion nitrate se déshydrate en ion NO2 capable de réagir avec les noyaux aromatiques. La substitution électrophile aromatique qui en résulte produit des produits qui peuvent être explosifs comme le trinitrotoluène.
Avec les alcools, il réagit pour donner des esters nitriques. C'est le cas avec le glycérol, ce qui conduit à la trinitroglycérine, un explosif puissant très utilisé, en particulier pour préparer la dynamite.
Propriété biologiques
L'azote est un élément vital pour la plupart des organismes (comme le potassium et le magnésium), mais les plantes ne savent pas le capter directement dans l'air. Sous forme de nitrate, il est très soluble dans l'eau et alors « bio-disponible » pour les racines.
Les nitrates sont en outre des sels qui en tant que tels facilitent ou « forcent » l'entrée d'eau dans les racines et dans la plante (rééquilibrage osmotique).
Les nitrates dans l'atmosphère
Le cycle de l'azote est en grande partie atmosphérique. Des nitrates se forment dans la stratosphère et la troposphère à partir du NO2 et d'ozone. Ils peuvent ensuite se combiner avec du NO2 pour produire du NO5 ou encore interagir avec les brouillards... selon des processus encore mal compris (il semble exister un puits de Nitrates dans l'atmosphère, c'est-à-dire une réaction qui fait disparaître les nitrates de l'air).
Les NOx participent d'ailleurs à la pollution photochimique, l'ion nitrate dans l'air peut se combiner à des composés organiques et les nitrates exposés aux UV solaires sont photosensibles, ce qui explique une variation jour/nuit du taux de nitrates dans l'environnement et une chimie des nitrates différente la nuit que le jour, notamment au-dessus de la mer.
Pollution de l'eau par les nitrates
Nitrates et eutrophisations
Un débat scientifique fait rage entre deux grandes théories sur l'eutrophisation : les uns accusant les nitrates, presque exclusivement d'origine agricole, les autres accusant les phosphates, d'origine industrielle, domestique (lessive et détergeant) et agricole (surfertilisation et érosion des sols). La mesure la plus adaptée à une lutte contre l'apparition ou le développement des phénomènes d'eutrophisation des eaux douces stagnantes consiste à réduire autant que possible les apports phosphorés. En mer, et dans les baies, les apports en nitrates doivent également faire l'objet d'une réduction. Comme cela a été bien montré dans les lacs (le lac de Valencia par exemple), les phosphates sont le principal facteur d’eutrophisation des eaux douces sur le long terme. Les nitrates sont la seconde cause importante, et elles interviennent souvent ensemble ; dans les eaux douces, mais aussi dans les eaux saumâtres et salées fermées ou peu renouvelées.
Selon l'Ifremer, au début des années 1900, les taux de nitrates des rivières bretonnes ne devaient pas dépasser 3 à 4 mg/L. Ils ont été multipliés par 10 en moyenne en un siècle. Selon l'Ifremer toujours, les eutrophisations des baies de Saint-Brieuc, du Mont Saint-Michel, de Lannion, Douarnenez ou de la rade de Brest, constatées depuis la fin du XX siècle sont typiques des situations de masses d’eau relativement confinées et peu profondes, victimes d’apports récents de nitrates. La biomasse estivale y croît après les apports de nitrate du printemps. Lorsque ces apports diminuent en été, le taux de nitrates dans les ulves diminue également, au point de bloquer la croissance estivale de ces algues alors que le taux de phosphore reste presque stable.
Les modélisations mathématiques de l'Ifremer indiquent que la diminution des apports de nitrate agricole est le seul moyen de limiter les pullulations d'ulves au printemps (les taux de nitrates des rivières devant au moins être divisés par quatre, pour passer de 40 mg/L à moins de 10 mg/L), ce qui devrait être possible par des pratiques agricoles adaptées, incluant les réseaux de bandes enherbées protégeant les cours d’eau. Paradoxalement, une brutale carence en azote d'un milieu aquatique antérieurement eutrophe ou dystrophe peut mener dans un premier temps à des efflorescences de cyanobactéries (ou algues bleues) capables d'assimiler directement l'azote de l'atmosphère et de vivre en condition anaérobie.
Cette approche centrée sur la lutte contre l'azote est contestée par d'autres scientifiques, notamment Guy Barroin de l'INRA. Ce dernier explique que réduire la concentration d'azote pour supprimer les marées vertes est voué à l'échec :
La concentration à atteindre pour bloquer le développement des algues serait inférieur au taux « naturel » de nitrate, et donc impossible à atteindre, les marées vertes ne disparaîtraient pas.
Si la concentration en nitrates baisse et mais que le milieu reste riche en phosphore, le rapport N/P risque de passer en dessous de 7, ce qui provoquera un basculement des populations algales et microalgales en faveurs des cyanobactéries : elles ne dépendent pas des nitrates grâce à leur capacité à fixer l'azote gazeux. Les cyanobactéries survivent à l'anoxie et peuvent pour certaines espèces et dans certaines circonstances sécréter des toxiques dangereuses pour de nombreux organismes vivants.
Certains hydrosystèmes (écosystème récepteur + bassin versant) de grande taille et fortement anthropisés sont lourdement chargés en phosphore et il sera très difficile de les épurer à court terme.
Les dépenses additionnelles des ménages générées par ces pollutions liées aux excédents d’azote et de pesticides d’origine agricole se situeraient au minimum dans une fourchette comprise entre 1 005 et 1 525 millions d’euros, dont **0 à 1 140 millions d’euros répercutés sur la facture d’eau, représentant entre 7 et 12 % de cette facture en moyenne nationale. Un rapport de la Cour des comptes publié en 2010 notait qu'en Bavière et au Danemark des actions préventives ont significativement réduit (- 30 %) les consommations d'azote et de pesticides. Les mesures d'aménagement et de compensation des pratiques agricoles sont en général moins couteuses que le retraitement : retraiter l'eau d'un hectare cultivé autour d'un point de captage coute entre 800 à 2 400 euros par an. Or, un agriculteur fait une marge brute d'environ 1 000 euros par hab./an pour une culture de céréales, il est donc possible de compenser la totalité de sa perte économique en réduisant le cout de production de l'eau potable. En France, la mise en place de ces mesures compensatoires pour inciter les agriculteurs à modifier leur assolement (plantation pérenne, réduction des intrants) ou leur pratique ne sont pas économiquement intéressantes ou à trop court terme pour permettre une amélioration réelle et durable des points de captages. Le problème est économique : les fournisseurs d'eau peuvent facilement reporter le surcoût du retraitement sur leurs clients, les agriculteurs ne peuvent pas reporter leur perte de rendement ou de production sur le prix de leurs produits. Le boisement est la solution idéale, mais elle se heurte des problèmes juridiques : si l'agriculteur n'est pas propriétaire, il n'a pas intérêt à boiser car il perdra son fermage. Si le terrain possède un droit à paiement unique (DPU), il sera aussi perdu, ce qui réduira les revenus de l'agriculteur.
Bien que la forêt soit réputée absorber efficacement les nitrates (alors que la coupe rase peut être suivie d'un relargage), une étude faite de la « forêt expérimentale de Fernow » (Virginie-Occidentale) a montré que dans une forêt centrale feuillue tempérée, les flux de NO3- dans l'eau interstitielle du sol (la « solution du sol ») peuvent fortement varier selon la capacité des bassins-versants à absorber les nitrates et à dénitrifier l'eau. La variation temporelle du taux de NO3- peut être influencée par l'hétérogénéité spatiale des processus à l'œuvre dans les bassins versants et ils varient au fil du temps en réponse à la disponibilité en azote.
Pour étudier en continu et de manière beaucoup plus fine (qu'avec les préleveurs classiques) le cycle de l'azote et les nitrates dans un cours d'eau, des chercheurs espagnols ont testé en laboratoire puis in situ (dans une rivière de l'Est de l'Espagne) un système expert associé à un réseau de capteurs sans fil . Un triple capteur redondant modulaire permet pour chaque capteur d'améliorer la fiabilité du système, sans grands changements de coûts ou de consommation d'énergie. Dans ce cas, la fréquence d'échantillonnage s'adapte à l'évolution du système, aux préférences de l'utilisateur et aux fonctionnalités de l'application, avec plusieurs modes possibles (transmission périodique, transmission graduelle, transmission à la demande de l'utilisateur et/ou à la demande de pairs). Il devient alors plus facile de détecter, quantifier, dater, cartographier les pollutions azotées de l'eau et d'identifier leur source géographique.
Nitrates dans les pluies
Des flux parfois importants de composés gazeux de l'azote existent du sol vers l'atmosphère, notamment dans les paysages d'agriculture intensive ; Ces flux varient de plusieurs kg/ha/jour pour l'ammoniac après un épandage de lisier (chiffre très élevé mais qui déclinera rapidement après quelques jours) à quelques grammes/ha/jour pour le protoxyde d'azote ou les NOx. Dans les régions d'agriculture ou d'élevage intensifs, de vastes surfaces peuvent être concernées (jusqu'à 70 % du paysage).
Plus localement, les pluies peuvent aussi être contaminées par des nitrates ayant une origine industrielle ou automobile (circulation routière / pollution photochimique). Des taux atteignant 5 mg/l ont été signalés dans certaines zones industrielles dès la fin des années 1980.
Enfin, la foudre peut aussi localement et momentanément augmenter la teneur en nitrate des précipitations.
Pour toutes ces raisons les apports de nitrate par les pluies varient beaucoup selon les régions et les saisons.
Ainsi, en zone tropicale forestières, ou dans la savane, les taux sont habituellement très faible (quelques traces seulement en Guyane ou dans le bassin du Congo par exemple) mais à proximité des zones touchées par des feux de brousse, le taux de nitrate peut être un peu plus élevé dans les premières pluies suivant les feux. En France, les retombées moyennes annuelles de nitrates dans la pluie étaient de 33 mg/m²/an dans la Haute-Vienne en 1991, mais de **0 mg/m²/an dans le Bas-Rhin en 1995. En bordure de mer, dans le bassin d'Arcachon victime de proliférations d'algues, les pluies étaient au milieu des années 1990 responsables de 9 % des apports allochtones d'azote (c'est peu par rapport aux plus de 90 % provenant des cours d'eau mais beaucoup par rapport à moins de 1 % pour la « nappe du Sable des Landes »). Selon une étude publiée en 2007, l'eau des citernes de récupération des eaux pluviales en Wallonie contenait de 2,0 à 5,3 mg/L de nitrate, mais ce taux peut ne pas refléter celui de la pluie (et 0,03 à 0,9 mg/L pour l'ion ammonium).
Les pluies ainsi « contaminées » deviennent alors à la fois acidifiantes et pouvant contribuer à l'eutrophisation des eaux douces.
Ecotoxicité
Les nitrates comptent parmi les produits chimiques les plus abondamment dispersés par l'Homme dans l'environnement depuis environ un siècle. Bien qu'ils soient très solubles dans l'eau, il ne semble pas y avoir eu au XX siècle d'études poussées sur leur écotoxicité vis-à-vis des organismes aquatiques. Plusieurs équipes scientifiques ont entrepris depuis le début du XXI siècle de combler cette lacune.
L'ion nitrate est bien moins toxique que l'ammoniac non-ionisé, il y a consensus sur ce point. Mais toutes les études publiées depuis la fin des années 1990 confirment que, parce qu'il devient omniprésent dans les nappes et les eaux douces (dès la source souvent, dans les régions d'agriculture intensive) ; le nitrate pose désormais plusieurs grands problèmes écosystémiques et écotoxicologiques :
quand un milieu aquatique n'est pas naturellement tamponné contre les acides (neutralisation des acides), l'ion nitrate y augmente le pH du milieu et une acidification croissante est alors (sauf contre-mesures) inéluctable. Elle rend en outre les métaux lourds et métalloïdes toxiques plus solubles et plus biodisponibles pour la faune, la flore, la fonge et les microorganismes. Alors que la législation sur les carburants soufrés a permis depuis les années 1990 environ de réduire les pluies acidifiées par le SO2, les nitrates ont pris la place et le rôle joué par le SO2 ou là où les carburants soufrés sont encore utilisés, ils aggravent conjointement leurs effets ; les nitrates sont devenus le nouveau facteur préoccupant, et croisant, d'acidification des eaux douces qui a déjà conduit à des « appauvrissements biotiques importantes, en particulier concernant les invertébrés et les poissons, dans de nombreux lacs et cours d'eau acidifiés par des retombées atmosphériques » ;
NO3 peut « stimuler ou favoriser le développement, l'entretien et la prolifération des producteurs primaires » (cyanophycées, algues unicellulaire et filamenteuses, lentilles, algues libres...), contribuant ainsi à l'eutrophisation des écosystèmes aquatiques ;
il atteint ou dépasse parfois les seuils de toxicité qui limitent « la croissance, la reproduction ou la survie » d'individus ou d'espèces;
l'azote inorganique des eaux souterraines, de source et de surface « peut également induire des effets néfastes sur la santé humaine et l'économie », d'autant que les milieux aquatiques les plus enrichis en nitrates sont souvent aussi ceux qui contiennent le plus de germes pathogènes et de parasites et/ou vecteurs responsables de zoonoses (cholera, paludisme et autres maladies hydriques). Le recul des poissons dans les zones les plus touchées risque en outre de reporter les pressions excessives de pêche sur les pêcheries encore épargnées.
Ce double phénomène (eutrophisation + acidification) affecte aussi le cycle du carbone et les puits de carbone ; or il survient et prend de l'ampleur alors que le protocole de Kyoto n'a pas enrayé l'augmentation du taux atmosphérique de CO2 et de méthane, et alors que les prospectivistes et les rapports successifs du GIEC augurent d'importants changements géoclimatiques ; la combinaison de ces trois phénomènes pourrait encore dégrader les capacités de résilience des écosystèmes face à ces changements.
Toxicité aux stades ovo-embryonnaires et larvaires : On a longtemps cru que les organismes d'eau douce (vertébrés ou invertébrés) sont bien plus directement sensibles et vulnérables aux nitrates que leurs homologues marins. C'est exact pour les animaux adultes (pour des raisons encore mal comprises, la salinité de l'eau de mer, c'est-à-dire la disponibilité en sodium, chlorure, calcium et autres ions, et peut être la disponibilité en iode améliorent la tolérance des animaux marins aux nitrates), mais c'est en réalité faux pour les larves de nombreuses espèces marines qui se montrent parfois aussi vulnérables aux nitrates que leurs cousins d'eau douce. En eau douce, 10 mg de nitrates par litre d'eau (soit le niveau maximal fédéral pour l'eau potable aux États-Unis) suffit à affecter significativement à gravement – au moins pour des expositions longues – les invertébrés d'eau douce. C'est la conclusion d'expériences notamment conduites sur Eulimnogammarus toletanus, Echinogammarus echinosetosus (nl), Cheumatopsyche pettiti, Hydropsyche occidentalis. À cette dose (10 mg/L), des poissons ducaquicoles autrefois communs se montrent touchés ; de même que des amphibiens tels que P. triseriata, Rana pipiens, Rana temporaria, Bufo bufo (voir détails ci-dessous).
Toxicités directe et indirectes : « la principale action toxique du nitrate est due à la conversion de pigments porteurs d'oxygène en des formes incapables de transporter l'oxygène ». Il existe une toxicité directe (pour les espèces qui y sont sensibles) et plusieurs biais de toxicité indirecte (par exemple liée à l'effet acidifiant du nitrate, et à ses effets eutrophisants qui conduisent notamment à la production de vastes blooms d'algues ou de cyanophycées, de dinoflagellés, de diatomées ou de bactéries toxiques ou capables de sécréter des toxines, qui contribuent à l'entretien ou à l'apparition de plus en plus fréquente de zones hypoxiques puis anoxiques aussi dites zones mortes. La décomposition des animaux morts et des algues des marées vertes conduit aussi à la production de sulfure d'hydrogène, toxique pour la plupart des espèces. Des bactéries peuvent transformer les nitrates en nitrites et inversement ; il faudrait donc aussi tenir compte du fait que la forme nitrite de l'azote inorganique est également écotoxique. Elle l'est fortement pour de nombreuses bactéries, et à partir de 60 mg/L pour le planaire Polycelis felina, déjà utilisé pour l'étude de la toxicité chronique de l'ammoniac. Le nitrate a d'autres voies toxiques indirectes (illustrées ci-dessous).
Toxicité pour les invertébrés aquatiques
Les études publiées dans les années 2000 à ce sujet ont toutes conclu que les nitrates étaient toxiques pour la plupart des invertébrés d'eau douce, par exemple pour des espèces-modèle telles que Eulimnogammarus toletanus, Echinogammarus echinosetosus et Hydropsyche exocellata.
Cette toxicité est de type « dose-dépendante », c'est-à-dire qu'elle croît avec l'augmentation des concentrations de nitrates et des temps d'exposition. Mais cette toxicité directe peut aussi diminuer chez les adultes (ou plus exactement avec l'augmentation de la taille du corps). Une toxicité indirecte peut être liée à des phénomènes d'anoxie et de dystrophisation, et/ou au fait que les nitrates rendent certains invertébrés (daphnies par exemple) plus vulnérables aux parasitoses ; Elle diminue aussi – pour les organismes adultes – avec la salinité de l'eau, ce qui explique que les invertébrés marins y soient apparemment moins sensibles, hormis bien entendu dans les zones mortes. Certains phénomènes adaptatifs semblent permettre à quelques espèces de mieux survivre en présence d'une quantité anormalement élevée de nitrates.
Certaines espèces se montrent bien plus sensibles à l'ion NO3 que d'autres ; ainsi parmi les quelques invertébrés testés en laboratoire, E. toletanus et E. echinosetosus présentent une DL50 (pour seulement 96 h d'exposition) qui est respectivement de 2,09 et 2,59 mg de nitrate par litre.
Une revue de la littérature publiée en 2003 a conclu que l'eutrophisation était devenue un problème global pour les écosystèmes.
Une autre revue de la littérature a (en 2005) conclu des études disponibles que « 10 mg/L serait un seuil de sécurité à ne pas franchir pour protéger les animaux d'eau douce sensibles à la pollution par les nitrates. Mais un seuil maximal de 2 mg/L serait approprié en eau douce pour la protection des espèces les plus sensibles ». Selon les mêmes auteurs, en milieu marin un seuil de 20 mg/L « pourrait en général être acceptable ; cependant, aux premiers stades de développement de certains invertébrés marins qui sont adaptés à de faibles taux de nitrates, ceux-ci peuvent être aussi sensibles aux nitrates que les invertébrés d'eau douce sensibles ».
Une nouvelle revue de la littérature a conclu (en 2006) qu'« il faudrait un taux d'azote total inférieure à 0,5-1,0 mg par litre pour empêcher les écosystèmes aquatiques (à l'exclusion des écosystèmes naturellement riches en azote) de s'acidifier et s'eutrophiser, au moins par la pollution par l'azote inorganique. Ces taux relativement faibles de nitrate total (NT) pourraient également protéger la faune aquatique contre la toxicité des composés azotés inorganiques (...) En outre, la santé humaine et l'économie seraient plus en sécurité vis à vis des effets néfastes de la pollution par l'azote inorganique ».
Toxicité pour les poissons
Après la Première Guerre mondiale, la traction animale a été rapidement remplacé par les moteurs, privant les agriculteurs et jardiniers d'une grande quantité de fumier. Les nitrates massivement produits par l'industrie de guerre comme explosif et pour les munitions étaient disponibles. Ils ont commencé à être utilisé comme engrais chimique (dont sous forme de sels ammoniacaux à raison de 2 à 300 kg/ha), malgré l'inconvénient d'être plus facilement lessivables par les pluies que l'azote organique du fumier. Des pêcheurs et pisciculteurs ayant observé des mortalités de poissons, notamment après lavage de sacs d'engrais ammoniacaux dans l'eau de rivières poissonneuses se sont opposé à l'utilisation d'engrais chimiques ;
Au début des années 1930, à la suite de plaintes en justice, deux biologistes allemands (L. Scheuring et F. Léopoldseder) ont commencé à tester la toxicité de divers types d'engrais dont les nitrates chimiques en exposant durant 6 heures des truites et cyprinidés adultes à diverses concentration de ces engrais. Le nitrate de chaux et le nitrate de soude présentaient une certaine toxicité (au-delà de 2 %, mort des poissons en une heure ou apparition de symptômes assez gaves pour les poissons remis dans une eau propre ne se rétablissent pas), mais bien moindre que le nitrate de chaux ammoniacal (limite de létalité : 0,03 %). Selon E. André (1935) , ces auteurs n'ont pas anticipé le fort développement de l'utilisation des engrais chimiques et ils ont conclu (en 1935) qu'aux doses habituelles, en raison de la dilution dans l'environnement, sauf cas exceptionnels les engrais ne sont pas toxiques pour les poissons (adultes).
Les études plus récentes, qui ont porté sur les œufs, les alevins et les adultes ont montré qu'en réalité, à la dose de 10 mg/L (fréquemment dépassée dans les milieux anthropisés), des poissons d'eau douce autrefois communs tels que Oncorhynchus mykiss, Oncorhynchus tshawytscha, Salmo clarki (nl) se montrent aussi affectés, de même que de nombreuses autres espèces.
Toxicité pour les amphibiens
Les nitrates sont toxiques pour les larves (aquatiques) et les adultes (plus ou moins terrestres) d'amphibiens. Ils le sont à faible dose pour les larves : Les concentrations requises pour tuer 50 % de têtards de certaines espèces nord-américaines sont très faibles : de 13 à 40 mg/L. Une exposition à des concentrations aussi faibles que quelques mg/L a chez certaines espèces des effets chroniques : nage réduite, malformations au cours du développement. Cette écotoxicité (aiguë et/ou chronique) a commencé à être mise en évidence dans les années 1990. En France, des espèces comme Rana temporaria ou Bufo bufo sont susceptible d'y être directement exposées car vivant souvent à proximité de zones cultivées. De faibles concentrations (de 25 à 150 ppm) ont chez certaines espèces d'amphibiens des effets chroniques : nage réduite, malformations au cours du développement ont été suspectés et pour certains expérimentalement confirmés. Les nitrates ralentissent le développement des larves de Rana pipiens. Sans effets seules, les nitrates mitige l'effet de l'atrazine : les Xenopus laevis adulte est plus exposé à de l'eau contaminé au stade têtard sont plus grande ou plus petite selon la dose de nitrate ajouté à l'atrazine, avec un effet antagoniste de la dose. Les têtards exposés à des fortes doses de nitrates (au moins 50 mg/L) ont une mortalité plus élevés et une activité perturbée. Une étude publiée en 1999 a montré que la pollution par les nitrate était déjà très généralisée dans les grandes régions agricoles des pays industrialisés : 20 % environ des bassins des états et des provinces bordant les Grands Lacs présentaient des teneurs en nitrates dépassant les doses causant des anomalies du développement et d'autres effets sublétaux chez les amphibiens.
Controverses et incertitudes quant à la toxicité des nitrates pour l'Homme
Complexité des effets alimentaires des nitrates
Diverses études ont suggéré ou démontré d'une part des effets négatifs pour la santé au-delà d'une certaine dose (toxicité aiguë) ou en cas de vulnérabilités du patient, et d'autres des effets positifs de nitrates inorganiques, mais il n'y a pas de consensus quant aux effets globaux chez l'Homme (ou les animaux d'élevage) d'une exposition chronique à de faibles doses.
La formation d'un consensus scientifique sur les effets sanitaires des nitrates se heurtent encore à de nombreuses inconnues :
les nitrates peuvent être transformés en nitrites et inversement, dont dans le tube digestif ;
ils pourraient à la fois avoir des effets positifs et négatifs, selon leur forme, leur quantité, l'âge du patient, l'heure à laquelle ils sont absorbés, etc.
la puissance statistique de nombreuses études, et leurs odds ratio sont souvent modestes, les auteurs précisant souvent que leurs résultats doivent être utilisés avec précaution et que des recherches plus poussées sont nécessaires ;
de nombreuses limites méthodologiques et biais d'interprétation réduisent la portée des travaux rétrospectifs :
reconstruire rétrospectivement l'exposition réelle d'un patient durant sa vie est compliqué car il n'existe pas de données individuelles pour la consommation d'eau en tant que boisson et les apports alimentaires ;
l'exposition humaine est souvent faible et inhomogène, L'eau, les aliments et même l'air inhalé peuvent être source de nitrates, et l'effet biologique mesuré pourrait aussi être faible ;
les évaluations de présence ou d'effets d'autres polluants éventuellement synergiquement présents et susceptibles d'être associés aux nitrates (ex : pesticides) ou de molécules susceptibles d'avoir un effet antidote (ex. : vitamines et antioxydants dans les fruits et légumes) sont souvent absentes des études ;
Les résultats des études sont parfois contradictoires : pour l'hyperthyroïdisme, certaines études montrent que les nitrates interagissent en effet avec la thyroïde (cause d'hypertrophie thyroïdienne, d'autres au contraire les innocentent pour la même pathologie, les accusant au contraire d'augmenter le risque de cancer et de d'hypothyroïdisme.
Au vu des limites des études disponibles ; comme pour d'autres travaux d'épidémiologie rétrospective basés sur des résultats à faible odds ratio, il reste difficile d'être catégorique.
Certains effets semblent négatifs pour la santé humaine
La présence de nitrate à « haute concentration (>10 mg Nl−1) » dans l'eau de boisson :
augmente légèrement le risque de plusieurs types de cancer, car ils sont une source endogène de nitrites et de réactions subséquentes de nitrosation produisant des composés « N-nitroso » connus pour être très cancérigènes et pouvant agir systémiquement (chez l'homme et chez plusieurs espèces utilisées comme modèle animal : cancer colorectal, avec des odds ratio très faiblement significatif de 1.22 (0.98-1.52) et 1.36 (1.08-1.70), et ce risque pourrait ne concerner que le cancer proximal du colon, et ce risque ne concernerait peut-être que des individus carencés en vitamine C, cette dernière inhibant la formation des composés Nitroso) et consommant beaucoup de viande L'association entre risque de cancer, exposition aux nitrates et carence en vitamine C a été retrouvée pour d'autres types de cancer (œsophage, voir ci-dessous) ; cancer de l'estomac serait aussi augmenté, que ce soit avec les nitrates de l'eau ou ceux contenus dans des végétaux riches en nitrate comme les épinards ; cancer de l'œsophage ; cancer du rein (qui ne semble associé qu'à la consommation de produits animaux contenant des nitrates ou des nitrites, et non à l'eau de boisson). Une eau ou alimentation riche en calcium aurait un effet protecteur ; Cancer de l'ovaire (le cancer apparaissant alors chez la femme âgée) ; Cancer de la vessie (également chez la femme âgée) ;
cancer colorectal, avec des odds ratio très faiblement significatif de 1.22 (0.98-1.52) et 1.36 (1.08-1.70), et ce risque pourrait ne concerner que le cancer proximal du colon, et ce risque ne concernerait peut-être que des individus carencés en vitamine C, cette dernière inhibant la formation des composés Nitroso) et consommant beaucoup de viande L'association entre risque de cancer, exposition aux nitrates et carence en vitamine C a été retrouvée pour d'autres types de cancer (œsophage, voir ci-dessous) ;
cancer de l'estomac serait aussi augmenté, que ce soit avec les nitrates de l'eau ou ceux contenus dans des végétaux riches en nitrate comme les épinards ;
cancer de l'œsophage ;
cancer du rein (qui ne semble associé qu'à la consommation de produits animaux contenant des nitrates ou des nitrites, et non à l'eau de boisson). Une eau ou alimentation riche en calcium aurait un effet protecteur ;
Cancer de l'ovaire (le cancer apparaissant alors chez la femme âgée) ;
Cancer de la vessie (également chez la femme âgée) ;
Les nitrates sont aussi des perturbateurs endocriniens : Ils perturberaient le fonctionnement de la thyroïde en tant qu'anions antagonistes de l'iode nécessaire au bon fonctionnement du système thyroïdien et auraient un effet goitrogènes quand ils sont associés à un faible apport d'iode: les nitrates perturbent l'absorption de l'iode dans l'intestin et au niveau de la thyroïde à cause de leur charge électrique négative (le corps humain absorbe ou excrète les ions en fonction de leur charge). Pour autant cet effet théorique n'est pas toujours confirmé par des études épidémiologiques ou des études sur témoins et semble lié à des doses de nitrate très supérieures aux normes de potabilité. Chez les populations fortement carencées en iode l'effet semble nul. L'effet des nitrates peut s'additionner aux thiocyanates et aux perchlorates. Un lien semble exister avec le risque de goître et hypertrophie de la thyroïde.
Ils perturberaient le fonctionnement de la thyroïde en tant qu'anions antagonistes de l'iode nécessaire au bon fonctionnement du système thyroïdien et auraient un effet goitrogènes quand ils sont associés à un faible apport d'iode: les nitrates perturbent l'absorption de l'iode dans l'intestin et au niveau de la thyroïde à cause de leur charge électrique négative (le corps humain absorbe ou excrète les ions en fonction de leur charge). Pour autant cet effet théorique n'est pas toujours confirmé par des études épidémiologiques ou des études sur témoins et semble lié à des doses de nitrate très supérieures aux normes de potabilité. Chez les populations fortement carencées en iode l'effet semble nul. L'effet des nitrates peut s'additionner aux thiocyanates et aux perchlorates. Un lien semble exister avec le risque de goître et hypertrophie de la thyroïde.
Certains effets semblent positifs pour la santé humaine
Concernant le système cardiovasculaires :
Chez le jeune adulte en bonne santé, une courte supplémentation en nitrate alimentaire (NO3 ajouté à l'alimentation normale durant quelques jours) réduit la pression artérielle au repos, mais altère la réponse physiologique à l'exercice.
Des adultes de 40 ans en mauvaise santé cardiovasculaire (présentant au moins trois facteurs de risques cardio-vasculaire parmi l'hypertension artérielle, l'obésité, l'hyperlipidémie, le tabagisme, la sédentarité, des antécédents familiaux de maladie cardiovasculaire ou de diabète) ont été soumis à une prise biquotidienne durant 30 jours de vitamine C (baies d'aubépine) et d'un aliments riche en nitrate (betterave rouge) favorisant la formation d'oxyde nitrique (NO) au niveau de l'endothélium. Ce traitement s'est traduit par une activité nitrite réductase, une élévation significative du nitrite (P <.01) et du nitrate (P <.0001) dans le plasma et une réduction statistiquement significative des triglycérides chez les patients qui présentaient des taux élevés de ces sucres.
Chez les personnes âgées, une étude (2010) a conclu qu'une alimentation riche en nitrates (inorganiques), comme dans le régime méditerranéen, augmente l'afflux sanguin dans le lobe frontal du cerveau chez des personnes âgées (74,7±6,9 ans), spécialement dans la zone située entre le cortex préfrontal dorsolatéral et le cortex antérieur cingulaire. De 2010 à 2013, d'autres études ont montré qu'il existait chez l'homme une voie dite « nitrate-nitrite-nitric oxide (NO) » qui a des effets vasculaires bénéfiques (dont réduction de la pression artérielle, inhibition de l'agrégation plaquettaire, préservation ou amélioration de la dysfonction endothéliale, amélioration de la performance physique chez les sujets sains et chez des patients atteints de maladie artérielle périphérique. Des études pré-cliniques utilisant certains nitrates ou du nitrites évoquent une possible protection contre des lésions d'ischémie-reperfusion cardiaques (qui apparaissent après l'infarctus lors de la réoxygénation du tissu cardiaque, et une réduction de la rigidité artérielle, de certaines inflammations et de l'épaisseur de l'intima. Après une supplémentation de l'alimentation par des nitrates durant 3 jour chez des adultes âgés en bonne santé, un test de capacité fonctionnelle (6 min de marche sur tapis roulant) montre une augmentation du taux de nitrites dans le plasma, une diminution de la pression artérielle au repos, une faible amélioration métabolique du muscle à l'exercice, sans changement des concentrations de métabolites dans le cerveau, ni de changement des fonctions cognitives. Cependant des preuves épidémiologiques montrant que ces effets positifs l'emportent sur de plausibles effets négatifs sont encore à trouver. Certaines études concluent à une réduction du risque cardiovasculaire chez les personnes qui ont des régimes riches en légumes considérés comme sources importantes et naturelles de nitrate (comme un régime méditerranéen), mais d'autres études suggéré que les associations positives sont modestes et évoquent aussi un risque accru de cancer lié aux « nitrates alimentaires », lien qui reste également à démontrer. Des interactions complexes existent avec d'autres nutriments, dont la vitamine C, les polyphénols et les acides gras qui peuvent renforcer ou inhiber les effets positifs ou négatifs des nitrates.
Questions en suspens
Un effet reprotoxique chez l'homme a été un temps soupçonné. Selon une étude publiée en 1996, il apparaît à des taux très supérieurs (environ 100 fois supérieur) à ceux auxquels un homme moyen est normalement exposé par l'alimentation.
Un taux élevé de nitrates dans le plasma sanguin n'a pas été corrélé avec un risque accru de cancer de la prostate. Un éventuel effet protecteur du nitrate sur des formes agressives de cancer de la prostate est évoqué, mais requiert confirmation selon les auteurs qui restent prudents.
En 1996, une bibliographie écrite par le professeur de médecine Jean L'hirondel et al., vivement critiquée par l'association Eau et rivières de Bretagne qui dénonce une bibliographie incomplète et parfois tronquée, et rappelle que « Ce livre, écrit par un rhumatologue du CHU de Caen, le docteur Jean-Louis L'hirondel, retranscrit les travaux de son père, Jean L'hirondel, professeur de clinique médicale infantile au CHU de Caen, décédé en 1995. Refusé par les éditeurs scientifiques Lavoisier Tech & Doc., il a finalement été édité en août 1996 » par une association qui s'est donné le nom d'Institut de l'environnement ou Institut scientifique et technique de l'environnement et de la santé (ISTES), présidée par un ancien agronome de l'INRA, devenu directeur du bureau d'études (GES) fournisseur des industriels qui ont créé l'Institut de l'environnement et connu pour son lobbying et ses positions favorables aux nitrates, tente de faire un résumé des effets bénéfiques supposés des nitrates. En mars 1996, le Conseil supérieur d'hygiène publique de France (CSHPF), a émis un avis sur les travaux du P L'hirondel : il y dénonce le caractère trop absolu de ses conclusions. Peu après (24 mars 1997), lors de la Conférence régionale de l'environnement, le Conseil scientifique régional a considéré que « L'ouvrage de M. L'hirondel n'apporte pas d'arguments nouveaux issus de recherches et d'expérimentations publiées, susceptibles de réviser la position des scientifiques sur les risques multiples liés à l'augmentation de la teneur en nitrates dans les eaux... », ajoutant « Au moment où tout le monde prône un développement durable, où des affaires récentes démontrent l'importance du principe de précaution, peut-on prendre le risque de réduire les facteurs de sécurité jusqu'alors retenus ? ».
Selon le D Jean-Louis L'hirondel, les nitrates ne sont pas toxiques et au contraire apporteraient les bénéfices sanitaires suivants :
Effet anti-infectieux : La sécrétion par les glandes salivaires et la transformation des nitrates salivaires en nitrites permettrait d'utiliser la propriété bactéricide des nitrites, en milieu acide. Le secteur agro-alimentaire utilise en effet les nitrites comme biocide pour la conservation des aliments et en particulier de celle de la viande pour le saucisson. L'effet antibactérien des nitrites acidifiés est vérifié artificiellement pour différentes entérobactéries : salmonelle, escherichia coli, shigella.
Effet sur la tension artérielle et certaines pathologies cardio-vasculaires : selon le D L'hirondel, une augmentation des taux sanguins de s-nitrosothiols (en) induire par des apports alimentaires en nitrates (légumes et eau de boisson principalement) pourraient améliorer les fonctions de l'organisme dépendant du monoxyde d'azote ; Ainsi pourraient-ils réduire chez l'homme le risque de pathologie vasculaire cérébrale et d'hypertension artérielle (Bockman et coll., 1997).
Effet sur les cancers gastriques : L'hypothèse du D L'hirondel est que les nitrates de l'eau de l'alimentation pourraient jouer un rôle anticarcinogénique. Des travaux complémentaires sont nécessaires pour confirmer ou infirmer cette hypothèse.
Autres : Lors de la synthèse chimique intragastrique du monoxyde d'azote, les apports alimentaires en nitrates joueraient un rôle bénéfique en relaxant la musculature lisse de l'estomac et en protégeant sa muqueuse.
Vers une remise en question des normes pour l'eau potable ?
Plusieurs auteurs ou groupes de lobbying suggèrent de revoir à la baisse les normes pour l'eau potable.
Un article de la revue La Recherche, extrait d'un ouvrage publié sous la direction de Marian Apfelbaum, professeur de nutrition à la faculté de médecine Xavier-Bichat (Paris) estime que « la norme qui fixe le seuil acceptable de nitrates dans l’eau de boisson est […] le fruit d’une expertise réalisée dans les années 1960, que les nouveaux éléments scientifiques ont démentie ». L'auteur y estime que « La consommation du nitrate est totalement inoffensive chez l’homme » (aux doses habituellement présentes dans l'eau du robinet).
Cependant, les enjeux de cette norme dépassent largement les seules questions de santé publique, car les normes et plusieurs directives, dont la directive Nitrates en Europe protègent aussi les eaux de surface de l'eutrophisation et de la dystrophisation (qui peuvent avoir d'autres conséquences, négatives, pour la santé humaine, par exemple lors des situations d'anoxie (favorables à de nombreux microbes indésirables) et parce que les nitrates favorisent aussi l'érosion de la biodiversité et des pullulations de planctons sécrétant des toxines). La qualité des eaux de surface est garante à long terme des nappes, et certaines nappes alimentent à leur tour de nombreuses sources pour lesquelles le Droit de l'environnement impose de conserver ou retrouver le bon état écologique.
Recommandations (2013) pour l'alimentation
En 2013, sur la base des données scientifiques actuellement disponibles en 2012, une équipe de chercheurs a produit un tableau dit « Veg-Table » basé sur le principe d'« unités de nitrate » (une unité = 1 mmol de nitrate ou 62 mg). Il vise à fournir des conseils simples pour que l'apport de nitrates alimentaire à partir de différents légumes soit suffisante pour tirer profit, mais pas trop important pour minimiser les risques d'effets secondaires possibles. Les auteurs concluent néanmoins que des incertitudes persistent sur les effets à long terme des nitrate alimentaires, qui ne pourront être levées que par des recherches plus approfondies.
L'heure d'ingestion du supplément en nitrate (jus de betterave rouge par ex) pourrait aussi avoir une importance. Pris au petit déjeuner, il modifie le taux de nitrites et de nitrates pour la journée.
Les nitrates et le Droit
La directive Nitrates en Europe impose un certain nombre d'actions, de zonages (zones vulnérables) et de suivi.
En novembre 2009, la Commission européenne a mis en demeure la France (qui doit payer des amendes), en raison de la faiblesse de ses programmes d’action pris en vertu de la directive pour protéger les eaux des nitrates, jugés trop disparates entre les départements. Le 19 octobre 2011, la Cour de justice de l'Union européenne a confirmé sa condamnation de la France avec astreinte de plus de 57 millions d'euros, s'ajoutant aux 20 millions d'euros d’amende déjà versés pour non-respect de la réglementation sur la Pêche et à d'autres amendes pour non-respect de la législation européenne (253,5 millions d'euros étaient pour cela provisionnés dans le compte général de l’État pour 2010). L'azote est aussi impliquée dans le non-respect de la directive sur la qualité de l'air, avec un autre risque de condamnation de la France (non-respect des valeurs limites des particules et du dioxyde d’azote).
Les types de nitrates
Nitrates de... (relativement au tableau périodique des éléments) HNO3 He LiNO3 Be(NO3)2 B(NO3)4 RONO2 NO3 NH4NO3 O FNO3 Ne NaNO3 Mg(NO3)2 Al(NO3)3 Si P S ClONO2 Ar KNO3 Ca(NO3)2 Sc(NO3)3 Ti(NO3)4 VO(NO3)3 Cr(NO3)3 Mn(NO3)2 Fe(NO3)3 Co(NO3)2 Co(NO3)3 Ni(NO3)2 Cu(NO3)2 Zn(NO3)2 Ga(NO3)3 Ge As Se Br Kr RbNO3 Sr(NO3)2 Y(NO3)3 Zr(NO3)4 Nb Mo Tc Ru Rh Pd(NO3)2 AgNO3 Cd(NO3)2 In Sn Sb Te I Xe CsNO3 Ba(NO3)2 Hf Ta W Re Os Ir Pt Au Hg2(NO3)2 Hg(NO3)2 Tl(NO3)3 Pb(NO3)2 Bi(NO3)3 Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Fl Uup Lv Uus Uuo ↓ La Ce(NO3)x Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac Th Pa UO2(NO3)2 Np Pu Am Cm Bk Cf Es Fm Md No Lr
Parmi les esters de nitrate en particulier organiques peuvent être cités :
Le nitrate de cellulose (plus connu sous le nom de « nitrocellulose »), abondamment utilisé comme explosif lors de la Première Guerre mondiale sous forme de fulmicoton, coton-poudre ou encore pyroxyle;
Le nitrate de peroxyacétyle (ou peroxyacetylnitrate ou NPA ou PAN), de formule CH3COO2NO2 qui est (comme l’ozone et les aldéhydes) un des polluants oxydants d'origine photochimique ; son origine est en partie naturelle, mais en grande partie anthropique.

 词典释义:
词典释义:

 盐
盐
 银棒
银棒 石
石 ;
; 盐;
盐;
 盐;
盐; 盐;
盐; ;
;
 盐
盐
 双氧铀
双氧铀
 铜
铜
 铁
铁
 汞
汞
 铋
铋
 铬
铬
 钴
钴
 高钴
高钴
 亚铜
亚铜
 高铈铵
高铈铵
 铝
铝
 铵
铵
 银
银
 肼
肼
 铀酰
铀酰
 脲
脲
 乙[盐、酯]
乙[盐、酯]
 钡
钡
 钙
钙
 钾
钾
 铋
铋
 铍
铍
 镉
镉
 钙铵
钙铵
 铈
铈
 胍
胍
 镧
镧
 锂
锂



 锰
锰
 汞铊
汞铊
 镍
镍
 镍铵
镍铵
 钯
钯
 铅
铅
 钾铵
钾铵
 锶
锶
 铊
铊
 钍
钍
 锌
锌
 锆
锆
 亚铁
亚铁
 亚锰
亚锰
 亚汞
亚汞
 盐还原酶
盐还原酶
 化
化 磷
磷 盐,
盐, 


 磷
磷 盐混合物
盐混合物
 水滑石
水滑石
 盐肉汤(培养基)
盐肉汤(培养基)
 盐
盐


![Niveaux de nitrates à la surface des océans[1]](https://wiki-gateway.eudic.net/wikipedia_fr/I/m/WOA05_sea-surf_NO3_AYool.png)