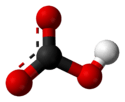
Le bicarbonate, ou hydrogénocarbonate, est un ion polyatomique dont la formule chimique est HCO3. Le bicarbonate doit son préfixe ("bi-") à son double caractère acido-basique (dit caractère amphotère) : il est à la fois acide et base, appartenant à deux couples acido-basiques différents. Il s'agit de la forme intermédiaire dans la double déprotonation de l'acide carbonique : ôter le premier proton (ion H) de l'acide carbonique donne le bicarbonate ; ôter le second proton donnera la forme carbonate ionique.
Le mot s'écrit au pluriel (bicarbonates) lorsqu'il s'agit des sels de l'ion bicarbonate: par exemple, le bicarbonate de sodium (souvent appelé « bicarbonate de soude » par abus de langage, ou « soda à pâte » et « petite vache » au Canada) de formule NaHCO3, qui est le sel de l'ion bicarbonate le plus répandu et le plus utilisé. Il contribue à la digestion par notre organisme.
Propriétés
Dans l'eau, le dioxyde de carbone, l'acide carbonique, l'ion bicarbonate et l'ion carbonate sont en équilibre, en fonction du pH :
CO2 + H2O H2CO3 H + HCO3 2 H + CO3.
L'ajout d'un acide déplace les équilibres vers la gauche (avec, éventuellement, dégagement de dioxyde de carbone), tandis que l'ajout d'une base les déplace vers la droite (avec, éventuellement, précipitation d'un sel carbonaté).
Applications
La transformation partielle des bicarbonates en contact avec des acides tel (l'acide acétique du vinaigre) en dioxyde de carbone gazeux est employée en cuisson pour permettre au pain de lever, et lors de la propulsion des fusées jouets.
Biologie humaine
Solution tampon
Le caractère amphotère du bicarbonate (sa place intermédiaire dans l'équilibre), lui fait jouer un rôle de tampon. Cette fonction de tampon des bicarbonates existe notamment dans le sang, avec un rôle très important pour le maintien du pH (cf. Homéostasie).
De nombreux organes interviennent dans la régulation du taux des bicarbonates, et donc du pH : principalement les poumons (par l'intermédiaire de l'élimination du dioxyde de carbone) et les reins. Le système digestif intervient également, par la sécrétion du suc gastrique acide (sous le contrôle de la sécrétine) et des sels biliaires fabriqués par le foie et sécrétés dans la bile.
Activation des enzymes digestives
La fonction exocrine du pancréas produit, par l'intermédiaire d'anhydrases carboniques, des ions bicarbonates HCO3 qui sont déversés dans le duodénum pour neutraliser l'acidité du chyme et ainsi activer les enzymes intestinales et les enzymes pancréatiques produites par cette même fonction exocrine.
Autres fonctions
Le bicarbonate sert à la synthèse de l'Uracile Mono Phosphate ( UMP ), précurseur des bases pyrimidiques de l'ADN.
碳酸氢盐是碳酸形成的酸式盐,含有碳酸氢根离子—HCO3。大多数碳酸氢盐对热不稳定,会分解为碳酸盐、二氧化碳和水。碱金属碳酸氢盐溶于水,水溶液呈碱性,与酸迅速反应放出二氧化碳气体,加碱则得到相应的正盐碳酸盐。
钾、钠和铵的碳酸氢盐溶解度都小于相应的正盐,这是由于HCO3通过氢键形成多聚链状离子。
碳酸氢根在生理学上也有很重要的作用,血液中含有H2CO3-HCO3组成的缓冲溶液,以抵御大幅度的pH值变化,为酶等生物分子维持适宜的酸碱度。
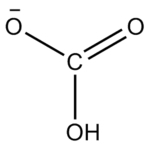
碳酸氢根(HCO3)为平面结构,碳位于中心,与三个氧原子键连。它是碳酸的共轭碱,也是碳酸根离子的共轭酸。水溶液中存在下列平衡,碳酸氢根既可发生电离生成水合氢离子,也会水解出氢氧根离子,水解程度大于电离,因此水溶液呈弱碱性。
- CO3 + 2 H2O ⇋ HCO3 + H2O + OH ⇋ H2CO3 + 2 OH
- H2CO3 + 2 H2O ⇋ HCO3 + H3O + H2O ⇋ CO3 + 2 H3O
例子
碳酸氢钠
碳酸氢钾
碳酸氢钙
碳酸氢铵

 词典释义:
词典释义:
 词:
词: 盐;
盐;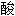 的;
的;

 ;
;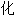
 ;
;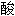 ;
; 盐;
盐; 氢盐,
氢盐,  式碳
式碳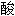 盐;
盐; 氢盐
氢盐