Le radium est l'élément chimique de numéro atomique 88, de symbole Ra.
Il est d'un aspect parfaitement blanc mais il noircit lors de son exposition à l'air libre. Le radium est un métal alcalino-terreux présent en très faible quantité dans les minerais d'uranium. Il est extrêmement radioactif, la demi-vie de son isotope le plus stable (Ra) étant 1 600 ans. Il fournit du radon comme produit de désintégration.
Marie Curie et son mari Pierre le découvrent en 1898 par extraction de la pechblende, un minerai d'uranium. Le mot radium est forgé à partir du latin radius (« rayon »), en même temps que le mot radioactivité.
Historique
Marie Curie et son mari Pierre étudiant le radium, dessin de André Castaigne.
Le radium a été découvert par Marie Curie et son mari Pierre le 21 décembre 1898, dans un minerai d'uraninite. Lors de l'étude de ce minéral, les Curie en avaient extrait tout l'uranium, pour constater que le reliquat était encore fortement radioactif. En juillet 1898, ils extraient de la pechblende un élément comparable au bismuth, qui s'avère être du polonium. Ils séparent ensuite un mélange radioactif formé principalement de deux composants : des composés de baryum, qui produit une flamme d'un vert brillant, et un composé radioactif inconnu qui donne des lignes spectrales de couleur carmin, qui n'avait jamais été précédemment décrit. Les Curie constatent que ce composé radioactif est très similaire aux composés de baryum, mais moins soluble. Cela permit aux Curie d'isoler ce composé radioactif et de découvrir un nouvel élément, le radium.
Les Curie annoncèrent leur découverte à l'académie des sciences le 26 décembre 1898.
L'élément fut baptisé « radium » vers 1899. Le mot est formé sur le latin radius, le rayonnement, pour rappeler le fort rayonnement radioactif de cet élément.
Le radium a été isolé sous forme métallique en 1910 par Curie et André-Louis Debierne. Ils procédèrent à une électrolyse d'une solution de chlorure de radium (RaCl2) sur une cathode de mercure, produisant ainsi un amalgame. Cet amalgame fut ensuite chauffé dans une atmosphère d'hydrogène pour éliminer le mercure, laissant le radium pur sous forme métallique. La même année, E. Eoler isola également le radium par décomposition thermique de l'azoture de radium, Ra(N3)2.
La première production industrielle du radium sous forme métallique a été réalisée par Biraco, filiale de l'Union minière du Haut Katanga (UMHK), dans son usine d'Olen en Belgique.
L'unité historique de radioactivité, le curie (en l'honneur de Pierre Curie décédé en 1906) correspond à la radioactivité d'un gramme de radium Ra, soit 37 gigabecquerels (37×10 Bq). En 1911, Marie Curie obtient le prix Nobel de chimie « en reconnaissance de sa contribution aux progrès de la chimie pour avoir découvert le radium et le polonium, avoir isolé le radium, et avoir étudié la nature et les composés de cet élément remarquable ».
Caractéristiques physiques et chimiques
C'est le plus dense des métaux alcalino-terreux avec lesquels il partage des caractéristiques (comportement assez proche de ceux du béryllium, magnésium, calcium, strontium et baryum) expliquant sa cinétique environnementale ou son métabolisme. L'élément qui lui est le plus proche est le baryum (autre cation divalent), mais le radium est moins bien étudié à cause des contraintes de radioprotection qu'impose sa radioactivité.
-
Propriétés physiques
Fraichement préparé, le radium pur est blanc et brillant, mais il noircit lorsqu'il est exposé à l'air (probablement par formation de nitrite Ra3N2). Sa densité est de 5,5 g/cm, plus élevée que celle du baryum. Son point de fusion est mal déterminé, entre 700 et 960 °C, et sa température d'évaporation est de 1 737 °C. Ces deux valeurs sont légèrement inférieures à celles du baryum, ce qui correspond à la tendance générale des éléments du goupe 2 .
De même que le baryum, le radium forme dans les conditions normales de température et de pression un réseau cristallin cubique centré, de maille 514,8 picomètres .
Le radium est luminescent (il émet une faible couleur bleue), et il est un peu plus volatil que le baryum.
-
Propriétés chimiques
De même que le baryum, le radium est un métal très réactif, et se retrouve généralement dans un degré d'oxydation de +2. Il s'hydrolyse dans l'eau par formation d'hydroxyde de radium. Il se présente en solution aqueuse sous forme de cation incolore Ra, très fortement basique.
Il ne forme pas facilement de complexe. La plupart des composés chimiques du radium sont donc formés de liaison ionique. Cependant, les électrons 6s et 6p (outre l'électron de valence 7s) pourraient participer à un effet chimique quantique relativiste renforçant le caractère covalent de la liaison avec des composés comme RaF2 ou encore RaAt2 .
Comme le baryum, il forme des sels solubles sous forme de chlorure, bromures et nitrates, alors qu'il est très faiblement soluble sous forme de sulfate, de carbonates, phosphates et phosphates acides. Ceci explique qu'en mer et dans les eaux saumâtres, la teneur de l'eau en ions libres de radium sera contrôlée par l'activité sulfate de l'eau. En pleine mer, il est à 70 % complexé sous forme de RaSO4 et pour le reste en grande partie complexé à la matière organique dissoute (en complexes organométalliques dont la stabilité diminue avec l'augmentation de la salinité). En présence de baryum et dans une eau riche en sulfate, il précipite en Ba RaSO4 .
Propriétés radiologiques
Radioactivité du radium 226
Le radium ne possède aucun isotope stable. L'isotope majoritaire, qui est celui historiquement découvert par les Curie, est le radium 226 (demi-vie : 1 600 a).
Présence dans les chaînes de désintégration
Le radium fait partie des chaînes de désintégration de l'uranium et du thorium, avec lesquels il peut se trouver en équilibre séculaire. Quatre de ses 25 isotopes possibles existent dans la nature à l'état de traces : Ra, Ra, Ra et Ra, tous les quatre radioactifs et tous issus de la dégradation radioactive d'autres radio-isotopes d'origine naturelle. On le rencontre donc en très petites quantités associé aux dépôts d'uranium, et à l'état de traces associé au thorium :
Une tonne de thorium 232 est en équilibre séculaire avec 0,4 µg de radium 228 (demi-vie de 5,75 ans) et 0,7 ng de radium 224 (demi-vie de 3,63 j)
Une tonne d'uranium naturel, formée majoritairement d'uranium 238, est en équilibre avec 360 µg de radium 226 (demi-vie de 1590 ans) ; et les 7,2 kg d'uranium 235 présents sont de leur côté en équilibre avec 0,55 ng de radium 223 (de demi-vie 11,4 jours).
Bien que ces quantités soient extrêmement faibles, la radioactivité induite (qui est inversement proportionnelle à la demi-vie) est très importante : le radium contribue autant que l'uranium à la radioactivité d'un minerai d'uranium, de même pour le thorium. Ainsi, l’activité moyenne du Ra dans la roche est de quelques dizaines de Bq/kg (becquerels par kilogramme), mais elle peut être mille fois supérieure dans les sols ou les zones riches en minerai d’uranium.
Aux premiers temps de l'étude de la radioactivité, les isotopes des chaînes de désintégration ne pouvaient pas être caractérisés par leurs propriétés chimiques, quand leur durée de vie était trop brève (inférieure à l'année), mais uniquement par leur radioactivité. Ils recevaient par conséquent un nom spécifique reflétant leur formation :
Ra (le premier découvert et le plus facile à isoler chimiquement) était le radium (Ra) ;
Ra (descendant de l'actinium 227 via le thorium 227) était nommé actinium X (AcX) ;
Ra (produit par le Thorium 232) était le mesothorium 1 (MsTh1) ;
Ra (descendant du Thorium 228, et du Thorium 232 à la quatrième génération) était nommé thorium X (ThX).
De même, les produits de désintégration successifs du Ra reçurent des noms formés sur radium, de « radium A » jusqu'à « radium G ».
Abondance relative
Les deux isotopes du radium que l'on peut isoler chimiquement sont Ra, descendant de l'uranium 238 et de 1 590 ans de demi-vie, et Ra, descendant du thorium 232 et de demi-vie de 5,739 années. Les autres sont plus difficilement isolables (Ra dont la demi-vie est de 11,1 jours et Ra dont la demi-vie est de 3,64 jours sont présents à des teneurs de l'ordre du nanogramme par tonne) et ne sont en pratique observés que par la radioactivité qu'ils engendrent.
Ses isotopes naturels sont utilisés pour dater certains matériaux radioactifs (baryte) rencontrés dans les forages gaziers ou pétroliers.
L'isotope à la durée de vie la plus longue, le radium 226 (Ra), représente en pratique la quasi-totalité du radium naturellement présent sur Terre.
Mesure de la radioactivité
Dans un échantillon de sol ou de produits végétaux ou animaux, ou encore dans les eaux minérales fortement chargées, le radium est mesuré directement par spectrométrie gamma, en association avec ses descendants à vie courte, (Pb et Bi), après mise à l’équilibre de l’échantillon pendant un mois (de manière à ce que l'équilibre se fasse avec le reste de ses descendants jusqu'au plomb-210).
Dans les eaux naturelles faiblement chargées, la mesure est effectuée par émanométrie du radon (Rn) : le radon dissous dans l’eau est dégazé par bullage et récupéré dans des fioles scintillantes pour effectuer la mesure.
Minéralogie du radium
Gisements
Section polie de pechblende.
Le radium est surtout présent à l'état de traces dans certains sous-sols anciens. Dans le sol, il est présent sous forme combinée et plus concentrée dans la pechblende, un minerai d'uranium, ainsi que dans d'autres minéraux d'uranium. Il faut environ trois tonnes de pechblende pure pour extraire un gramme de radium.
Le charbon contient des traces parfois significatives d'uranium et donc de radium, qu'on retrouve parfois dans les crassiers de cendres charbonneuses (issus des centrales thermiques ou de la sidérurgie) et parfois les fumées, quand elles ne sont pas filtrées. La combustion du charbon est une voie de dissémination du radium ; la teneur en Ra des cendres de charbon est de l’ordre de 120 Bq.kg .
Les schistes exploités (depuis 2004 principalement) pour le gaz de schiste en contiennent également, en quantité parfois importantes. De manière générale, plus un schiste est noir ; c'est-à-dire à haute teneur en COT (carbone organique total), plus il en contient. C'est le cas par exemple des schistes noirs du Dévonien de la région des Appalaches et en particulier de ceux du bassin de Marcellus.
Production minière
Le radium est extrait de minerais d'uranium, sa production minière est essentiellement associée à l'extraction de l'uranium. Aucun gisement n'est exploité pour son radium, mais la production d'uranium justifie l'extraction minière, et permet de rentabiliser la séparation du radium comme coproduit.
Jusque vers la fin du XVIII siècle, l'uranium n'avait pas d'application industrielle à grande échelle, et il n'y avait donc pas de mines d'uranium en tant que telles. Initialement, la seule source abondante de minerai d'uranium était la mine d'argent de Jáchymov (Sankt-Joachimsthal en allemand), alors située dans l'empire d'Autriche. Le minerai d'uranium était un produit dérivé des activités minières, rejeté comme stérile sous forme de pechblende.
Après que Pierre et Marie Curie eussent isolé le radium à partir du minerai de cette mine de Sankt-Joachimsthal, de nombreux scientifiques commencèrent à s'y intéresser, mais la disponibilité du radium resta longtemps faible. De petites entreprises rachetèrent les stériles de la mine, pour en isoler le radium en petites quantités. La mine fut rachetée par le gouvernement autrichien en 1904, et l'exportation de minerai brut fut suspendue.
La prise de contrôle de l'Autriche conduisant à un monopole, la demande croissante en radium conduisit les autres pays à une intense prospection pour trouver de nouveaux gisements d'uranium. Les États-Unis devinrent les premiers producteurs mondiaux au début des années 1910, par l'exploitation des sables de carnotite du Colorado. Mais les gisements les plus riches découverts à cette époque se situaient au Congo belge, et dans les régions du Grand lac de l'Ours et du Grand Lac des Esclaves au Canada.
La production de radium a toujours été faible ; par exemple, en 1918, les États-Unis ne produisirent qu'un total de 13,6 g de radium. En 1954, il n'y avait au total que 2,3 kg de radium disponible sous forme purifiée dans le monde, et ce chiffre n'a guère augmenté de nos jours, la production mondiale n'étant que de l'ordre de 100 g par an .
Les principaux producteurs de radium sont la Belgique, le Canada, la République tchèque, la Slovaquie, le Royaume-Uni, et les anciens États de l'Union soviétique.
Applications
Les rares applications du radium proviennent toutes de ses propriétés radioactives.
Applications médicales
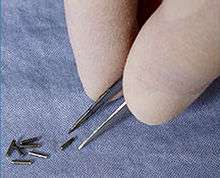
Une brachythérapie est souvent appliquée au cancer de la prostate : de petites aiguilles radioactives sont implantées directement dans la tumeur.
La curiethérapie de contact a commencé en 1901, peu après la découverte de la radioactivité par Henri Becquerel en 1896, quand Pierre Curie a suggéré à Henri-Alexandre Danlos qu'une source radioactive peut être insérée dans une tumeur.
Des sources de radium ont été utilisées en curiethérapie, traitement où source radioactive scellée est placée à l'intérieur ou à proximité immédiate de la zone à traiter, généralement sous forme d'aiguilles contenant du radium. Les tumeurs peuvent ainsi être traitées avec des doses très élevées de radiations localisées, en réduisant la probabilité de dommages pour les tissus sains environnants
À la suite de l'intérêt initial pour la curiethérapie en Europe et aux États-Unis, son utilisation a diminué au milieu du XX siècle en raison des problèmes d'irradiation des opérateurs dus à l'application manuelle des sources radioactives.
La mise en évidence de ses vertus thérapeutiques dans la lutte contre le cancer a donné naissance à la radiothérapie, encore utilisée de nos jours.
L'isotope Ra est par ailleurs le seul radioisotope commercialisé pour une application en alpha-immunothérapie, sous forme de chlorure.
Source de luminescence
L’extrémité de l’aiguille et les points du cadran de cette ancienne horloge ont été rendus fluorescents par incorporation de sels de radium.
Le radium a été utilisé jusqu'aux années 1950, pour ses propriétés de photoluminescence, dans des peintures destinées à l’horlogerie, à l’aviation et aux dispositifs de signalisation de secours. La première utilisation identifiée a été celle du D George F. Kunz, qui avait peint au radium les aiguilles de sa montre pour les voir dans l'obscurité, et déposa un brevet sur ce procédé en septembre 1903.
La demande en cadrant luminescent entraina une hausse rapide de la production, réalisée par la société US Radium Corp, bientôt en position de monopole sur le marché américain.
À partir des années 1920, des maladies potentiellement professionnelles furent identifiées chez les ouvrières, qui affinaient leurs pinceaux de peinture, enrichie en radium, en les portant à leur bouche. Ces maladies conduisirent à une première enquête épidémiologique, et à la fermeture de l'usine du New Jersey en 1926 . L'enquête menée par le ministère du travail déboucha en 1929 sur la publication d'un rapport, Radium Poisoning, recommandant des mesures de protection des employés (en particulier l'interdiction de sucer les pinceaux), et recommandant d'éviter d'utiliser du radium comme source luminescente.
Cette pratique a entraîné quelques dizaines de décès chez les ouvrières (46 cas sur 1747 employés). Aucun symptôme n’a été observé chez les peintres ayant reçu moins de 1 000 fois la dose d’irradiation naturelle par le Ra absorbée par les individus non exposés, ce qui suggère l’existence d'un seuil pour les affections malignes induites par le radium.
L'utilisation du radium comme source de photoluminescence a été assez rapidement abandonnée, le radium étant remplacé dans cet usage par le tritium beaucoup moins dangereux pour la santé (mais en revanche moins durable).
Source de ionisation
Dès 1914, le physicien hongrois Béla Szilárd propose de renforcer l'ionisation naturelle autour des installations de protection foudre avec des sources radioactives placées à proximité de la pointe des paratonnerres. L'idée aboutit à la commercialisation de paratonnerres radioactifs, plus simplement surnommés parads. Ces « Parads » ayant une activité de quelques dizaines de MBq pour les émetteurs alpha, et pouvant atteindre 1 GBq pour d'autres.
Cet effet n'a pas été démontré. Les doutes sur la validité du procédé, compte tenu de la difficulté de prouver son efficacité, émergèrent dans les années 1970, et ce système n'est plus commercialisé. De nombreux pays ont été jusqu'à les interdire à partir des années 1980, en 1985 en Belgique, et 1 janvier 1987 pour la France. Certains pays (Belgique et Luxembourg notamment) imposent un démontage de ces paratonnerres radioactifs (parad). Depuis le 11 mars 2011 un site Internet d'intérêt collectif réalise l'inventaire et la localisation des dizaines de milliers de parads disséminés sur le territoire français. Il fait notamment appel à la mobilisation civique des internautes. Ils sont à présent remplacés par des détecteurs
Le radium est également utilisé comme source radioactive scellée dans des détecteurs ioniques de fumée, pour ioniser le volume d’air circulant dans l’appareil. En présence de fumée, la conductivité électrique de ce volume diminue, ce qui déclenche l’alarme. Interdits pour un usage domestique, ces détecteurs s’emploient souvent dans les immeubles de bureaux ou les lieux publics. Ils sont remplacés par des technologies alternatives (détecteurs optiques) d’un niveau équivalent de fiabilité, mais sans risque sanitaire et environnemental.
Engouement populaire
Pot de crème Tho-Radia (en).

Une fontaine de radium : l'eau passe par une capsule de sels de radium et devient radioactive (1930).
Le radium a connu un fort engouement après sa découverte au début du XX siècle par Marie Curie, en particulier après la mise en évidence de ses vertus thérapeutiques. Des crèmes rajeunissantes (Tho-Radia (en)) aux cigarettes, des sodas atomiques aux poudres de riz, dentifrices ou sels de bains, talc pour bébé, des fontaines à radium (le Revigator (en) pour boire de l'eau radioactive).
Le radium est utilisé un peu partout avant d'être interdit en 1937 pour les utilisations non médicales, plusieurs décès ayant été observés à l'institut du Radium de Londres consacré aux applications médicales.
Le radium est si cher qu'il est incorporé en quantité infime, comme le confirme le certificat d’analyse du Laboratoire de recherches scientifiques de Colombes en date du 18 juillet 1932 sur la crème Tho-Radia qui contient « 0,233 microgramme de bromure de radium (RaBr2, H20) [ce qui correspond à environ 4500 Bq] pour 100 grammes de crème », .
Le radium dans l'environnement
Radium en solution
Le radium peut passer dans l'hydrosphère par lessivage de minerais, ou y être directement produit par l'uranium ou le thorium déjà dissout dans l'eau. La concentration du Ra peut être importante dans les eaux d’infiltration des mines d’uranium, que ce soit par sa mise en contact avec le minerai d'uranium, mais plus encore par le lessivage des résidus de traitement, pour lesquels le minerai a été concassé pour en extraire l'uranium, ce qui rend le radium d'autant plus mobile.
Même si les quantités correspondantes sont infinitésimales, elles peuvent être détectées par la radioactivité qu'elles induisent, qui est d'autant plus forte que la demi-vie du radionucléide est faible.
Les deux isotopes du radium les plus fréquents dans la mer sont Ra et Ra. Les autres sont plus rarement observés. Ils servent parfois de radioélément traceur (par exemple pour repérer les vidanges naturelles de nappes d'eau souterraine en mer, notamment autour de la Sicile). On les trouve aussi en faible dose dans les océans (avec de fortes variations temporelles des teneurs pouvant traduire des modifications de courants), dans certains lacs ou dans certaines eaux souterraines sources accidentellement ou naturellement radioactives. On en trouve d'infimes quantités dans certaines nappes phréatiques utilisées pour alimenter des réseaux d'eau potable, et en quantité plus significative (plus rarement) dans certains forages profonds (par exemple proches de failles et/ou de massifs souterrains uranifères ; ex. : jusqu'à 23 pCi/Litre de Ra et 3 300 pCi/Litre de Rn dosés dans certains des puits du nord-ouest et sud-ouest du comté de Harris au Texas). La mer Morte est un cas particulier avec une radioactivité en radium différentiée : passant de 114,5 dpm/kg dans les eaux de surface, à 97,8 dpm/kg en profondeur (avec une couche de transition de 25 m d'épaisseur environ, à une profondeur de 150 à 175 m). Les données sur le radon dans cette mer ont servi à mesurer la durée de la méromicticité.
Dégazage de radon
Le marquage au radium 226 est peu dangereux par lui-même, mais le radium 226 se désintègre en radon 222, gaz radioactif, qui peut conduire à des doses importantes de rayonnement dans les habitations.
Le radon est produit au même débit que dans le minerai d'uranium d'origine, mais peut dégazer beaucoup plus facilement d'un substrat non consolidé (résidus d'extraction de l'uranium ou du thorium) et se répandre dans l'atmosphère. Il est susceptible de poser des problèmes de santé publique quand il s'accumule dans des locaux insuffisamment ventilés (au-delà de 1 000 Bq⋅m).
Un microgramme de radium, qui présente une activité de 37 000 Bq, se met rapidement en équilibre séculaire avec la même activité de radon. Si ce radon ne rencontre pas d'obstacle à sa diffusion (par exemple, si le radium est en solution aqueuse dans un récipient non bouché), il est alors susceptible de saturer une pièce de taille moyenne à des niveaux de l'ordre de 1 000 Bq⋅m.
Bioaccumulation
Le seul isotope susceptible d'avoir un rôle dans la biosphère est le radium 226 produit par l'uranium 238 ; les autres isotopes ont une production et une durée de vie beaucoup trop faibles pour jouer un rôle comparable.
Au moins dans certaines conditions (et par certaines espèces), le radium semble biodisponible, bioassimilable et susceptible d'être bioconcentré, voire bioaccumulé. Par exemple une espèce australienne de moule d'eau douce (Velesunio angasi) a été étudiée dans le cadre d'un suivi scientifique (avec biomonitoring depuis 2001) de billabongs (bras morts restant en eau en saison sèche) du ruisseau Magela drainant le bassin où est situé la mine d'uranium Ranger. Ces moules avait été trouvées les plus contaminées à 20 km en aval du site minier. Elles se sont montrées capables de concentrer le radium ; dans ce cas, le radium semble prendre la place du calcium dans l'organisme, mais d'autant moins que le calcium est abondant dans le milieu. Il a une demi-vie biologique assez longue, estimée (par modélisation) à environ 13 ans pour cette espèce). Comme souvent avec les animaux filtreurs, le facteur de concentration de radium s'est montré élevé chez les moules du bassin versant de la rivière Magela (30 000 à 60 000 fois la teneur du milieu pour la chair de la moule, mais du radium pourrait aussi être accumulé dans les coquilles). Peu avant, sur les bassins de lagunage de cette mine, puis en microcosme, on avait déjà montré (2004) que la plante aquatique Eleocharis dulcis bioaccumulait lentement mais efficacement de l'uranium dans ses racines et rhizomes après l'avoir capté dans l'eau.
Risques sanitaires
Les premières observations sur les effets biologiques du radium sont réalisées accidentellement par Henri Becquerel. Transportant dans la poche de son gilet une ampoule de radium, il constate au bout de quelques heures une rougeur sur sa peau qui se transforme en brûlure. Pierre Curie confirme cette observation en expérimentant sur lui-même, s'infligeant une brûlure profonde qui mettra plus de deux mois à cicatriser. Cette observation marque à la fois le début de la radiothérapie et celui de la radioprotection.
Les risques sanitaires associés au radium sont de plusieurs types :
Sous forme concentrée, son émission gamma conduit à une irradiation externe qui peut être importante : un tube contenant 1 milligramme de radium délivre à 10 cm une dose de 0,8 millisievert par heure, débit de dose au-dessus duquel des effets nuisibles apparaissent in vivo.
Même à l'état de traces il peut être ingéré (en solution ou porté par des aliments) et conduire par accumulation à une irradiation interne.
Des concentrations significatives, notamment dans des résidus industriels ou miniers, peuvent dégazer du radon à des niveaux importants.
Sites marqués au radium
Séquelles industrielles

Aiguilles au radium.

Papier photographique impressionné par le rayonnement de la pechblende.
D'anciens sites de production ou d'utilisation de radium ont laissé des séquelles de pollution.
À titre d'exemple, il est nécessaire de dépolluer l'ancien site de production de radium de la SATCHI (Société anonyme des traitements chimiques) qui a produit du radium entre 1913 et 1928, en Seine-Saint-Denis. L'IRSN a confirmé et caractérisé la pollution radioactive. Le débit de dose en surface (mesuré à 50 cm du sol) démontre une pollution sur environ 1/4 du site ; avec une radioactivité « jusqu’à 110 fois la valeur du bruit de fond (8 µSv/h) ». Autour du site, 5 zones sont polluées en surface selon l’IRSN (localisées sur le site Unibéton, avec environ 10 fois le bruit de fond), sur le site Partena (2 à 6 fois le bruit de fond), sur la berge Est de la Seine (25 fois le bruit de fond) et sur la berge Ouest (6 à 15 fois le bruit de fond). Le sol est également pollué en profondeur, avec sur le site de la SATCHI, et au-delà, une activité massique variant de 750 à 10 000 fois le bruit de fond naturel régional. Sur les sites périphériques étudiés, on dépasse de 10 à 245 fois le bruit de fond naturel régional. L'IRSN a estimé à 15 000 et 20 000 m (estimation majorante) le volume de terres ainsi marquées radiologiquement. Ces débits de dose qui ne dépassent pas 10µSv/h restent assez largement en dessous de ceux (de l'ordre de 40µSv/h) en dessous desquels il n'y a pas d'effet mesurable aux populations de plantes et d'animaux, et quelqu'un présent un an et demi en continu sur ces points chauds pour risquerait d'accumuler une dose supérieure à celle (de l'ordre de 100 mSv) au-dessous de laquelle aucun pathologique n'a jamais été constaté.
La nappe aquifère s'est aussi montrée polluée essentiellement par les isotopes 235 et 238 de l'uranium en aval hydraulique du site de la SATCHI (avec dépassement de la norme eau potable pour le rayonnement alfa (0,1 Bq/l). Une émission anormale de radon est détectée dans les bâtiments du site de la SATCHI (2 à 5 fois le niveau moyen de Seine-Saint-Denis qui est 34 Bq/m). Sur le site de Partena, on a atteint lors des mesures 2 300 Bq/m dans certaines pièces et 26 000 Bq/m dans une cave. Ces valeurs sont nettement supérieures aux limites d'intervention (1 000 Bq/m) et justifient de mettre en œuvre des mesures correctives (par exemple, assurer une meilleure ventilation du bâtiment).
L'exploitation du gaz de schiste, par fracturation hydraulique notamment est devenu une source de pollution significative en radium. Les échantillons de ces puits en contiennent plusieurs fois plus que ceux des puits de pétrole ou de gaz de l’État de New York. Même après traitement, les eaux usées des industriels gaziers en contiennent encore des quantités anormales en 2013), qui peut par exemple menacer les ressources en eau potable de l'État de New York. À la suite de la détection de radium 226 dans les cours d’eau drainant le champ gazier d'extraction de gaz de schiste dit Marcellus Shale (et depuis 2004, c'est-à-dire depuis que le gaz de schiste est exploité en plus du pétrole, le volume d'eaux sales à traiter a augmenté de 570 % selon Brian Lutz (professeur adjoint de biogéochimie à l’université d’État de Kent (Ohio) ; à la suite d'une étude de l'EPA, le DOE et le département de la Santé de l’État de New York) et General Electric devront dépenser 2 millions de dollars sur 2 ans pour décontaminer des sols et sédiments pollués par la radioactivité libérée dans les rivières à partir des produits utilisés ou remontés par les fluides de fracturation et de forage. Selon Gasfrac (l'entreprise qui a inventé le fracking au propane), la fracturation par le propane liquide serait une alternative intéressante ne consommant pas d'eau et diminuant le risque de pollution par le radium, mais c'est un produit explosif dont la manipulation est dangereuse.
Réhabilitation des sites
Depuis la fin des années 1990, l’État a construit progressivement le dispositif de prise en charge des sites pollués par des substances radioactives en France. La plupart des sites sont liés à des activités du passé, datant de l’entre-deux-guerres et qui ne relevaient pas de l’industrie nucléaire. C’est notamment le cas des sites pollués artificiellement par du radium.
Avec le « fonds radium », des mécanismes financiers et des solutions techniques ont pu être mis en œuvre pour gérer des situations de pollutions radioactives avérées. Au début des années 2000, l’Office de protection contre les rayonnements ionisants (OPRI) a réalisé, sur demande du ministère de la Santé, des contrôles sur les sites potentiellement pollués que cet organisme connaissait. De plus, un guide méthodologique sur la gestion des sites industriels potentiellement pollués par des substances radioactives a été élaboré en 2001. Enfin, depuis 2006, la loi confère à l’Agence nationale pour la gestion des déchets radioactifs (Andra) la mission d’intérêt général de gestion des déchets radioactifs et la remise en état de sites pollués par des substances radioactives, à la demande du propriétaire ou des pouvoirs publics en cas de responsable défaillant. Ce dispositif a été complété avec la création en 2007 de la Commission nationale des aides dans le domaine radioactif (Cnar).
-
Les différents cas de figure de sites pollués au radium
Quatre cas de figure liés au radium ont été identifiés par les pouvoirs publics français: les sites ayant abrité des activités de recherche sur le radium ; les sites ayant abrité une activité industrielle d’extraction de radium ; les sites ayant utilisé du radium à des fins médicales ou artisanales ; les particuliers qui possèdent des objets contenant du radium (réveils, montres, fontaines au radium).
L’État français a traité prioritairement des sites dont la pollution était avérée et significative. Pour les deux premières catégories de sites, des opérations de réhabilitation ont lieu depuis plus de 15 ans (Institut du radium à Arcueil, sites de L'Île-Saint-Denis, Gif-sur-Yvette, Nogent-sur-Marne, Saint-Nicolas-d'Aliermont, etc.). Ces sites sont aujourd’hui dépollués ou en cours de dépollution. Concernant les objets détenus par les particuliers, une démarche nationale de reprise à titre gratuit a été lancée par les pouvoirs publics ; chaque année, une centaine objets est récupérée par l'Andra, toutefois la question du devenir de ces déchets reste entière.
-
Sites ayant utilisé du radium à des fins médicales ou artisanales
Le travail de recensement des sites ayant abrité une activité utilisant du radium s’est terminé en 2009. Ces sites ont accueilli dans le passé des activités médicales et artisanales (fabrication horlogère) utilisant cet élément dans de faibles quantités. Ces activités, exercées il y a plusieurs décennies, ont pu laisser des traces de radium sur les lieux de leur utilisation. Ces sites nécessitent un diagnostic consistant à rechercher, par des mesures, la présence éventuelle de traces de radium ou d’en confirmer l’absence.

 词典释义:
词典释义:
 ;
;
 ;
; 子
子 ;
; ;
;



