Le silicium est l'élément chimique de numéro atomique 14, de symbole Si. C'est un membre du groupe des cristallogènes.

Poudre de silicium.
C'est l'élément le plus abondant dans la croûte terrestre après l'oxygène, soit 25,7 % de sa masse, mais il n'est comparativement présent qu'en relativement faible quantité dans la matière constituant le vivant. Il n'existe pas dans la nature à l'état de corps pur, mais sous forme de composés : sous forme de dioxyde de silicium (SiO2), d'origine biogène (fabriqué par un organisme vivant comme les diatomées ou les radiolaires), on le trouve sous forme de silice amorphe (dans le sable, ou d'origine lithogénique lorsqu'il est sous la forme de silice minérale, le quartz, la cristobalite, etc.), ou d'autres silicates (dans les feldspaths, la kaolinite…).
Sous sa forme amorphe, la silice (SiO2) provenant généralement de la terre de diatomées, est utilisée depuis très longtemps comme composant essentiel du verre. Il a depuis le milieu du XX siècle de nouveaux usages en électronique (transistor), pour la production de matériaux tels que les silicones ou, pour fabriquer des panneaux solaires photovoltaïques et en tant que biominéral, la silice amorphe est actuellement étudiée pour ses utilités en nanotechnologie.
Le nom dérive du latin silex, silicis qui signifie caillou ou silex.
Confusion possible : en anglais, silicon désigne le silicium, silicone désigne le silicone et silica désigne la silice.
Caractéristiques

Polycristal de silicium.
Les cristaux de silicium sont gris à noirs, en forme d'aiguille ou d'hexaèdres (forme cubique). La phase amorphe est une poudre marron foncée.
Le silicium est un semi-conducteur, sa conductivité électrique est très inférieure à celle des métaux. Insoluble dans l'eau (sauf à haute température), il est attaqué par l'acide fluorhydrique (HF) ou un mélange acide fluorhydrique/acide nitrique (HNO3) en fonction de la phase.
Il présente des reflets métalliques bleutés, mais n'est pas du tout aussi ductile que les métaux.
Il existe trois isotopes naturels du silicium : Si (92,18 %), Si (4,71 %) et Si (3,12 %). Il existe également des isotopes artificiels instables : Si, Si et Si qui sont émetteurs β, ainsi que Si à Si qui sont émetteurs β.
Cristallographie
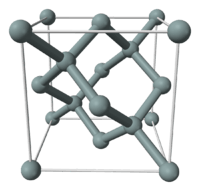
Maille élémentaire de type diamant du silicium.
Le silicium a une structure de type diamant (comme le germanium et la forme diamant du carbone), avec un paramètre de maille de 0,5430710 nm.
Histoire
Un des composés du silicium, la silice (dioxyde de silicium), était déjà connu dans l'Antiquité. La silice a été considérée comme élément par les alchimistes puis les chimistes. C'est un composé très abondant dans les minéraux.
Du silicium a été isolé pour la première fois en 1823 par Jöns Jacob Berzelius. Ce n'est qu'en 1854 que Henri Sainte-Claire Deville obtient du silicium cristallin.
Utilisations et applications
Synthèse des silicones
La synthèse des silicones représente également une utilisation importante du silicium (environ 40 % de la consommation). Ces polymères [(CH3)2SiO]n sont utilisés dans des mastics pour joint, des graisses résistantes à l'eau ou conductrices de la chaleur, les poudres lessivielles ou les shampoings conditionneurs, etc.
Semi-conducteur
Les propriétés de semi-conducteur du silicium ont permis la création de la deuxième génération de transistors, puis les circuits intégrés (les « puces »). C'est aujourd'hui encore l'un des éléments essentiels pour l'électronique, notamment grâce à la capacité technologique actuelle permettant d'obtenir du silicium pur à plus de 99,999 99 % (tirage Czochralski, zone fondue flottante).
Photovoltaïque

Cellule photovoltaïque en silicium.
En tant que semi-conducteur, le silicium est aussi l'élément principal utilisé pour la fabrication de cellules solaires photovoltaïques. Celles-ci sont alors montées en panneaux solaires pour la génération d'électricité.
Composants mécaniques
Le silicium présente à l'état pur des caractéristiques mécaniques élevées qui le font utiliser pour la réalisation de petites pièces destinées à certains micromécanismes et même à la fabrication de ressorts spiraux destinés à des montres mécaniques haut de gamme.
Alliages aluminium-silicium
La principale utilisation du silicium en tant que corps simple est comme élément d'alliage avec l'aluminium. Les alliages aluminium-silicium (AS ou série 40000 suivant NF EN 1780-1, également appelés « sialumins ») sont utilisés pour l'élaboration de pièces moulées, en particulier pour l'automobile (par exemple jantes en alliage) et l'aéronautique (par exemple éléments de moteurs électriques embarqués). Les alliages aluminium-silicium représentent à peu près 55 % de la consommation mondiale de silicium. L'alliage le plus connu est l'Alpax, proche de la composition eutectique (env. 13 %m de Si).
Micro et nanostructure
Du fait de la performance des procédés de gravure et de formation de forme avec le silicium, le silicium est utilisé pour :
la formation de silicium nanoporeux pour dissocier l'hydrogène de l'oxygène de molécule d'eau dans les piles à combustibles ;
la formation de nanopics sur une surface de silicium par Gravure Ionique Réactive (RIE) en vue de relier des puces de semi-conducteur.
Composés
Outre les propriétés du silicium élémentaire, de nombreux composés du silicium possèdent des applications. Parmi les plus connus :
la silice se trouve dans la nature sous forme compacte (galets, quartz filonien par exemple), ou sous forme de sable plus ou moins fin. On l'obtient aussi industriellement, sous forme pulvérulente (silice synthétique). Elle a de nombreux usages : le verre est fabriqué depuis des millénaires en faisant fondre du sable principalement composé de SiO2 avec du carbonate de calcium CaCO3 et du carbonate de sodium Na2CO3. Le verre peut être amélioré par différents additifs, le sable de silice est un des composants des céramiques, le quartz forme de superbes cristaux. Il est utilisé comme matériau transparent, plus résistant à la chaleur que le verre (ampoule de lampes halogènes). Il est également beaucoup plus difficile à fondre et à travailler, la silice intervient aux côtés du noir de carbone dans la fabrication des pneumatiques économes en énergie (pneus « verts »), la silice très fine est utilisée comme adjuvant pour les bétons à haute performance ;
le verre est fabriqué depuis des millénaires en faisant fondre du sable principalement composé de SiO2 avec du carbonate de calcium CaCO3 et du carbonate de sodium Na2CO3. Le verre peut être amélioré par différents additifs,
le sable de silice est un des composants des céramiques,
le quartz forme de superbes cristaux. Il est utilisé comme matériau transparent, plus résistant à la chaleur que le verre (ampoule de lampes halogènes). Il est également beaucoup plus difficile à fondre et à travailler,
la silice intervient aux côtés du noir de carbone dans la fabrication des pneumatiques économes en énergie (pneus « verts »),
la silice très fine est utilisée comme adjuvant pour les bétons à haute performance ;
le ferrosilicium et le silicocalcium sont utilisés comme éléments d'addition dans l'élaboration d'aciers ou de fontes ;
le carbure de silicium possède une structure cristalline analogue à celle du diamant ; sa dureté en est très proche. Il est utilisé comme abrasif ou sous forme céramique dans les outils d'usinage ;
le silicate de calcium CaSiO3 est un des composants des ciments.
Dans la nature
Après l'oxygène, c'est l'élément le plus abondant dans la croûte terrestre.
Minéraux
Le silicium sur Terre se trouve essentiellement sous forme minérale, et en particulier sous forme de silicates, qui constituent 28 % de la croûte terrestre. Le silicium est par exemple constitutif du sable de silice, résultat de la dégradation de roches comme le granite.
Molécules organiques
Le silicium se trouve dans certaines molécules organiques, comme les silanes — méthylsilanetriols, diméthylsilanediol —, les silatranes.
Biologie du silicium
Les diatomées et les radiolaires, présents dans le plancton qui est au tout début de la chaîne alimentaire des mers et des océans, participent au cycle géochimique du silicium. Ils extraient la silice de l'eau de mer pour former leur squelette externe. L'eau de mer est relativement pauvre en silice sauf dans les grandes profondeurs (dissolution des squelettes des diatomées) et au voisinage des estuaires. Il ne remonte à la surface qu'à la faveur des upwellings (remontées d'eau). Il y a alors une production importante de plancton. Mais la source la plus renouvelée de silice dans les océans se trouve dissoute dans l'eau des fleuves qui s'y jettent, mais aussi dans leurs limons. Elle a été arrachée aux massifs montagneux et aux terrains traversés par l'eau des sources, des torrents et des rivières. C'est d'ailleurs dans l'estuaire des fleuves que l'on trouve le plus de poissons. Comme ils se trouvent en haut de la chaîne alimentaire marine, il faut considérer que c'est parce qu'ils trouvent là du plancton en quantité. Il faut donc s'interroger sur les quantités importantes de limon piégé au fond des barrages dans les bassins des fleuves dans le monde entier. Cela pourrait bien retentir sur le stock actuel des poissons dans les océans qui est en forte décroissance.
L'organisme humain contient de l'ordre de 7 g de silicium.
Le silicium se retrouve associé aux glycosaminoglycanes et aux polyuronides : chondroïtine sulfate, dermatan-sulfate, kératan-sulfate, héparan-sulfate et héparine. Il est aussi impliqué dans la synthèse du collagène (3 à 6 atomes de Si par chaine alpha) et de l'élastine. L'aorte se trouve être le tissu qui en contient le plus avec la peau et le thymus. Le taux de silicium dans ces tissus diminue avec l'âge dans des proportions très importantes : perte de l'ordre de 80-90 % (étude chez le lapin). La diminution du silicium dans les parois artérielles est corrélée avec la fragmentation de l'élastine et à la perte de son élasticité. Plus une artère est athéroscléreuse moins elle contient de silice et plus elle est rigide.
Un régime riche en cholestérol provoque une athérosclérose expérimentale chez le lapin. L'administration de silicium organique prévient la fragmentation des fibres d'élastine. Un tuyau rigide conduit moins bien un débit qu'un tuyau souple. La restauration de l'élasticité artérielle - la compliance - aiderait sans aucun doute à diminuer l'hypertension artérielle.
Le silicium est impliqué dans la fixation du calcium (Ca) au niveau du squelette. La bordure ostéoïde, zone où se fabrique l'os, présente un pic de concentration en silicium qui ne se retrouve pas dans l'os mature. Le silicium potentialise l'action du Zinc (Zn) et du Cuivre (Cu).
Le silicium participe au fonctionnement du système immunitaire. Le thymus qui en contient des quantités importantes est l'organe où se « programment » les lymphocytes T. Il faut aussi signaler que les macrophages ont un très grand appétit pour elle et recyclent la silice localement en excès (poumons par exemple). Il est également impliqué dans la synthèse des anticorps (immunoglobulines).
Pour certains, notre réserve de silicium diminuerait drastiquement avec l'âge. En fait, il existe surtout une modification de la répartition du silicium dans l'organisme : certains tissus voient leur taux baisser drastiquement (peau, artères, thymus, cartilages, etc.), d'autres « s'empoussièrent » de façon importante comme les poumons et les ganglions qui leur sont associés du fait de leur grande richesse en macrophages. Si le bilan du silicium total en fonction de l'âge pourrait bien s'équilibrer en termes de quantité, la disponibilité effective pour les métabolismes semble bien diminuer avec l'âge. Ceci est à mettre en rapport avec l'insuffisance d'apport alimentaire et la carence progressive de l'organisme en molécules organiques qui contiennent des motifs « ène-diol ». Ceux-ci modifient la valence du silicium et forment avec lui des complexes hyper-valents (penta- ou hexa-) de forte importance biologique. Parmi ces molécules les polyphénols (antioxydants), certains neuro-médiateurs issus du métabolisme de la tyrosine (adrénaline, dopamine) ou du tryptophane (sérotonine, mélatonine), et surtout l'acide ascorbique (vitamine C). Il n'est donc pas certain que les apports alimentaires quotidiens soient couverts dans toutes les tranches de population, en particulier celles qui ont des besoins accrus ou des carences dues à une alimentation peu diversifiée et pauvre en fruits et légumes et autres aliments riches en polyphénols antioxydants (enfants en croissance, femmes enceintes, vieillards) ou personnes qui ont des besoins accrus. Ainsi les accidents musculo-squelettiques sont fort nombreux chez les sportifs (entorses, tendinites, claquages, micro-fractures, et.). Ces accidents mettent en cause des structures anatomiques comme l'os où le silicium est un facteur primordial de sa synthèse ou d'autres, comme les tendons, les ligaments ou les muscles, qui contiennent des quantités importantes de silicium (élastine, collagène). L'application par voie externe d'un gel contenant des complexes organiques à base de méthylsilanetriol qui traversent la barrière cutanée, est d'un grand intérêt thérapeutique.
Certaines plantes comme la prêle, le bambou, l'ortie, l'avoine qui contiennent des quantités importantes de silicium sont très utilisées en phytothérapie et en cosmétologie (ortie, avoine). Le séchage inconsidéré de ces plantes annihile une partie des effets bénéfiques car la silice polymérise. D'autres plantes utilisées en alimentation humaine comme le riz, le blé, la pomme (pectine), etc. en contiennent également des quantités notables, surtout dans les enveloppes, d'où l'intérêt de consommer du riz ou blé complet. Certaines eaux minérales, le vin, la bière surtout peuvent aussi être considérées comme des sources notables. L'Afssa (Agence française de sécurité sanitaire des aliments) n'a pas défini d'apports nutritionnels conseillés pour le silicium. Les besoins sont généralement considérés comme largement couverts par l'alimentation, sans qu'aucune étude vraiment sérieuse avalise cette assertion.
Le terme de « silicium organique » est approprié quand des chimistes ajoutent un (ou plusieurs) atome(s) de carbone sur un atome de silicium, ce qui donne par exemple un monométhylsilanetriol ou un diméthylsilanediol. L'association contrôlée d'une molécule organique appropriée (un salicylate par exemple) au monométhylsilanetriol forme un complexe doté de propriétés intéressantes, comme la possibilité de traverser en profondeur le revêtement cutané. Ce genre de complexes est très utilisé en cosmétologie comme anti-rides par comblement inter-cellulaire et effet tenseur. Cela est dû à une synthèse favorisée du collagène et de l'élastine.
Un tel complexe a aussi été utilisé en thérapeutique humaine sous le nom de spécialité de Conjonctyl, avec comme indication les ischémies circulatoires (cérébrales, coronaires, mésentériques, des membres), les ostéoporoses, les mastodynies et mastoses, ainsi que les états d'asthénie physique et/ou psychique du vieillard. Seulement l'Autorisation de Mise sur le Marché (AMM) pour ces indications a été retirée, faute pour le laboratoire producteur de pouvoir produire des évidences cliniques récentes, évaluées scientifiquement. Le Conjonctyl a récemment été ré-autorisé en tant que dispositif médical par injection intradermique pour le comblement des dépressions cutanées (rides, cicatrices).
Biochimie du silicium
Il a été évoqué la possibilité d'une toute autre forme de vie basée principalement sur le silicium et non pas le carbone. Ceci pourrait se fonder sur le fait que le silicium est non seulement tétravalent comme le carbone, mais qu'il est susceptible de former des complexes penta- et hexa-coordinés chargés et stables. Ceux-ci pourraient avoir des propriétés catalytiques intéressantes qui ont été peu explorées dans les hypothèses exobiologiques. Toutefois il faut remarquer l'extrême difficulté du silicium à former des liaisons multiples qui sont nécessaires au fonctionnement des échanges dans la cellule. Les exemples de molécules de silicium présentant des liaisons multiples ou des valences différentes de IV sont possibles uniquement avec des substituants particulièrement complexes. Un moment donné des recherches de médicaments contenant du silicium ont été menées et finalement n'ont apporté aucun avantage, cela se vérifie quand on fait une recherche d'informations sur ce thème.
Certains scientifiques croient devoir conclure par la négative à ce genre de proposition. Selon eux, le silicium ne participerait que peu à des réactions biologiques mais servirait plutôt de support (enveloppes, squelettes, gels). Cependant, le silicium se trouve étroitement associé à l'ADN, à l'intérieur du noyau des cellules donc, pour une fonction qui reste à identifier. Il existe aussi une enzyme dans la paroi des mitochondries qui participe au transport du silicium vers l'intérieur de celles-ci et pourrait être associé au cycle de Krebs.
Enfin, les arguments définitifs qui peuvent remettre en cause la possibilité de l'existence de forme de vie basée sur le silicium sont d'une part l'abondance relative du carbone dans l'univers qui est très largement supérieure à celle du silicium et d'autre part, l'inertie chimique de la silice SiO2, solide, comparativement à la labilité du dioxyde de carbone CO2, gazeux.
Production industrielle du silicium
Le silicium n'existe pas naturellement à l'état libre sur la Terre, mais il est très abondant sous forme d'oxydes, par exemple la silice ou les silicates. Le silicium est extrait de son oxyde par des procédés métallurgiques, et son niveau de pureté dépend de son utilisation finale.
Pureté du silicium

Barreau de silicium de qualité solaire.
On distingue trois niveaux de pureté du silicium, désignés en fonction de l'utilisation :
silicium métallurgique (pureté 99 %), noté MG-silicium (en anglais : metallurgical grade) ;
silicium de qualité solaire (pureté 99,999 9 %), noté SoG-silicium (solar grade) ;
silicium de qualité électronique (pureté 99,999 999 99 %), noté EG-silicium (electronic grade).
Production du silicium métallurgique
Pour obtenir du silicium libre (parfois appelé improprement « silicium métal » pour le distinguer du ferrosilicium), il faut le réduire ; industriellement, cette réduction s'effectue par électrométallurgie, dans un four à arc électrique ouvert dont la puissance peut aller jusqu'à environ 35 MW. La réaction globale de principe est une réaction de carboréduction :
-
-
-
SiO2 + C → Si + CO2.
La réalité est plus complexe, avec des réactions intermédiaires conduisant par exemple à la formation de SiC, de SiO (instable).
En pratique, le silicium est introduit sous forme de morceaux de silice (galets, ou morceaux de quartz filonien), mélangé à des réducteurs tels que le bois, le charbon de bois, la houille, le coke de pétrole. Compte tenu des exigences de pureté des applications finales, la silice doit être relativement pure (faible teneur en oxyde de fer en particulier), et les réducteurs soigneusement choisis (houille lavée par exemple).
Le mélange est déversé dans un creuset de plusieurs mètres de diamètre, où plongent des électrodes cylindriques en carbone (trois le plus souvent) qui apportent la puissance électrique et permettent d'atteindre les très hautes températures dont les réactions recherchées ont besoin (autour de 3 000 °C dans la région de l'arc électrique, à la pointe des électrodes).
Le silicium obtenu est recueilli dans des « poches », à l'état liquide, grâce à des orifices pratiqués dans le creuset: les trous de coulées. La coulée en silicium, à l'inverse du ferrosilicium, est une coulée continue.
Il est ensuite affiné dans ces poches, par injection d'air et d'oxygène pour oxyder l'aluminium et le calcium.
Puis il est séparé du « laitier » (oxydes produits au cours des différentes étapes du procédé et entraînés avec le silicium) avant d'être solidifié :
soit par coulée en lingotières ou sur une surface plane ;
soit par granulation à l'eau (le silicium liquide est alors versé dans de l'eau et les gouttes de silicium se solidifient en petits granules : opération relativement délicate).
Les réactions intermédiaires conduisant à la réduction du silicium produisent aussi une très fine poussière de silice amorphe, qui est entrainée par les gaz chauds (essentiellement air et dioxyde de carbone) émis par le four ; dans les installations modernes, ces gaz sont filtrés pour recueillir cette poussière de silice amorphe, qui est utilisée comme élément d'addition dans les bétons à haute performance.
Selon les applications, le silicium est utilisé sous forme de morceaux (production des alliages aluminium-silicium) ou sous forme de poudre obtenue par broyage (production des silicones).
Le silicium pour électronique est obtenu à partir du silicium électrométallurgique, mais nécessite une étape chimique (purification réalisée sur des silanes) puis un ensemble de purifications physiques, avant le tirage des monocristaux.
Préparation pour l'industrie électronique
Préparation du silicium pur
L'opération s'effectue à partir du trichlorosilane (SiHCI3), ou du tétrachlorure de silicium (SiCl4), ou du tétraiodure de silicium (SiI4), etc. Par exemple, en attaquant du siliciure de cuivre à 300 °C par de l'acide chlorhydrique il se forme du trichlorosilane ; ce corps est purifié par une distillation très poussée ; il est ensuite décomposé à 950 °C en présence d'hydrogène ; on obtient des blocs compacts de silicium très pur (procédé Pechiney).
Préparation du monocristal

Barreau 302 grammes (10,3 cm de long × 4 cm de diamètre) de silicium polycristallin destiné à la production de silicium monocristallin par le procédé Czochralski.

Monocristal de silicium.
On désire obtenir des monocristaux de type N ; or le silicium obtenu chimiquement contient toujours quelques traces de bore et il est de type P ; on le cristallise donc et on le transforme en semi-conducteur de type N.
Principe
On place dans un creuset en quartz une quantité de silicium correspondant sensiblement au poids du monocristal à obtenir ; on ajoute le dopeur donneur d'électrons ; aucune impureté ne doit perturber la cristallisation ; l'opération doit donc se dérouler dans une enceinte hermétiquement close, d'une propreté « chirurgicale », et dans une atmosphère neutre, ou sous vide.
Réalisation
Autour de l'enceinte isolante en quartz est placé l'inducteur d'un générateur haute fréquence qui permet de porter le mélange Si-dopeur à la température de fusion, soit 1 500 °C environ. Lorsque la fusion est totale, l'opération de cristallisation peut commencer ; à cet effet, un système mécanique de précision présente le germe monocristal au contact du bain, puis le soulève verticalement, très lentement, tout en lui imprimant une très lente rotation qui aide à l'homogénéisation. Le germe entraîne le silicium qui se trouve alors soustrait à l'action de l'induction HF ; le Si se refroidit donc et cristallise suivant l'ordonnancement fixé par le germe.
L'opération est très délicate ; la vitesse de levage doit être constante afin de ne pas perturber la formation du cristal ; la température du bain doit être également constante, à 0,1 °C près (et ceci vers 1 500 °C). L'homogénéisation, aidée par les deux mouvements de levage et de rotation, est primordiale ; en effet, à mesure que l'opération progresse, le bain voit sa concentration en impuretés augmenter parce que ces dernières présentent plus d'affinité pour la phase liquide que pour la phase solide.
Le monocristal obtenu se présente sous la forme d'un cylindre à peu près régulier, pouvant atteindre 30 cm de diamètre ; on le sectionne à ses deux extrémités : la tête, qui est très pure, servira de germe pour une opération ultérieure ; le bas, qui risque de ne pas être assez pur, est rejeté.
Préparation des galettes (wafers)
Du fait du prix très élevé du silicium monocristallin, il faut éviter la perte de matière pendant la préparation des galettes (wafers). Le cristal étant très fragile, il faut éviter toute contrainte pouvant les déformer ou les briser. Par ailleurs, l'état de surface des wafers doit être aussi parfait que possible et le traitement ne doit pas « polluer » le monocristal.
Tronçonnage

Wafer de silicium poli.
Le silicium est découpé en galettes (wafers) de 0,2 à 0,3 mm d'épaisseur au moyen d'une scie circulaire diamantée de grande précision. Le travail s'effectue dans l'eau afin d'éviter tout échauffement et toute pollution. Les déchets étant importants, les boues sont filtrées et la poudre de silicium est récupérée et utilisée à nouveau.
Rodage des faces
Il a pour but d'éliminer les irrégularités de surface provoquées par les grains de poudre de diamant lors du tronçonnage ; il s'effectue avec de la poudre de carbure de silicium. Après le rodage mécanique, un rodage chimique vient supprimer les dernières irrégularités sur la couche superficielle qui peut avoir été polluée. À cet effet, on utilise des bains d'acides (acides fluorhydrique et nitrique) ; puis les wafers sont rincées soigneusement et séchées. Cette attaque chimique peut être remplacée ou complétée par un polissage électrolytique.
Découpage des pastilles
On découpe les galettes (wafers) en un très grand nombre de pastilles, avec précision, la largeur du trait de découpe étant aussi faible que possible (0,125 à 0,15 mm). Les bavures de découpage sont ensuite éliminées par attaque chimique suivie d'un rinçage.

 词典释义:
词典释义:
 铁
铁

