Le palladium est un élément chimique de symbole Pd et de numéro atomique 46. Le corps simple fait partie du groupe du platine, ce platinoïde léger et rare fait parfois partie, selon les applications des métaux précieux, c'est un métal noble.
Généralité sur l'élément et histoire de l'élément
Le palladium appartient au groupe 10, nommé groupe du nickel, du tableau périodique des éléments :
Z Élément No. d'électrons/couche 28 nickel 2, 8, 16, 2 46 palladium 2, 8, 18, 16, 2 78 platine 2, 8, 18, 32, 17, 1 110 darmstadtium 2, 8, 18, 32, 32, 17, 1
Mais il possède une configuration très atypique de ses couches électroniques périphériques par rapport au reste des éléments du groupe, mais aussi par rapport à tous les autres éléments (voir aussi le niobium (41), le ruthénium (44) et le rhodium (45)).
Le palladium a été découvert, avec le rhodium, à partir du platine natif brut en 1803 par le médecin et chimiste anglais William Hyde Wollaston. Le nom, donné par Wollaston lui-même l'année suivant sa découverte, dérive de l'astéroïde (2) Pallas découvert le 28 mars 1802 par l'astronome allemand Heinrich W.M. Olbers. Le nom de l'astéroïde fait sans doute référence à la déesse grecque de la sagesse Pallas, épiclèse (surnom) d'Athéna. Le terme palladium, allusion à l'égide protectrice, se place dans cette lignée, tout en honorant en premier lieu la découverte marquante de l'astronome.
Wollaston a découvert le palladium dans du platine brut d'Amérique du Sud en dissolvant le minerai dans l'eau régale, en neutralisant la solution avec de la soude, puis en précipitant le platine sous forme de hexachloroplatinate d'ammonium ((NH4)2PtCl6) par du chlorure d'ammonium. Il a ensuite ajouté du cyanure mercurique pour former le cyanure de palladium, qu'il a finalement chauffé pour extraire le palladium métal.
Le palladium a été à un moment prescrit comme traitement contre la tuberculose en doses de 0,065 g par jour (environ un milligramme par kilogramme de masse corporelle). Mais ce traitement avait de nombreux effets secondaires et a été rapidement remplacé par des médicaments plus appropriés.
L'affinité du palladium pour l'hydrogène l'a amené à jouer un rôle essentiel dans l'expérience de Fleischmann-Pons en 1989.
Isotopes
Le palladium possède 38 isotopes connus, de nombre de masse variant entre 91 et 128, et 16 isomères nucléaires. Parmi ces isotopes, six sont stables, Pd, Pd, Pd, Pd, Pd et Pd, même si le premier et le dernier sont soupçonnés de se désintégrer très lentement par double radiation β, ces désintégrations n'ayant pour l'instant jamais été observées. Ces six isotopes constituent l'ensemble du palladium naturel, dans des proportions allant de 10 à 27 %. On attribue au palladium une masse atomique standard de 106,42(1) u.
Production et occurrence naturelle dans le monde
Il est plutôt rare comme l'atteste le clarke de 0,015 ppm dans la croûte terrestre.
On rencontre le palladium à l'état natif, sous forme de métal natif sous forme assez finement divisée, parfois insérés dans le platine natif ou dans des roches basiques, ou encore en petites masses granulaires. Le minéral, minerai le plus important, est le stibiopalladinite (Pd5Sb2). Notez que l'élément est associé au platine dans la plupart des minerais. Outre les mines et placers de platine ou de platinoïdes, on le trouve aussi dans les mines de nickel et de cuivre.
Du palladium peut aussi être trouvé dans les minéraux rares coopérite (en) et polarite (en). La production mondiale s'élève à environ 267 t en 2011, avec un apport assuré par la Russie à 46 %, par l'Afrique du Sud 35 %, l'Amérique du Nord 15 %. La demande ne serait pas entièrement couverte certaines années. Au début de l'an 2000 la production provenaient parfois à plus de 70 % comme sous-produit des usines russes de nickel, notamment à Norilsk (Russie). En 1990, la production mondiale de l'ordre de 110 t venait essentiellement de l'Afrique du Sud, de la Russie et du Canada.
En 2007, la Russie était le premier exportateur de palladium avec une part mondiale de production de 44 %, suivie par l'Afrique du Sud, 40 %. Le Canada (6 %) et les États-Unis (5 %) sont les seuls autres producteurs signifiants de palladium.
.PNG)
Principaux lieux de production de palladium en 2005.
Le palladium peut être trouvé comme métal libre allié avec l'or et autres métaux du groupe du platine dans des dépôts d'orpaillage dans l'Oural, l'Australie, l’Éthiopie, l'Amérique du Nord et du Sud. Ces dépôts ne jouent toutefois qu'un rôle mineur dans la production de palladium. Les gisements majeurs pour le commerce du palladium sont les dépôts de nickel-cuivre dans le bassin de Sudbury en Ontario et les dépôts de Norilsk–Talnakh en Sibérie. L'autre grand dépôt de métaux du groupe du platine est le dépôt de Merensky Reef (en) qui fait partie du complexe igné du Bushveld en Afrique du Sud. Le complexe igné de Stillwater (en) dans le Montana et le gisement de Roby du complexe igné du Lac des Îles (en) sont les deux autres sources de palladium au Canada et aux États-Unis.
Le palladium est également produit dans les réacteurs de fission nucléaire et peut être extrait du combustible nucléaire irradié même si la quantité produite est minime.
Corps simple, chimie de l'élément et ses combinaisons

Palladium métallique sous forme solide (solidifié à partir de goutte liquide), cliché terni
Description du corps simple métal
Le palladium est un métal blanc argenté ou de couleur acier brillant, parfois gris blanc, malléable et mou, assez semblable au platine. Mais ce platinoïde léger, minéral de maille cubique face centrée pourtant compacte, est le moins dense des métaux du groupe du platine (des autres platinoïdes légers comme le ruthénium et le rhodium, et a fortiori des lourds osmium, iridium et platine) et possède le plus faible point de fusion. Recuit, il est mou et ductile, alors que travaillé à froid, il est plus dur et plus solide. Malléable et très ductile, il peut être travaillé à la forge de façon à relever par écrouissage sa dureté, il est laminable à froid à l'instar de l'or en feuilles très minces de l'ordre du dix millième de millimètre. Le palladium, insoluble dans l'eau et les acides et bases dilués, se dissout très lentement à froid dans les acides sulfurique et chlorhydrique concentrés. Il est soluble dans nitrique ou dans l'eau régale à froid, ainsi que l'acide sulfurique à chaud. Le palladium est stable à l'air, il ne réagit pas avec l'oxygène à température ambiante et par conséquent ne ternit pas à l'air. Par contre, s'il est chauffé au rouge à 800 °C, il s'oxyde en oxyde de palladium(II) PdO. Il ternit légèrement dans une atmosphère humide en présence de soufre.

Assemblage blanc brillant de cristaux quasi-centimétriques de palladium (artifice chimique)
Ce métal, mis sous forme de mousse ou sous forme ultradivisée, possède la capacité rare d'absorber jusqu'à 900 fois son propre volume de dihydrogène à température ambiante. Il est probable que ce soit lié à la formation d'hydrure de palladium(II) (PdH2) mais l'identité chimique d'un tel composé n'est pas encore claire. Quand le palladium a absorbé de grandes quantités d'hydrogène, sa taille augmente sensiblement. Le chimiste dit que le gaz hydrogène fait mousser et gonfler le métal Pd.
Les feuilles de palladium métal sont complètement perméables à l'hydrogène, ainsi que ses tôles ou ses récipients poreux à chaud.

Groupes cristallins millimétriques de palladium (artificiel)
A température ambiante, le noir de palladium adsorbe jusqu'à 1200 fois son volume de gaz dihydrogène. Cette adsorption chimique est remarquable, même si les solutions colloïdales fixent jusqu'à 3000 volumes équivalents.
Tous les corps simples du groupe du Nickel possède un fort potentiel catalytique.
Le palladium métal forment des associations ou alliages avec les autres métaux (Ag, Cu, platinoïdes...), sous l'appellation de palladure de métaux lorsqu'il est majoritaire.
Applications du corps simple et de ces alliages
Ses alliages avec le platine, l'iridium et le rhodium présente une grande dureté recherchée. Il est connu pour ses alliages techniques avec le cuivre. Les alliages PdAgCu sont durs et résistants à la corrosion.
Sa principale utilisation est aujourd'hui dans les convertisseurs catalytiques. Le palladium est également utilisé en bijouterie, en odontologie, en horlogerie, dans les tests de glycémie par bandelette, dans les bougies d'allumage des avions, dans la production d'instruments chirurgicaux et dans la connectique. On trouve aussi du palladium dans les flûtes traversières professionnelles. Il peut aussi être utilisé en laboratoire afin de recouvrir des échantillons et ainsi pouvoir les observer en microscopie électronique en transmission (MET).
La plupart du palladium est utilisé pour quelques applications clé, 2 % seulement de la production étant consacrés à d'autres usages. L'utilisation majeure aujourd'hui est dans les convertisseurs catalytiques. Le palladium est également utilisé en bijouterie, en odontologie, en horlogerie, dans les tests de glycémie par bandelette, dans les bougies d'allumage des avions, dans la production d'instruments chirurgicaux et dans la connectique (secteur électrique et électronique de l'ordre de 15 % de la demande). On trouve aussi du palladium dans les flûtes traversières professionnelles. Certains photographes d'art font aussi leurs tirages sur un papier sensibilisé à la lumière avec du platine et du palladium ; cette alternative aux halogénures d'argent offre un meilleur contrôle du contraste et une exceptionnelle stabilité de l'image.
Avers et revers d'un rouble en palladium frappé en l'honneur du tsar Ivan III en 1989
Par commodité, le lingot de palladium a les codes ISO 4217 des monnaies : XPD et 9**. Seuls trois autres métaux ont de tels codes : l'or, l'argent et le platine. Certains états émettent des pièces de monnaies de prestige ou de collection en palladium, ainsi la Russie valorisant sa grande histoire ou ses arts...
Catalyse
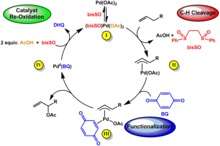
Cycle catalytique de l'acétoxylation allylique
Le palladium est utilisé comme catalyseur pour l'industrie chimique parfois en remplacement du platine (5 % de la consommation mondiale de palladium). En chimie organique, le palladium (le plus souvent à 10 % dispersé sur du charbon actif : palladium sur carbone) est utilisé comme catalyseur d'hydrogénation ou de déshydrogénation. Un exemple est le craquage du pétrole. Un grand nombre de réactions formant des liaisons carbone-carbone, telles que le couplage de Suzuki ou la réaction de Heck, sont facilitées par catalyse au palladium et dérivés. En outre, après dispersion sur des matériaux conducteurs, le palladium se révèle être un excellent électro-catalyseur pour l'oxydation des alcools primaires en milieu alcalin.
Le palladium est également un métal versatile pour la catalyse homogène. La combinaison du palladium avec une grande variété de ligands permet des transformations chimiques hautement sélectives.
Une étude menée en 2008 a montré que le palladium est un catalyseur efficace pour la synthèse de fluorure de carbone.
Le désormais fameux catalyseur de Lindlar est à base de palladium.
Mais le principal secteur consommateur de palladium est l'industrie automobile. Le palladium sert en effet, avec d'autres composés, dans les pots catalytiques à accélérer la transformation des produits toxiques issus de la combustion du carburant en composés moins nocifs : CO2 et eau. Ce secteur consommait en 2006 57 % de la consommation mondiale estimée.
Plaque nanométrique de palladium métal sur wafer (tranche support) de silicium
Électronique
Le deuxième domaine d'application le plus demandeur en palladium est l'électronique et en particulier son utilisation, parfois allié au nickel, dans la fabrication de condensateurs multicouches en céramique et de connecteurs. Ces condensateurs se trouvent dans des composants électroniques grand public : téléphones cellulaires, ordinateurs, télécopieurs, électronique embarquée des véhicules…
Il est également utilisé dans l'électrodéposition de composants électroniques et de matériaux de soudure.
Le secteur de l'électronique consommait 1,07 million d'onces troy (33,2 tonnes) de palladium en 2006 ce qui représente 14 % de la consommation mondiale de palladium, selon une étude de l'entreprise Johnson Matthey.
Technologies
Grâce à son aptitude à capter l'hydrogène, le palladium est utilisé comme électrode dans les piles à combustible. De par sa constitution, le palladium présente une variation de conductivité en fonction du taux d'hydrogène qu'il absorbe dans son réseau cristallin.
L'hydrogène se diffuse facilement à travers le palladium chauffé, ainsi il permet de purifier ce gaz. Des réacteurs à membrane avec des membranes de séparation en palladium sont donc utilisés pour la production d'hydrogène à haut degré de pureté.
Dans les études électrochimiques il est partie intégrante de l'électrode à hydrogène-palladium. Le chlorure de palladium(II), en particulier sous sa forme dihydraté, peut oxyder de grandes quantités de monoxyde de carbone (CO réducteur) et est utilisé dans les détecteurs de monoxyde de carbone. La réaction est équivalente à ː
-
PdCl2 poudre brune + H20 eau liquide ou vapeur d'eau (milieu humide) + C0 gaz toxique léger (émanant d'un chauffage défectueux) → Pd métal divisé en fines particules dit "noir de palladium" + 2 HCl gaz acide léger ou acide en milieu aqueux + CO2 gaz carbonique
Le dichlorure de palladium dihydraté, sel brun rouge à bas point de fusion, sert à fabriquer des fines particules de noir de palladium.
Stockage de l'hydrogène
L'hydrure de palladium(II) correspond au palladium métallique contenant une large quantité d'hydrogène au sein de son réseau cristallin. À température ambiante et pression atmosphérique, le palladium peut absorber jusqu'à 900 fois son volume d'hydrogène gaz, le processus étant réversible. Cette propriété est beaucoup étudiée en raison de l'intérêt porté au stockage de l'hydrogène en vue de son utilisation dans les piles à hydrogène. Une meilleure compréhension des phénomènes rentrant en jeu au niveau moléculaire pourrait aider à la conception d'hydrures métalliques « améliorés » pour le stockage d'hydrogène. Cependant, un stockage fondé uniquement sur le palladium serait trop coûteux en raison du coût élevé du métal.
Odontologie

Boucle de ceinture brillante, obtenue par plaquage de métal palladium
Couronnes dentaires : c'était son utilisation principale avant l'avènement des catalyseurs, sous forme de divers alliages avec le cuivre, l'argent, l'or ou le platine, voire le zinc. C'est encore 14 % de la consommation mondiale.

Plaque fine de palladium en usage en bijouterie-joaillerie (par exemple, préparation de l'or blanc)
Joaillerie
La joaillerie représente 5 % de la consommation mondiale ; le palladium y est utilisé par exemple par plaquage en feuilles ou pour la fabrication de l'or blanc qui est en bijouterie un alliage d'or, de palladium (4 à 5 %) et de nickel (le nickel n'est plus actuellement utilisé dans l'or blanc en raison du risque allergique qu'il représente, il est désormais substitué par un alliage cuivre/argent). Il existe une gamme d'alliage à base d'Au et de Pd (avec des constituant mineur) qualifié d'or blanc par les chimistes ou or gris par les joailliers. Notez que l'or blanc au sens commun est un alliage d'or et de palladium utilisé en dorure à la feuille.
Photographie
Le palladium, moins cher que le platine, est utilisé en photographie. Il donne des tons bruns chauds, alors que les tirages au sel de platine sont gris froid.
Composés du palladium
Les états d'oxydation usuels du palladium sont 0, +1, +2 et +4. Bien qu'à l'origine on pensait que certains composés contenaient du Pd(III), bien qu'aucune preuve n'ait jamais justifié l'existence du palladium au degré d'oxydation +3. Par la suite, de nombreuses études par diffraction des rayons X ont montré que ces composés contenaient un dimère de palladium(II) et de palladium(IV) à la place. Récemment, des composés présentant un état d'oxydation de +6 ont été synthétisés.

Dichlorure de palladium, brun
La palladium existe principalement aux degrés d'oxydation 0, +2 et +4, ce dernier étant plutôt rare. Un exemple étant l'hexachloropalladate(IV). Notons que la valence II n'est nullement ionique et que l'état IV est important. Contrairement à ce qui se constate pour le nickel, il n'existe pas de forme ionique simple, en particulier de cations monoatomiques simples. Il existe à l'instar du Pt un grand nombre de complexes (ions, molécules).
Le palladium corps simple, mou, est réactif. L'attaque par l'oxygène ou les acides forts est, nous l'avons vu, assez facile. Il réagit également assez facilement avec les halogènes, en particulier à chaud vers 500 °C avec le gaz fluor pour donner le triflurorure de palladium PdF3, avec le gaz dichlore au rouge pour donner le chlorure de palladium(II) PdCl2. Ce dernier corps composé non ionique, de structure macromoléculaire linéaire et de maille cristalline cubique, se dissout dans l'acide nitrique et précipite sous forme de acétate de palladium(II) après addition d'acide acétique. Ces deux sels de palladium ainsi que le bromure de palladium(II) sont réactifs et relativement peu coûteux, ce qui fait qu'ils sont très utilisés comme précurseurs dans la chimie du palladium. Tous les trois ne sont pas des monomères, le chlorure et le bromure nécessitent d'être chauffés à reflux dans l'acétonitrile pour obtenir des complexes d'acétonitrile, qui eux sont des monomères très réactifs.
-
PdX2 + 2MeCN → PdX2(MeCN)2 (X=Cl, Br)
Le chlorure de palladium(II) est le principal précurseur de nombreux autres catalyseurs à base de palladium. Il est, entre autres, utilisé pour la préparation de catalyseurs hétérogènes tels que le palladium sur sulfate de baryum, le palladium sur carbone, et le chlorure de palladium sur carbone. Il réagit avec la triphénylphosphine dans des solvants coordinants pour donner le dichlorobis(triphénylphosphine)palladium(II), un catalyseur utile qui peut être formé in situ.
-
PdCl2 + 2PPh3 → PdCl2(PPh3)2
La réduction de ce complexe avec l'hydrazine (N2H4) avec plus de triphénylphosphine donne le tetrakis(triphénylphosphine)palladium(0), un des deux complexes de palladium(0) majeurs.
PdCl2(PPh3)2 + 2PPh3 + 2,5N2H4 → Pd(PPh3)4 + 0,5N2 + 2N2H5Cl
L'autre complexe d'importance du palladium(0), le tris(dibenzylidèneacétone)dipalladium(0) (Pd2(dba)3), est synthétisé par réduction du hexachloropalladate(IV) de sodium en présence de dibenzylidèneacétone.
palladium(0).jpg)
poudre jaune de tetrakis(triphenylphosphine)palladium

Poudre de diacétate de palladium
La très grande majorité des réactions dans lesquelles le palladium joue le rôle de catalyseur sont connues sous le nom de réactions de couplage pallado-catalysées. Des exemples célèbres sont la réaction de Heck, la réaction de Suzuki ou encore la réaction de Stille. Des complexes tels que l'acétate de palladium(II), le tetrakis(triphénylphosphine)palladium(0) ou encore le tris(dibenzylidèneacétone)dipalladium(0) sont souvent utilisés dans de telles réactions, que ce soit en tant que catalyseur, ou comme précurseurs à d'autres catalyseurs. Un problème gênant lors des catalyses au palladium est le risque que ces composés se décomposent à haute température pour donner du palladium métal, soit sous la forme d'un composé noir (« palladium noir »), soit sous la forme d'un « miroir » déposé sur les parois du réacteur.
dipalladium(0).jpg)
Poudre bleu de tris(dibenzylideneacetone)dipalladium
Notons, à côté de l'oxyde {fchim|PdO}}, du sulfure {fchim|PdS}}, des dihalogénures {fchim|PdF|2|}}, {fchim|PdCl|2|}}, {fchim|PdBr|2|}}, {fchim|PdI|2|}} et de leurs éventuels hydrates (tel que {fchim|PdCl|2|.H|2|O}}), l'existence du sulfate de palladium PdSO4 ou de son sulfate dihydraté PdSO4.2 H20, du nitrate Pd(NO3)2, de l'acétate Pd(CN)2, du cyanure de palladium Pd(CN)2, du carbure de palldium. Parmi les complexes, mentionnons avec l'eau [Pd(H20)4] , les chlorures [PdCl4] , l'ammoniac [Pd(NH3)4] , l'ammoniac et divers métaux [Pd(NH3)2 X2]
Analyse
La détection chimique est parfois coûteuse, requérant des quantités appréciables de produit rare. Les méthodes physiques sont communément utilisées, comme le spectre d'émission UV et/ou la fluorescence X parfois susceptible de discriminer avec un bon logiciel un mélange de platinoïdes complexes à environ 10 ppm.
Cinétique environnementale, toxicité, écotoxicité
Les métaux de transition sont de plus en plus utilisés et dispersés dans l'environnement, de manière exponentielle depuis les années 1980 avec les pots catalytiques. Pourtant jusqu'aux années 2000, la toxicité du palladium, son écotoxicité et son comportement dans l'environnement et son métabolisme (bactérien, fongique, végétal, animal ou humain) ne semblaient pas avoir fait l'objet d'études publiées.
À la fin des années 1990, divers indices laissent penser que le palladium semble être beaucoup plus fortement bioconcentré que les autres platinoïdes. Suspectant qu'il commence à contaminer les milieux naturels et écosystèmes. Moldovan & al l'ont cherché chez un isopode d'eau douce considéré comme bon bioindicateur (asellus aquaticus) et fréquent dans les rivières. Les isopodes analysés en contenait effectivement, en quantités faibles mais significatives (quelques nanogrammes par gramme d'échantillons) ainsi que d'autres platinoïdes (teneur moyenne de 155,4 ± 73,4 ng/g de poids sec pour le palladium (Pd) ; 38,0 ± 34,6 ng/g de poids sec pour le platine (Pt) et 17,9 ± 12,2 ng/g de poids sec pour le rhuténium (Rh). Et en laboratoire cette même espèce (A. aquaticus) exposée à une solution standard des 3 platinoides principalement contenus par les pots catalytiques les a bioaccumulés avec un facteur de concentration de 150 pour le palladium, de 85 pour le platine et seulement 7 pour le rhuténium.
Sa mobilité et biodisponibilité ont ponctuellement été évaluées dans le cadre d'études sur une éventuelle bioaccumulation d'éléments du groupe platine (Pt, Pd et Rh) émis, sous forme particulaire par les pots catalytiques ; comme le ruthénium, il s'est avéré plus mobiles que le platine dans l’environnement aquatique (Rauch et al., 2000, cités par IRSN).
Des anguilles européennes ont été exposées 4 semaines à des poussières routières (taux de 10 kg de poussière introduites dans 100 l d'eau, cette poussière contenant des traces de palladium perdu par les pots catalytiques. Après autopsie, les foies et reins des anguilles ont été analysés. Du palladium a été retrouvé, essentiellement dans le foie l'un des principaux organes de détoxication, mais il était sous la limite de détection dans le rein (soit parce que le rein n'en absorbe pas, soit parce qu'il l'évacue très efficacement, ce qui reste à déterminer). le taux moyens en poids humide était dans ce cas et pour le foie de 0,18 ± 0,05 ng/g. D'autres chercheurs ont étudié le palladium en tant qu'antigène chez l'anguille ; montrant que l'effet antigénique est modulé selon l'oxygénation de l'eau. Puis on a étudié la bioaccumulation de platine et de rhodium par des anguilles exposées à des ions Pt4+ et Rh3+ aux concentrations respectives de 170 et 260 μg/l durant 6 semaines ; Après une 6 semaines d'exposition, les taux moyens de Pt (dans la bile, le foie, les reins et l'intestin) variaient de 68 à 840 ng/g alors qu'ils s'échelonnaient de 35 à 155 ng/g pour le Rh (les sujets témoins non exposés présentaient des taux de PGM toujours sous la limite de détection qui était de 50 ng/g pour le Pt et de 5 ng/g pour le Rh (aussi retrouvé dans les branchies et la rate). Aucun PGM n'a été trouvée dans les muscles et le sang de l'anguille (bien que peut-être présent à faible dose sous les limites de détection). Le modèle de distribution des métaux dans les organes de l'anguille différait pour Pt et Rh et était dépendant du type d'eau. Les auteurs ont conclu que les anguilles bioaccumulent effectivement les PGM et pourraient être des indicateurs d'accumulation pour le suivi de la contamination des écosystèmes aquatiques par les PGM, en complément de Dreissena polymorpha.
Sans surprise, les bivalves filtreurs (dont la moule zébrée ou Dreissena polymorpha en eau douce) bioconcentre aussi les PGM. Les tissus mous de ces moules ont accumulé les platinoïdes après exposition dans de l'eau du robinet ou de l'eau humique (selon les lots) et durant (6, 9 ou 18 semaines). Elles avaient accumulé de 720 à 6 300 ng/g de palladium (soit plus que le platine qui avait été bioaccumulé à raison de 780 à 4 300 ng/g. Le ruthénium était lui dosé à 270 à 1 900 ng/g. les moules-témoin non exposée n'en contenaient que moins de 50 ng/g pour le palladium (et moins de 20 ng/g pour le platine (Pt) et moins de 40 ng/g pour le ruthénium (Rh)). Les PGM étaient très nettement plus concentrés par les moules exposées dans l'eau humique (par rapport au groupe exposés dans l'eau du robinet).
C'est un produit qu'on trouve notamment de plus en plus dans la poussière des tunnels routiers, ensuite lessivé avec les eaux ou emporté dans l'air (jusqu'à plusieurs dizaines de picogrammes par mètre cube mesurés en Autriche, avec de nettes variations saisonnières).
Le marché de ce platinoïde ː prix et évolution du cours du palladium
Le métal palladium est coté en US dollar à l'once à la bourse spécialisée des métaux précieux de Londres, en particulier le marché du Pt et Pd, en anglais "London Platinum and Palladium Market" abrégé en LPPM.
Son prix est très variable car intimement lié à l'activité industrielle. Au plus haut en janvier 2001 à plus de 1 000 dollars de l'once, il est tombé à 150 dollars de l'once en avril 2003. Il est remonté à 480 dollars l'once en avril 2008 et a terminé l'année 2008 autour de 175 $/once avant de remonter sensiblement pour atteindre un pic de 850 $/once en 2010 : depuis lors, le cours semble se stabiliser autour de 550 $/once (2014-2015), avec une tendance à la baisse.
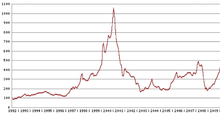
Cours du palladium de 1992 à 2009, montrant la flamblée touchant les platinoïdes au début des années 2000
À l'approche de l'an 2000, l'offre russe de palladium sur le marché mondial a été à maintes reprises retardée et perturbée, et ce, pour des raisons politiques, les quotas d'exportation n'ont pas été accordés à temps. La panique des marchés qui a suivi a conduit le prix du palladium à un niveau record de 36 000 euros le kilogramme, le 26 janvier 2001. À cette époque la Ford Motor Company, craignant des répercussions qu'aurait causée une éventuelle rupture de stock de palladium sur la production automobile, a stocké des quantités colossales du métal à prix fort (la plupart du palladium est utilisé pour les convertisseurs catalytiques dans l'industrie automobile). Lorsque les prix ont chuté début 2001, Ford a perdu près de 1 milliard de dollars. La demande mondiale en palladium a augmenté de 100 tonnes par an en 1990 à près de 300 tonnes par an en 2000. Sachant que la production minière mondiale était de 222 tonnes en 2006 selon les données de l'USGS.

 词典释义:
词典释义:
 )帕拉斯女神塑像;守护人,〈引〉护城圣物
)帕拉斯女神塑像;守护人,〈引〉护城圣物
 保障。
保障。
 ,
,

 ;
; ;
; )帕拉斯女神塑像; <引>护城圣物
)帕拉斯女神塑像; <引>护城圣物







palladium(0).jpg)

dipalladium(0).jpg)
