Une diastase est une glycoside hydrolase qui catalyse l'hydrolyse de l'amidon essentiellement en maltose. Ce terme recouvre à l'origine plusieurs amylases :
α-amylase (EC3.2.1.1), β-amylase (EC3.2.1.2), γ-amylase (EC3.2.1.3),
et tend aujourd'hui à désigner toute hydrolase susceptible de cliver l'amidon en oligomères osidiques. Utilisée en pharmacie, la diastase porte le numéro ATC A09AA01.
L'α-amylase, principale diastase présente chez de nombreux être vivants, dégrade ainsi l'amidon en un mélange de maltose (un diholoside), de maltotriose (un triholoside contenant des résidus de glucose avec des liaisons α(1-4)) et de diverses dextrines (oligosaccharides contenant des ramifications α(1-6)).
La diastase est la première enzyme identifiée, bien que sa nature chimique demeurait encore totalement inconnue — il fallut attendre la première moitié du XX siècle pour que leur nature protéique soit définitivement établie. La découverte de la diastase en 1833 est due à Anselme Payen et Jean-François Persoz, deux chimistes français. Ils forgèrent ce substantif à partir du grec ancien ἡ διάστασις, εως désignant l'action de cliver. Le suffixe -ase dérivé en français de la désinence grecque -ασις, -ασεως a depuis été repris par le biologiste et chimiste français Émile Duclaux (1840-1904) pour désigner les enzymes.

 词典释义:
词典释义:
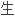 化]淀粉
化]淀粉

 词
词 ;
;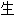 化】淀粉
化】淀粉

